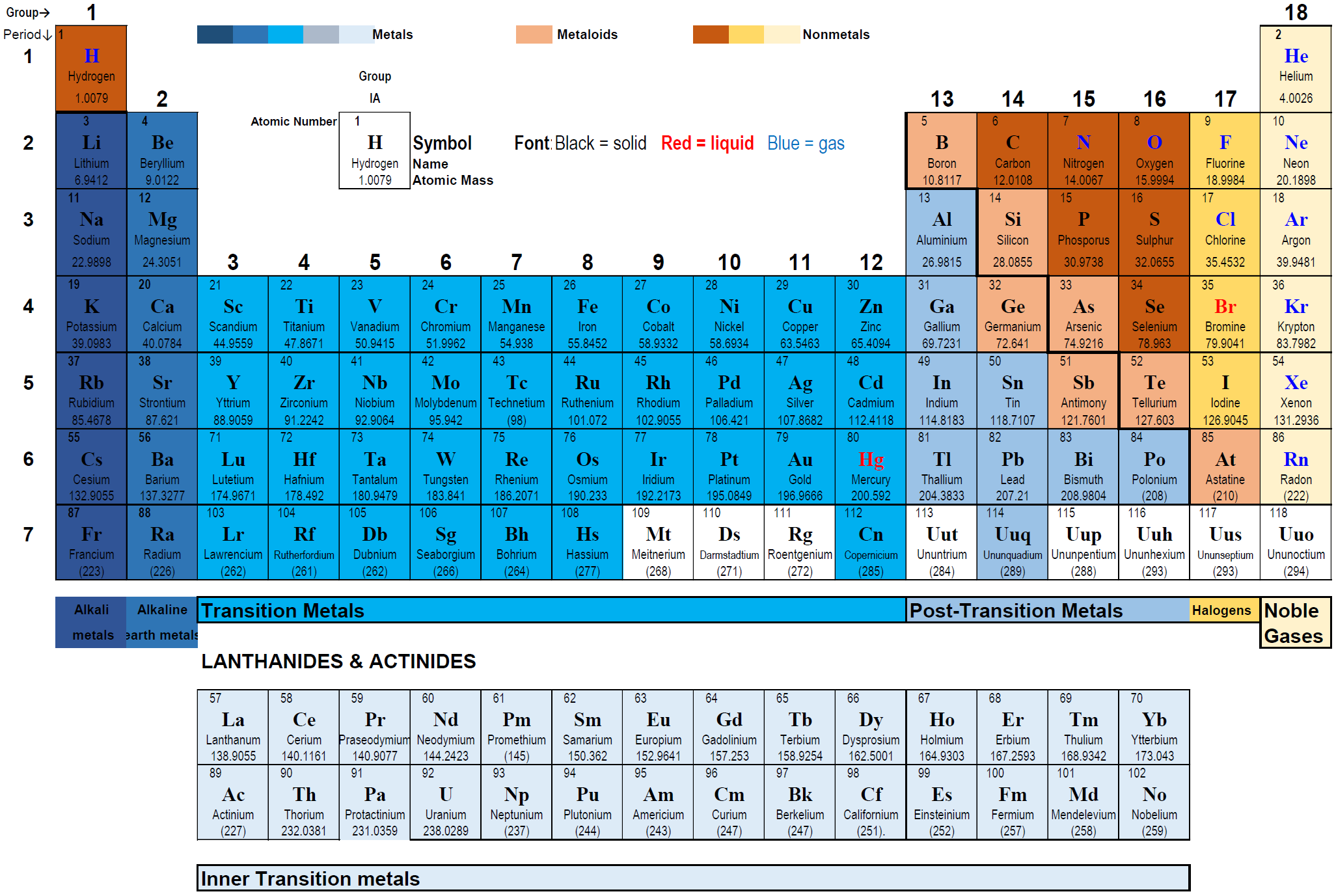
2.4: Таблиця Менделєєва
- Page ID
- 25374
Ранні розробки
Відкриття стихій відбувалися протягом довгого часу. У міру зростання списку відомих елементів вчені намагалися розташувати їх виходячи з їх властивостей. Менделєєв розташував елементи в таблиці на основі атомних мас. Це призвело до того, що елементи, що мають схожі властивості, розміщені поруч один з одним в більшості випадків. У таблиці були навмисно залишені прогалини для елементів, які були передбачені на основі знань з періодичної таблиці, але ще не виявлені.
Було мало винятків, де властивості елементів не узгоджувалися з групою, в яку вони були поміщені на основі їх атомних мас. Мозелі розробив метод вимірювання атомних номерів на основі рентгенівської спектроскопії. Розташування елементів на основі атомного номера замість атомних мас прибирало розбіжності в таблиці Менделєєва.
Сучасна періодична таблиця елементів
- Сучасна періодична таблиця елементів розташовує елементи за зростаючим порядком атомного номера починаючи від атомного номера 1 для Н і закінчуючи атомним номером 118 для Ог, як показано на рис.2.4.1.
- Елементи розташовані в горизонтальних рядках, які називаються періодами та вертикальними стовпцями, які називаються групами.
Періоди
Періодична таблиця має сім горизонтальних рядків, які називаються періодами. Періоди пронумеровані: 1 вгорі до 7 внизу.
- 1-й період має всього два елементи: водень в групі 1 і гелій в групі 18, з проміжком від групи 2 до групи 17.
- 2-й і 3-й періоди мають вісім елементів кожен, заповнюючи групи 1 і 2, а потім групи 13 до 18, залишаючи прогалину від групи 3 до групи 12.
- Періоди 4-го і 5-го періодів мають вісімнадцять елементів, які заповнюються послідовно з групи 1 в групу 18.
- Періоди 6-й і 7-й мають 32 елементи, кожен: перші два в групах 1 і 2, наступні чотирнадцять елементів в окремих рядках під таблицею. Ці два ряди по 14 елементів кожен називаються актинідами і лантаноїдами відповідно. Потім наступні шістнадцять елементів заповнюють групи 3 на 18.
Групи
Періодична таблиця має 18 вертикальних стовпців, які називаються групами або сімействами. Групи нумеруються, починаючи з 1 на крайньому лівому і проходячи до 18 в крайньому правому куті.
1-ю групу називають лужними металами. До лужних металів відносяться літій (Li), натрій (Na), калій (K), рубідій (Rb), цезій (Cs) і францій (Fr), показаний на рис.2.4.2. Найбільш реактивними серед металів у таблиці Менделєєва є лужні метали. Вони енергійно реагують з водою, як показано на рис. 2.4.3.





Малюнок\(\PageIndex{2}\): Лужні метали зліва направо: літій, натрій, калій, рубідій та цезій. Джерело: Томіхандорф у німецькій Вікіпедії, Dnn87 Контактна адреса електронної пошти: Dnn87@yahoo.dk та http://images-of-elements.com/potassium.php.
Водень входить до групи 1, але не входить до лужноземельних металів. Водень є неметалом і має властивості, досить відмінні від лужних металів або будь-якої іншої групи елементів.
2-а група називається лужноземельними металами. До його складу входять берилій (Be), магній (Mg), кальцій (Ca), стронцій (Sr), барій (Ba) та радій (Ra). Вони є реактивними металами, але менш реактивними, ніж лужні метали. Лужноземельні метали надають характерний колір полум'я. Солі лужних металів використовують в рецептурі феєрверку для додання характерних кольорів феєрверку, як показано на рис.2.4.4.

Групи 3 по 12 називаються перехідними металами. Вони включають дорогоцінні метали, такі як золото, срібло, платина та будівельні метали, такі як залізо. Деякі виробляють каталізатори і містяться в ферментах та інших біомолекулах, таких як гемоглобін та хлорофіл.
Група 13 до групи 16 не має унікальної назви. Вони включають неметали вгорі та метали внизу кожної групи, які називаються пост-перехідними металами. Важливі неметали включають вуглець, азот, кисень, фосфор та сірку.
Елементи 17 групи називаються галогенами. До галогенів належать фтор (F), хлор (Cl), бром, йод (I) та астатін (At). Галогени є високореактивними неметалами. Хлор - газ, бром - рідкий, а йод твердий при кімнатній температурі, як показано на рис.2.4.5.

Група 18 називається благородними газами. До них відносяться гелій (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) і радон (Rn). Вони є найменш реактивними з усіх елементів. Благородні гази використовуються для створення інертної атмосфери для хімічних реакцій. Благородні гази також використовуються в системі освітлення через їх хімічно інертної природи, як показано на рис. 2.4.6.

Метали, металоїди та неметали
Метали
Елементи в правому нижньому куті таблиці Менделєєва є металами, крім водню, який є неметалом. Метали мають загальні характеристики, серед яких:
- вони блискучі,
- тверда речовина при кімнатній температурі (крім ртуті, яка є рідкою),
- ковкий (можна забивати в листи) і пластичний (можна втягувати в дроти),
- хороші провідники тепла і електрики, а також
- схильні втрачати електрони і утворювати іонні сполуки, коли вони реагують з неметалами.
Метали групи 1 називаються лужними металами; 2 групи називаються лужноземельними металами, групи 3 до групи 13 називаються перехідними металами, дворядні нижче перехідні метали в таблиці Менделєєва називаються лантаноїдами, а актиніди або внутрішні перехідні метали, і метали з групи 13 до 16 групи називаються пост-перехідними металами. Елементи, відмінні від перехідних або внутрішньо-перехідних металів, тобто елементи груп 1 і 2 і груп 13 - 18, в сукупності називаються основними груповими елементами або представницькими елементами.
Металоїди
Розподільна лінія між металами і неметалами являє собою лінію сходів, що починається від\(\ce{_5B}\) і закінчується на\(\ce{_85At}\). Елементи на сходовій лінії являють собою металоїди крім алюмінію і полонію, які вважаються металами. Металоїди мають властивості між металами та неметалами; наприклад, вони мають помірну тепло- та електропровідність.
Неметали
Елементи у верхньому правому куті таблиці Менделєєва і водню називаються неметалами.
- Неметали зазвичай мають властивості, протилежні металам, наприклад, вони, як правило, не блискучі, крихкі, якщо тверді, і погані провідники тепла і електроенергії.
- Неметали, як правило, утворюють іонні сполуки, приймаючи електрони з металів і роблячи молекулярні сполуки, реагуючи один з одним.
Дві групи в неметалах також мають унікальні назви, тобто група 17 називається галогенами, а група 18 називається благородними газами.
Як правило, лужні метали є найбільш реактивними, за ними йдуть лужноземельні метали, а галогени - найбільш реактивні неметали. Благородні гази - найменш реактивні неметали, також звані інертними газами.
На рис. 2.4.7 наведені приклади металу, металоїда і неметалу.



Елементи, необхідні для життя
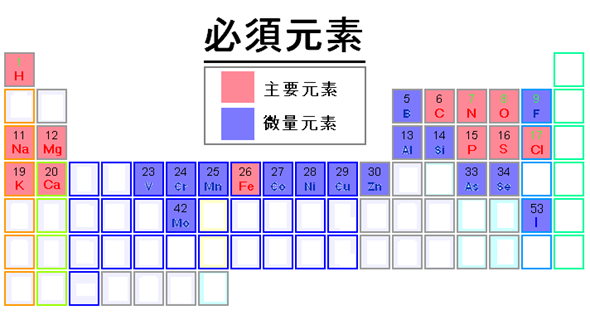
Елементи, які є основними складовими людини та інших живих організмів, є кисень, вуглець, водень, азот, сірка. Фосфор присутній в кістках, зубах та ДНК. Кальцій і магній є основними складовими кісток і зубів і виконують деякі інші функції організму. Катіони натрію і калію є основними електролітами в рідинях організму, а хлорид-аніон врівноважує заряд. Залізо присутній в гемоглобіні, який переносить кисень до клітин. Ці елементи необхідні для життя, і вони є макроелементами. Крім них, кілька інших елементів потрібні в невеликій кількості. Вони необхідні для життя і називаються мікроелементами. На рис. 2.4.8 показані макроелементи рожевого кольору і мікроелементи синього кольору в таблиці Менделєєва.
Фізико-хімічні стани елементів
Елементи в стані газів в умовах навколишнього середовища
Термін молекула зазвичай використовується для електрично нейтральної групи з двох або більше атомів, утримуваних разом хімічними зв'язками. У кінетичної молекулярної теорії газів молекула - це найменша частинка елемента або з'єднання зі стабільним і незалежним існуванням. Атоми благородних газів існують як самостійні види в газовій фазі при кімнатній температурі, тобто як моноатомні молекули типу He, Ne, Ar, Kr, Xe та Rn. Інші елементи, які є газами кімнатної температури або двоатомними молекулами, тобто H 2, N 2, O 2, F 2 і Cl 2, називаються відповідно дигідрогеном, азотом, диоксигеном і дихлором. Зверніть увагу, що зазвичай префікс di не використовується для назви елемента, тобто їх зазвичай називають водень, азот, кисень, фтор і хлор відповідно. Одноатомні види цих елементів, тобто H, N, O, F і Cl, існують, але вони є дуже реактивними формами, званими вільними радикалами, і вони довго не виживають.
Елементи в рідкому стані в умовах навколишнього середовища
Два елементи існують у вигляді рідин при кімнатній температурі, тобто ртуть (Hg), метал та бром (Br 2), не є металом, який існує як двоатомні молекули. Чотири елементи, францій, цезій, галій та рубідій, є твердими металами при 25 o С, але стають рідкими, коли температура трохи тепліша.
Елементи в твердотільному стані в умовах навколишнього середовища
Всі елементи, не згадані в попередніх двох розділах, тверді при кімнатній температурі. Вони можуть бути двоатомними або багатоатомними молекулами, наприклад, I 2, O 3, P 4, S 8, дійодом, озоном, тетрафосфором і октасіркою, з двома або трьома, чотирма і вісьмома атомами відповідно в молекулі.
Аллотропи
Різні форми одного і того ж елемента в одному фізичному стані називаються аллотропами.
Алотропи - це різні структурні модифікації елемента. Наприклад, вуглець існує в декількох аллотропних формах; дві з них показані на рис.2.4.9. Інший приклад - O 2, а O 3 - газоподібні форми кисню.

Елементи, які існують як гігантські молекули
Деякі елементи існують як гігантські молекули, тобто сукупність багатьох атомів, пов'язаних між собою за допомогою 3D-мережі зв'язків. Наприклад, вуглець - гігантська молекула в декількох аллотропних формах, включаючи алмаз, графіт, вуглецеві нанотрубки та фулерени. На рис. 2.4.9 показано склеювання в аллотропах алмазу і графіту. Весь шматок алмазу - це одна молекула з атомами вуглецю, з'єднаними між собою в тривимірну мережу зв'язків.
Метали також існують як сукупність багатьох атомів, пов'язаних між собою металевими зв'язками. Атоми металу існують у вигляді іонів +, розташованих у чітко визначеному тривимірному розташуванні, званому кристалічною решіткою, з деякими з найвіддаленіших електронів, що бродять навколо цілого шматка металу, утворюючи море електронів навколо атомів металу, як показано на рис. 2.4.10.
Елементи в гігантських молекулах і металах представлені символами елементів без будь-якого індексу, наприклад, C - вуглець, Fe - залізо, Au - золото тощо.

