2.5: Електрони в атомах
Електронна структура атома визначає властивості елемента. Знання електромагнітного випромінювання описується спочатку, оскільки воно відіграє важливу роль у розумінні електронної структури атомів.

Електромагнітні випромінювання
Електромагнітні випромінювання - це хвилі, які є коливальними електричними і магнітними полями. Хвиля поширюється в одному напрямку, наприклад, вздовж осі x. Електричне поле коливається перпендикулярно йому, наприклад, вздовж осі y. Магнітне поле коливається перпендикулярно обом, наприклад, вздовж осі z, як показано на рис. 2.5.1. Відстань між двома послідовними максимумами або між будь-якими двома послідовними однаковими фазовими точками уздовж хвилі називається довжиною хвилі (λ, вимовляється «лямбда»). Кількість хвиль, які проходять контрольну точку за одну секунду, називається частотою (ν, вимовляється «ню»). Швидкість електромагнітного випромінювання називається швидкістю світла (в). Швидкість світла - це довжина хвилі та частота виробу, т. Е.
c=λν
Швидкість світла (с) становить 3,00 х 10 8 м/с у вакуумі. Енергія (Е) електромагнітного випромінювання прямо пропорційна частоті, т. Е.
E=hν
, Де h - константа, звана постійною планки. Замінаν наcλ показує, що енергія обернено пропорційна довжині хвилі.
E=hcλ
Рис. 2.5.2 ілюструє діапазон електромагнітних випромінювань, які відрізняються один від одного щодо довжини хвилі, частоти або енергії. Поділ випромінювань на основі їх довжини хвилі дає спектр. Видиме світло являє собою невелику частину спектра електромагнітних випромінювань, як показано на рис. 2.5.2.

Безперервний і лінійний спектр
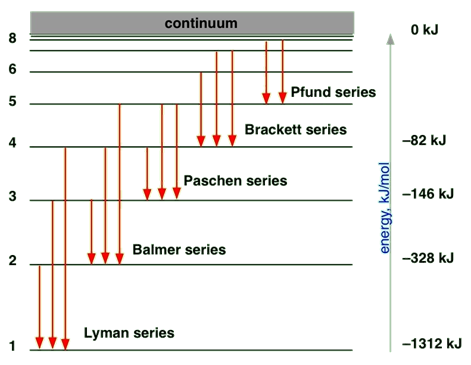
Спектр сонячного світла містить випромінювання всіх довжин хвиль у видимому діапазоні. Спектр, який містить всі довжини хвиль в діапазоні, називається безперервним спектром. Спектр від натрієвих ламп або викидів інших атомів містить лише деякі дискретні довжини хвиль. Спектр, який містить дискретні довжини хвиль, називається лінійним спектром. Наприклад, як показано на рис. 2.5.3, емісія з атома водню є лінійним спектром.


Енергетичні рівні електронів в атомі
Питання в тому, чому атомна емісія має дискретну довжину хвилі або дискретну енергію. Відповідь на це питання прийшла з відкриттів, які прийшли до висновку, що електрон в атомі не має безперервних енергетичних значень; вони мають дискретні енергетичні значення, звані оболонками і підоболонками.
Оболонка
Квантові числа визначають допустимі енергетичні значення електрона в атомі.
- Основне квантове число (n) може мати будь-яке ціле значення, починаючи з 1, тобто 1, 2, 3, 4 тощо.
- Чим менше n, тим нижче енергетичний стан, і чим ближче електрон до ядра, тим щільніше утримується електрон ядром.
- Значення n визначає оболонку, тобто 1-я оболонка має n = 1, 2-я оболонка має n = 2, 3-я оболонка має n =3 і т. Д.
Бор ввів це поняття квантування електронних енергетичних рівнів. Рис. 2.5.4 ілюструє атомну модель Бора.
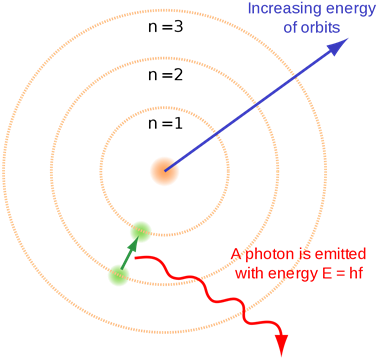
- Коли електрон перескакує з нижньої оболонки на більш високу оболонку, він поглинає електромагнітне випромінювання енергії, рівної енергетичному зазору між початковою і кінцевою оболонкою.
- Коли електрон перескакує з вищої оболонки на нижню оболонку, він випромінює випромінювання, рівне енергетичному зазору між початковою і кінцевою оболонкою.
Рис. 2.5.3 ілюструє випромінювання випромінювання від атомів —це лінійний спектр, оскільки лише дискретні енергетичні рівні, звані оболонками, дозволені електронам в атомі.

Підоболонка
Друге квантове число, зване азимутальним квантовим числом (l), визначає підоболонки всередині оболонки.
Підоболонки зазвичай позначаються як s, p, d, f,...
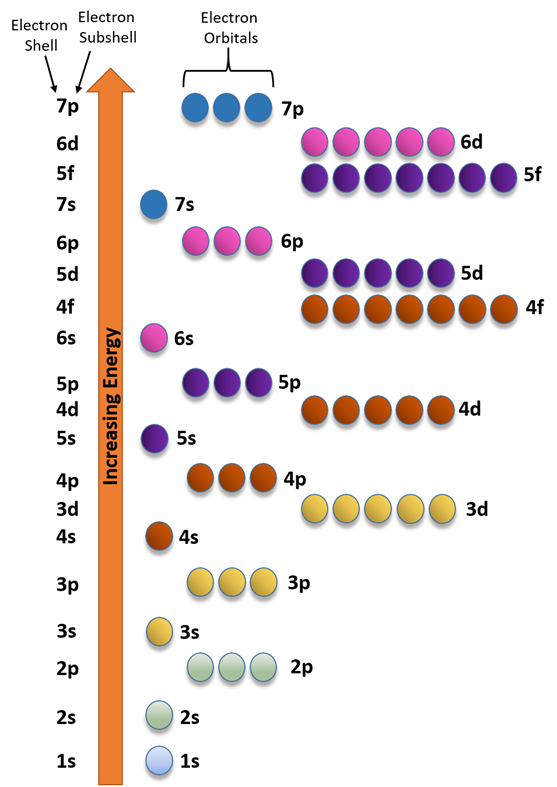
Кожна оболонка має підоболонки, рівні номеру оболонки. Наприклад, 1-й повинен мати тільки одну підоболонку, тобто s. Вона позначається 1s, де число є основним квантовим числом, а буква - підоболонкою. 2-а оболонка має дві підоболонки 2s та 2p; 3-я оболонка має три підоболонки 3s, 3p та 3d; а 4-я оболонка має чотири підоболонки 4s, 4p, 4d та 4f.
Енергетичний порядок підоболонок становить 1s<2s<2p<3s<3p<4s тощо.
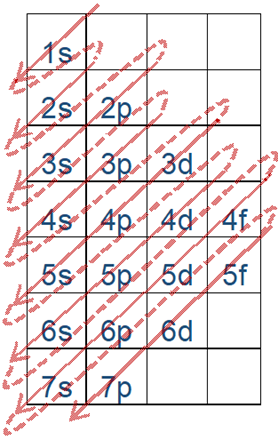
Мал. 2.5.6 допомагає в запам'ятовуванні порядку. Ця цифра малюється розміщенням орбіталів у стовпцях, а номера оболонок у рядках у порядку зростання n зверху вниз, починаючи з 1s орбіталів у першому стовпчику та першому рядку, p орбіталів у другому, d у третьому та f у четвертому. Наповнення електронів слід за стрілками, що йдуть від кута до кута, починаючи з верхнього лівого кута самої верхньої комірки, як описано більш детально в наступному розділі.
Орбітальна - це область в просторі навколо ядра атома, де найімовірніше знайдені електрони.
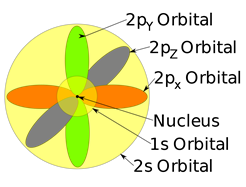
Кожна підоболонка має певну кількість орбіталей в них. Орбіталі мають певну форму і орієнтацію. Підоболонка s має лише одну орбітальну сферично симетричну, як куля з ядром в центрі. 1s орбіталь менше 2s, а 2s менше 3s, але всі вони мають сферично симетричну форму, як показано на рис. 2.5.5. Підоболонка p має три орбіталі. Кожна p орбітальна - це форма гантелі з двома частками, тобто р х орієнтована по осі х, p y по осі y, і p z по осі z, як показано на рис. 2.5.5.
Набір орбіталів, що мають однакову енергію, називається виродженими орбіталями.
Всі три p орбіталі в одній оболонці мають однакову енергію, i, e, 2p x, 2p y, а 2p z - набір вироджених орбіталів. Підоболонка d має п'ять вироджених орбіталей, а f підоболонка має сім вироджених орбіталей, як показано на рис. 2.5.7. Їх форми і орієнтації більш складні і не показані тут.
Електронна конфігурація атомів
Електронна конфігурація - це розподіл електронів на орбіталі атома.
- Кожна орбіталь може приймати максимум два електрони.
- Орбіталі заповнюються в порядку збільшення енергії: найнижча енергія орбіталі заповнюється електронами, перш ніж наступна вища енергія орбіталі почне заповнюватися.
Енергетичний порядок орбіталей становить 1s<2s<2p<3с<3p<4s і так далі, як показано на рис. 2.5.6 і рис.2.5.7.
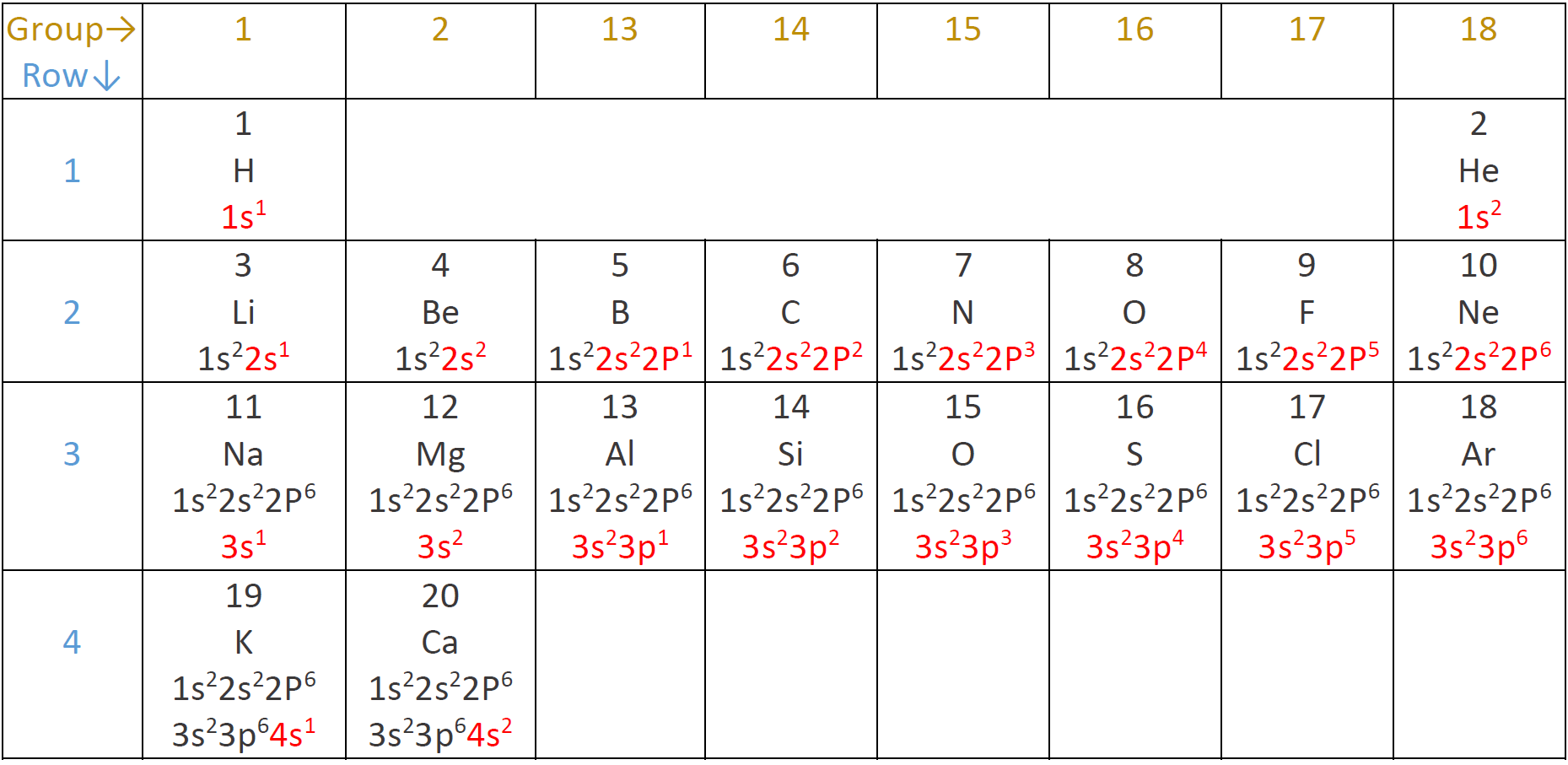
Електронна конфігурація елементів 1-го ряду
Атом водню має один електрон, і він займає 1s орбіталь, тобто 1s 1 представляє електронну конфігурацію атома водню. Верхній індекс у 1s 1 показує кількість електронів у підоболонці. Атом гелію має два електрони, і обидва займають 1 з орбіталі, надаючи гелію електронну конфігурацію 1s 2. Водень і гелій знаходяться в 1-му рядку таблиці Менделєєва і мають 1-ю оболонку, що містить електрони.
Електронна конфігурація елементів 2-го ряду
2-й ряд починається з літію з 3 електронами: перші два займають 1s, а третій займають 2s, що дають літію електронну конфігурацію 1s 2 2s 1. Наступний елемент - берилій з 4 електронами з конфігурацією 1s 2 2s 2. Наступним елементом є бор з 5 електронами і електронна конфігурація 1s 2 2s 2 2p 1. Вуглець має 6 електронів з електронною конфігурацією 1s 2 2s 2 2p 2. Пам'ятайте, що підоболонка s має одну орбітальну і може приймати максимум два електрони, але підоболонка p має три орбіталі і може приймати максимум шість електронів, тобто два на орбіталі. Азот, кисень, фтор і неон мають 7, 8, 9 і 10 електронів і мають електронну конфігурацію 1s 2, 2s 2, 2p 3, 1s 2, 2s 2, 2 p 4, 1s 2, 2s 2, 2 p 5, і 1s 2 2s 2 2p 6, відповідно. Атомний номер від 3 до 10, тобто літій до неону, завершує 2-й ряд.
Сама зовнішня оболонка називається валентної оболонкою, а електрони в валентної оболонці називаються валентними електронами. 1-а оболонка - валентна оболонка для елементів 1-го ряду водню і гелію. Елементи 2-го ряду мають внутрішню оболонку з конфігурацією 1s 2, а валентну оболонку, що містить 2s і 2р заповнюється. Внутрішню оболонку ще називають ядро-оболонкою, а електрони в ядро-оболонці називаються електронами ядра.
Електронна конфігурація елементів 3-го та 4-го ряду
3-й ряд починається з атомного номера натрію 11 і закінчується аргоном атомним номером 18. Електронна конфігурація елементів 3-го ряду повторює малюнок 2-го ряду, тобто набір повних ядро-оболонок 1s 2 2s 2 2p 6, і валентної оболонки, що має 3s або 3p заповнюється. Перші два елементи 4-го ряду - калій і кальцій з атомними номерами 19 і 20, що мають конфігурації 1с 2, 2с, 2, 2р, 6, 3с, 2, 3, 6, 4с 1 і 1с 2, 2, 2с, 6, 3, 3, 6, 4. s 2, відповідно. Електронна конфігурація елементів з атомними номерами понад 20 є більш складною, за участю d і f підоболонки, і вони виходять за рамки цієї книги. На рис. 2.5.8 показана електронна конфігурація перших двадцяти елементів, описаних вище.