2.3: Атоми елементів
- Page ID
- 25372
Символ елемента
Елементи представлені символами, першим алфавітом їх англійської або неанглійської назви, написаним великими літерами. Наприклад, С для вуглецю, N для азоту, а I для йоду. Зазвичай інший алфавіт також вибирається з назви елемента і пишеться маленькою літерою, наприклад, Al для алюмінію, Zn для цинку та Ca для кальцію. Деякі символи елементів походять від неанглійських назв, наприклад, Na для натрію від латинської назви natium, Cu для міді з латинської cupurum і Ag для срібла від латинського Argentum.
Атоми одного елемента мають однакову кількість протонів, а атоми різних елементів мають різну кількість протонів. Іншими словами, кількість протонів в атомі визначає елемент. На даний момент відомо 118 елементів; кількість протонів в атомах варіюється від 1 для водню до 118 для Оганессона (Ог).
Кількість протонів в атомі називається атомним номером.
Атомний номер визначає елемент. Індекс ліворуч від символу елемента представляє атомний номер. Наприклад,\(\ce{ _1H}\) показує один протон в атомі водню і\(\ce{_6C}\) показує 6 протонів в атомі вуглецю.
Кількість протонів плюс кількість нейтронів в атомі - це число маси.
Верхній індекс ліворуч від символу елемента представляє масове число. Наприклад,\(\ce{^1_1H}\) це атом водню з атомним номером 1, масою № 1 і без нейтронів, в той час як\(\ce{^19_9F}\) атом фтору з 9 протонами і 10 нейтронами.
Кількість електронів в атомі дорівнює кількості протонів мінус заряд на атомі.
Кількість електронів дорівнює числу протонів у випадку нейтрального атома, так як на нейтральному атомі немає заряду.
Нейтральний атом може втратити деякі електрони і стати позитивно зарядженою частинкою, званої катіоном.
Заряд представлений у вигляді верхнього індексу з правого боку символу елемента, наприклад\(\ce{^1_1H^+}\), водень без електрона, тобто 1 протон, 0 нейтронів і 0 електронів. \(\ce{^20_40Ca^2+}\)кальцій з двома меншими електронами, ніж протони, тобто 20 протонів, 20 нейтронів і 18 електронів.
Атом може набирати електрони і стати негативно зарядженою частинкою, званої аніоном.
Наприклад,\(\ce{^16_8O^2-}\) кисень з двома електронами більше, ніж протонів на ньому, тобто 8 протонів, 8 нейтронів, і 10 електронів. А\(\ce{^19_9F^-}\) - фтор з на один електрон більше, ніж протонів, тобто 9 протонів, 10 нейтронів і 10 електронів. Рис. 2.3.1 ілюструє посилення або втрату електронів від нейтральних атомів.
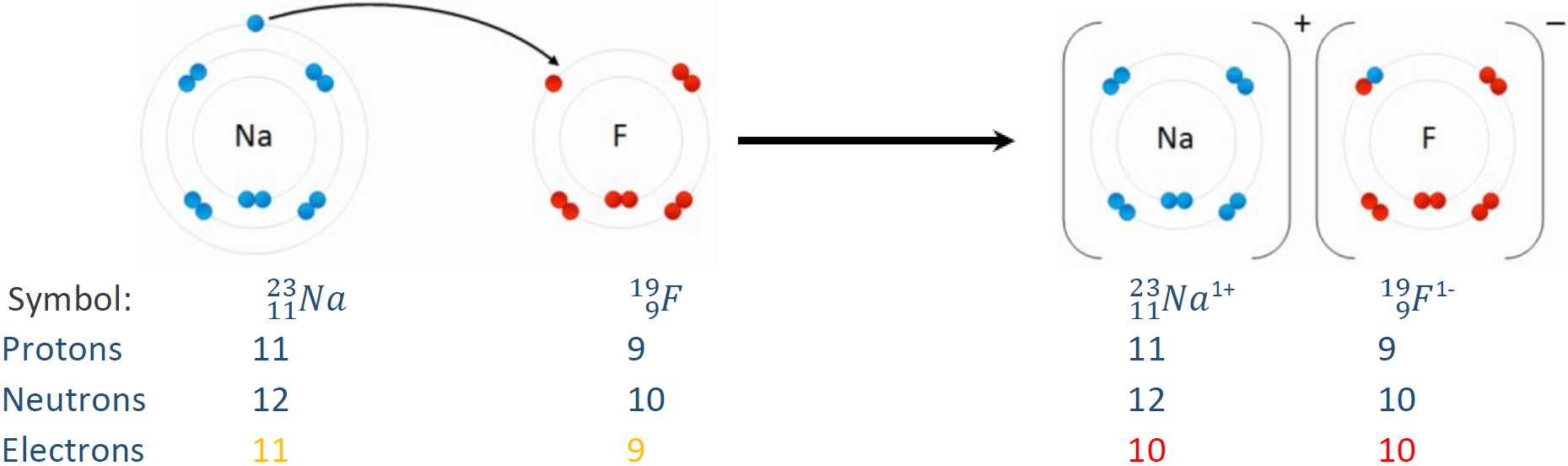
Розрахунок кількості протонів, нейтронів і електронів
В цілому атом гіпотетичного елемента X представлений так,\({ }_{Z}^{A} X^{I ~charge}\) де Z - атомний номер, A - число маси, а I - ціле число, рівне числу заряду і заряду знака числа заряду: + або -.Число протонів, нейтронів, і електронів розраховується за наступними формулами:
Кількість протонів = А,
Кількість нейтронів = A — Z, а
Кількість електронів = Z — (заряд I),
де заряд є + або - знак номера заряду.
Обчисліть кількість протонів, нейтронів і електронів в\(\ce{^16_8O}\)\(\ce{^16_8O^2-}\), і\(\ce{^16_8O^+}\)?
Рішення
\(\ce{^16_8O}\): кількість протонів = Z = 8, кількість нейтронів = A — Z = 16-8 = 8,
і кількість електронів = Z — (заряд I) = 8 — 0 = 8.
\(\ce{^16_8O^2-}\): кількість протонів = Z = 8, кількість нейтронів = A — Z = 16-8 = 8,
і кількість електронів = Z — (заряд I) = 8 - (-2) = 8 + 2 = 10.
\(\ce{^16_8O^1+}\): кількість протонів = Z = 8, кількість нейтронів = A — Z = 16-8 = 8,
і кількість електронів = Z — (заряд I) = 8 — (+1) = 8 — 1 = 9.
Якщо номер заряду I дорівнює 1 в\({ }_{Z}^{A} X^{I ~charge}\), то зазвичай не пишеться, а пишеться число більше одиниці. Наприклад,\(\ce{^16_8O^-}\) має зміну = -1,\(\ce{^16_8O^2-}\) має заряд -2, і\(\ce{^16_8O^+}\) має заряд = +1.
Ізотопи
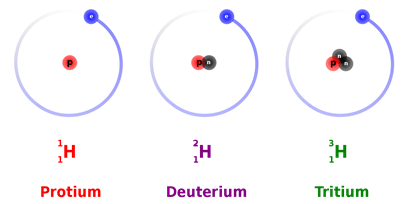
Всі атоми одного елемента мають однакову кількість протонів, але можуть мати різну кількість нейтронів. Наприклад,\(\ce{^1_1H}\),\(\ce{^2_1H}\),\(\ce{^3_1H}\) мають нейтрони, рівні 0, 1 і 2 відповідно.
Атоми одного і того ж елемента, що мають різну кількість нейтронів, називаються ізотопами.
Для прикладів,\(\ce{^1_1H}\),\(\ce{^2_1H}\), і\(\ce{^3_1H}\) наведені ізотопи водню, проілюстровані на рис.2.3.2. Іншим прикладом є\(\ce{^6_3Li}\), і\(\ce{^7_3Li}\) є два ізотопи літію. Природні зразки елементів зазвичай мають майже постійні співвідношення ізотопів. У таблиці 1 наведено деякі ізотопи елементів та їх відсоток достатку в типових природних зразках.
|
Елемент |
Ізотопи |
Достаток (%) |
|---|---|---|
|
Водень |
\(\ce{^1_1H}\) \(\ce{^2_1H}\) \(\ce{^3_1H}\) |
99.99 0,01 Незначний |
|
Літій |
\(\ce{^6_3Li}\) \(\ce{^7_3Li}\) |
7.6 92.4 |
|
Вуглець |
\(\ce{^12_6C}\) \(\ce{^13_6C}\) \(\ce{^14_6C}\) |
98.93 1.07 Незначний |
|
хлор |
\(\ce{^35_17Cl}\) \(\ce{^37_17Cl}\) |
75.78 24.22 |
|
Бром |
\(\ce{^79_35Br}\) \(\ce{^81_35Br}\) |
50.69 49.31 |
|
Уран |
\(\ce{^235_92U}\) \(\ce{^238_92U}\) |
0,72 99.28 |
Атомна маса
Атомна маса, перерахована в таблиці Менделєєва, - це середньозважене значення мас ізотопів, присутніх в природному зразку елемента.
Наступна формула обчислює атомну масу:
\[\text { Atomic mass }=\sum[(\text { mass of isotope }) \times(\text { fractional abuncance of the isotope })\nonumber\]
, Де\(\sum\) означає підсумовування по всіх ізотопах елемента, дробове чисельність ізотопу становить% достатку, поділене на 100. Мал. 2.3.3. ілюструє, як атомна маса занесена в періодичну таблицю.
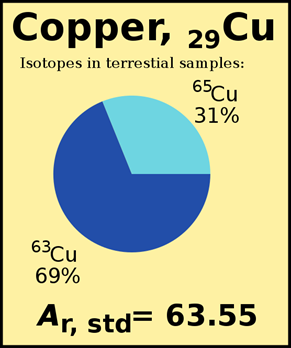
Обчисліть атомну масу хлору з двома ізотопами у зразках природи,\(\ce{^35_17Cl}\) тобто з маси 34,969 аму та%\(\ce{^37_17Cl}\) чисельності 75,78% та маси 36,996 аму та% достатку 24,22%.
Рішення
Формула:\(\text { Atomic mass }=\sum[(\text { mass of isotope }) \times(\text { fractional abuncance of the isotope })\)
Вставте задані значення в формулу і розрахуйте:
\[\left(34.969 \mathrm{~amu} \times \frac{75.78}{100}\right)+\left(36.996 \mathrm{~amu} \times \frac{24.22}{100}\right)=35.45 \mathrm{~amu}\nonumber\]
- Атомні маси ізотопів близькі до, але не збігаються з їх масовими числами. Наприклад,\(\ce{^35_17Cl}\) має масове число mass = 35, але атомна маса цього ізотопу дорівнює 34.969 amu, як показано в наведеному вище прикладі.
- Середньозважена атомна маса зазвичай ближче до масового числа найпоширенішого ізотопу, наприклад, 35.45 amu у наведеному вище прикладі близька до масового числа 35\(\ce{^35_17Cl}\) ізотопу, який є найбільш поширеним ізотопом.
- Періодична таблиця повідомляє атомну масу, розраховану в наведеному вище прикладі, тобто середньозважене значення мас ізотопів, присутніх в природному зразку елемента.
