9.10: Резонанс
- Page ID
- 19141
Це відображення або дверний проріз?
Ви можете подивитися на картинку нижче і подумати, що ви дивитеся на зображення кімнати як відображене в дзеркалі (і ви, ймовірно, є). Але картинку можна обрізати таким чином, щоб створити враження погляду на справжню кімнату через двері. Ви б бачили те саме і отримали ту саму інформацію, але це було б з іншої точки зору. Є молекули, які можуть бути представлені по-різному, таким чином, що реальність стає питанням інтерпретації.
Резонанс
Є деякі випадки, коли для молекули можна намалювати більше однієї життєздатної структури Льюїса. Прикладом може служити\(\left( \ce{O_3} \right)\) молекула озону на малюнку нижче. Всього в структурі 18 електронів, і тому можливі наступні дві структури:
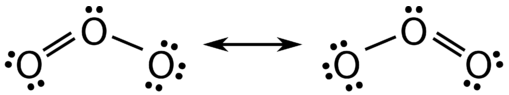
Структура зліва (див. Малюнок вище) може бути перетворена в структуру праворуч шляхом зсуву електронів без зміни положень атомів.
Колись вважалося, що структура такої молекули, як\(\ce{O_3}\) складається з одного єдиного зв'язку та одного подвійного зв'язку, який потім зміщувався вперед і назад, як показано вище. Однак подальші дослідження показали, що дві зв'язки ідентичні. Будь-який подвійний ковалентний зв'язок між двома заданими атомами, як правило, коротший, ніж один ковалентний зв'язок. Дослідження\(\ce{O_3}\) і інших подібних молекул показали, що зв'язки були ідентичні по довжині. Цікаво, що довжина зв'язку знаходиться між довжинами, очікуваними для\(\ce{O-O}\) одного зв'язку та подвійного зв'язку.
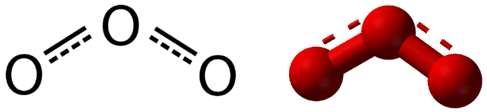
Резонанс - це використання двох або більше структур Льюїса для представлення ковалентного зв'язку в молекулі. Однією з дійсних структур називають резонансну структуру. Зараз зрозуміло, що справжня структура молекули, яка відображає резонанс, - це середня або гібридна всіх резонансних структур. Що стосується\(\ce{O_3}\) молекули, то кожен з ковалентних зв'язків між\(\ce{O}\) атомами найкраще розглядати як «півтора» зв'язку, на відміну від чистого одиночного зв'язку або чистого подвійного зв'язку. Ця «напівзв'язок» може бути показана у вигляді пунктирної лінії як в структурі Льюїса, так і в молекулярній моделі (див. Малюнок нижче).
Багато багатоатомні іони також виявляють резонанс. У деяких випадках справжньою структурою може бути в середньому три допустимі резонансні структури, як у випадку з нітратним іоном\(\ce{NO_3^-}\) (див. Малюнок нижче).
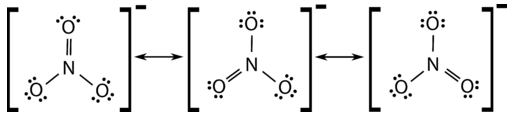
Довжини зв'язку між центральним\(\ce{N}\) атомом і кожним\(\ce{O}\) атомом ідентичні, і зв'язки можуть бути наближені як рівні однієї і однієї третини зв'язків.
Резюме
- Резонансні структури є середніми показниками різних можливостей структури Льюїса.
- Довжини зв'язків є проміжними між ковалентними зв'язками і ковалентними подвійними зв'язками.
Рецензія
- Скільки електронів всього в структурі озону?
- Що змінюється в двох резонансних структурах озону?
- Як ми можемо думати про ковалентні зв'язки в озоні?
