9.11: Винятки з правила октету
- Page ID
- 19129
✅
Чи завжди дотримуються правила?
Щовесни мільйони американців подають свої форми податку на прибуток. Різні правила визначають, скільки податку платить людина. Є й винятки з правил. Ви платите менше податку, якщо ви одружені та/або маєте дітей. Існують певні обмеження на те, скільки грошей ви можете заробити до сплати податків. Правило полягає в тому, що ви платите податки, але є і винятки, виходячи з вашої особистої ситуації. Правила склеювання молекул, як правило, застосовні, але допускаються деякі винятки.
Винятки з правила октету
Як то кажуть, всі правила прийнято порушувати. Коли мова заходить про правило октету, це вірно. Винятки з правила октету діляться на одну з трьох категорій: (1) неповний октет, (2) непарно-електронні молекули та (3) розширений октет.
Неповний октет
У деяких сполуках кількість електронів, що оточують центральний атом в стабільній молекулі, менше восьми. Берилій є лужноземельним металом, і тому можна очікувати утворення іонних зв'язків. Однак його дуже малий розмір і дещо вища енергія іонізації порівняно з іншими металами насправді призводить до утворення берилію в першу чергу молекулярних сполук. Оскільки берилій має лише два валентні електрони, він, як правило, не досягає октету шляхом спільного використання електронів. Структура Льюїса газоподібного гідриду берилію\(\left( \ce{BeH_2} \right)\) складається з двох одиночних ковалентних зв'язків між\(\ce{Be}\) і\(\ce{H}\) (див. Малюнок нижче).
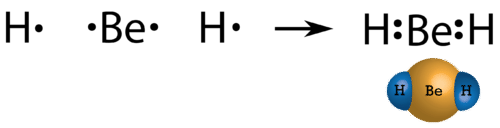
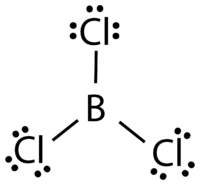
Бор і алюміній, з трьома валентними електронами, також мають тенденцію утворювати ковалентні сполуки з неповним октетом. Центральний атом бору в трихлориді бору\(\left( \ce{BCl_3} \right)\) має шість валентних електронів, як показано на малюнку нижче.
Молекули непарних електронів
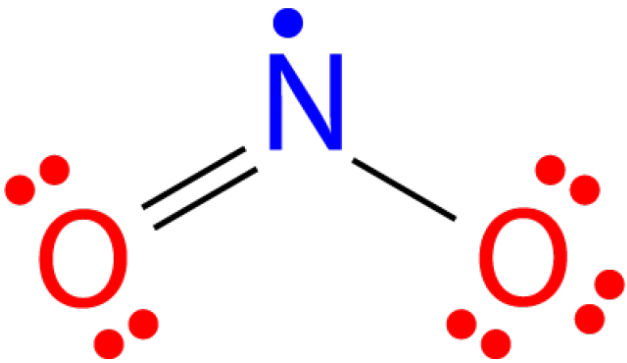
Існує ряд молекул, загальна кількість валентних електронів яких є непарним числом. Не всі атоми в такій молекулі можуть задовольнити правило октету. Прикладом може служити діоксид азоту\(\left( \ce{NO_2} \right)\). Кожен атом кисню вносить шість валентних електронів, а атом азоту вносить п'ять в цілому сімнадцять. Структура Льюїса для\(\ce{NO_2}\) відображається на малюнку нижче.
Розширені октети
Атоми другого періоду не можуть мати більше восьми валентних електронів навколо центрального атома. Однак атоми третього періоду і далі здатні перевищувати правило октета, маючи більше восьми електронів навколо центрального атома. Починаючи з третього періоду,\(d\) підрівень стає доступним, тому можна використовувати ці орбіталі в склеюванні, в результаті чого виходить розширений октет.
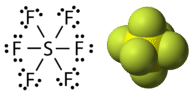
Фосфор і сірка - два елементи, які вступають в реакцію з галогенними елементами і утворюють стійкі сполуки з розширеними октетами. У пентахлориді фосфору центральний атом фосфору робить п'ять одиночних зв'язків з атомами хлору і, як наслідок, має десять електронів, що оточують його (див. Малюнок нижче). У гексафториду сірки центральний атом сірки має дванадцять електронів від шести зв'язків до атомів фтору (див. Малюнок нижче).
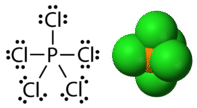
Резюме
- Існують винятки з правил ковалентного склеювання.
- Ці винятки стосуються атомів, електрони яких не будуть вмістити нормальне правило октету.
Рецензія
- Що таке неповний октет?
- Що таке непарно-електронна молекула?
- Чому в розширеному октеті є зайві електрони?