2.2: Ідеальний ґратчастий газ
- Page ID
- 18096
Газова решітка
В описі слабо взаємодіючої рідини, газу, розчину або суміші переважає поступальна ентропія або ентропія змішування. У цьому випадку ми маємо справу з тим, як молекули займають обсяг, що призводить до поступальної функції поділу. Почнемо з визначення решітки та молекул, які заповнюють цю решітку:

Параметри:
Загальний об'єм: Об'єм\(V\)
комірки:\(v\)
Кількість ділянок:\(M = V/v\)
Кількість частинок: Коефіцієнт\(N\ (N \le M)\)
заповнення:\(x = N/M\ (0 \le x \le 1)\)
Кількість контактів кожної комірки з сусідніми комірками:\(z\)
Починаємо з мого припущення, що всі мікростану (конфігурації займаних сайтів в обсязі) однаково вірогідні, т. Е\(E_i = \text{constant}\). Це мікроканонічний ансамбль, тому ентропія рідини задається рівнянням Больцмана
\[S=k_{B} \ln \Omega\]
де\(\Omega\) - кількість мікростанів, доступних системі. Якщо не\(M\) дорівнює\(N\), то перестановки для внесення\(N\) нерозрізнених частинок на\(M\) ділянки задаються біноміальним розподілом:
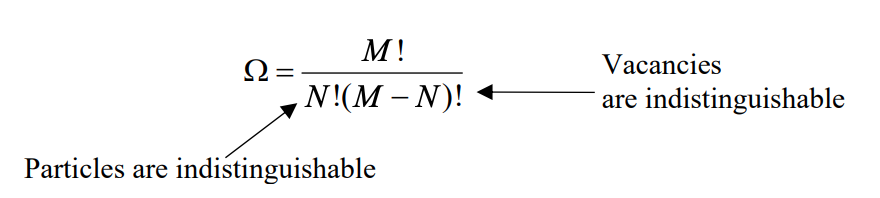
Також на кубічній решітці ми маємо 6 контактів, які кожна комірка робить зі своїми сусідами. Контактний номер є\(z\), який буде відрізнятися за\(2D\ (z = 4)\) і\(3D\ (z = 6)\) проблеми.
Як ми вибираємо розмір\(v\)? Це має розглядатися в кожному конкретному випадку. Мета цих моделей полягає в тому, щоб розглядати клітину як об'єм, який частинка виключає до окупації іншими частинками. Це не повинно відповідати фактичному молекулярному виміру в атомному сенсі. У разі традиційного виведення функції поступального поділу для ідеального газу,\(v\) еквівалентно об'єму квантування\(\Lambda^{3}=\left(h^{2} / 2 \pi m k_{B} T\right)^{3 / 2}\).
З\(\Omega\) ми можемо отримати ентропію змішування\(S = k_B \ln \Omega\) з за допомогою наближення Стерлінга\(\ln (M !) \simeq M \ln (M) - M\):
\[\begin{array} {rcl} {S} & = & {k_B (M \ln M - N \ln N - (M - N) \ln (M - N))} \\ {} & = & {-Mk_B (x \ln x + (1 - x) \ln (1 - x))} \end{array}\]
В останньому рядку ми ввели коефіцієнт заповнення частинок
\[x = N/M \nonumber\]
який кількісно визначає частку клітин, зайнятих частинками, а також відомий як мольна фракція або коефіцієнт упаковки. Так як\(x < 1\), ентропія змішування завжди позитивна.
Для випадку з розведеним розчином або газом\(N \ll M\), і\((1 - x) \approx 1\), так
\[S_{\text{dilute}} \approx -N k_B \ln x \ \ \ \ or \ \ \ \ -nR \ln x\nonumber\]
Ми можемо отримати ідеальний закон газу\(p = Nk_B T/V\) з цього результату, використовуючи термодинамічну ідентичність\(p = T (\partial S / \partial V)_N\).