8.4: Ізотоп достаток
- Page ID
- 26299
Ізотопна достаток.
Існування ізотопів вперше спостерігав Астон за допомогою мас-спектрометра для вивчення іонів неону. При інтерпретації масових спектрів важливо пам'ятати, що відносна атомна маса або атомна маса елемента є середньозваженим показником природних ізотопів. Мас-спектрометри розділяють ці ізотопи, і кожен з них спостерігається при їх відповідному співвідношенні маси до заряду. Відносна чисельність, яка використовується для визначення відносної атомної маси, визначається за допомогою мас-спектрометрії. Хоча це ускладнює масовий спектр, він також надає корисну інформацію для ідентифікації елементів в іоні. Хлор є прекрасним прикладом того, як розподіли ізотопів корисні для інтерпретації. Молекулярна маса хлору становить\(35.45 \mathrm{u}\). Це обчислюється з природного достатку\({ }^{35} \mathrm{Cl}(75 \%)\) і\({ }^{37} \mathrm{Cl}(25 \%)\). Щоб уникнути неоднозначності, молекулярний іон визначається як іон з найбільш часто зустрічаються ізотопами. Для\(\mathrm{CH}_{3} \mathrm{Cl}\) молекулярного іона знаходиться\({ }^{12} \mathrm{C}^{1} \mathrm{H}_{3}{ }^{35} \mathrm{Cl}\) на рівні 50 м/z.
Ізотоп хлору достаток
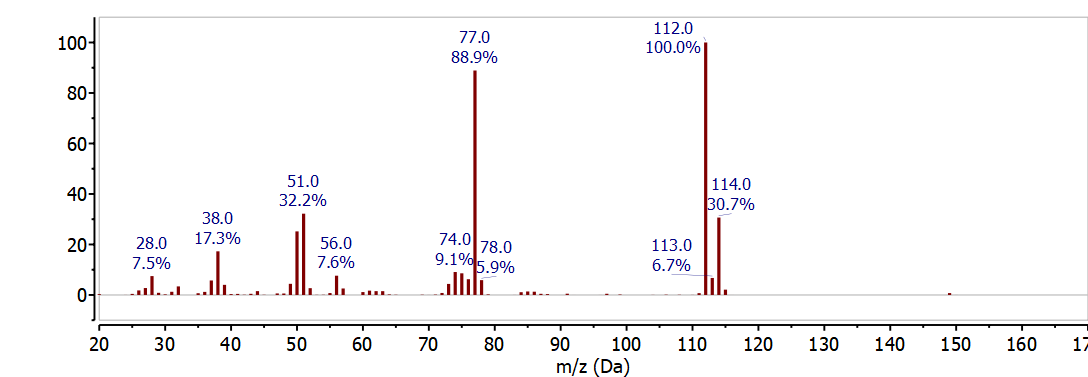
Природна велика кількість цих двох ізотопів спостерігається в масовому спектрі у вигляді двох піків, розділених 2 м/z з відносною інтенсивністю\(3: 1\). Масовий спектр хлорбензолу C 6 H 5 Cl на малюнку\(\PageIndex{1}\) чітко показує розподіл ізотопів хлору при 112 м/z і 114 м/z. Ці піки відповідають молекулярному іону - молекулярний іон має найбільш поширений ізотоп для кожного елемента - при 112 м/з (6x12 + 5x1 + 35) і пік ізотопу 37 Cl при 114 м/з (6x12 + 5x1 + 37), а відносна інтенсивність визначається природною чисельністю 37 Cl ізотоп. Інший великий пік в цьому спектрі при 77 м/з відповідає втраті хлору з молекулярного іона або піку ізотопу 37 Cl, щоб дати C 6 H 5 + (112 - 35 = 77 АБО 114 - 37 = 77).
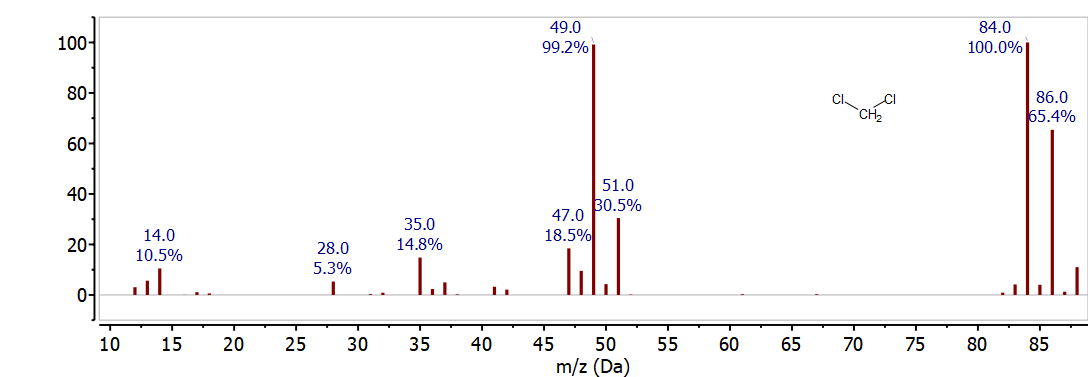
Якщо присутній більше одного атома хлору, то велика кількість ізотопів складніше. Іон з двома атомами хлору має три можливі ізотопні комбінації. Ця закономірність очевидна в масовому спектрі CH 2 Cl 2, показаному на малюнку\(\PageIndex{2}\). Іони спостерігаються для\(\mathrm{CH}_{2}{ }^{35} \mathrm{Cl}_{2}^{+}\) at 84 m/z,\(\mathrm{CH}_{2}{ }^{35} \mathrm{Cl}^{37} \mathrm{Cl}^{+}\) at 86 м/z, і\(\mathrm{CH}_{2}{ }^{37} \mathrm{Cl}_{2}^{+}\) at 88 m/z. Виходячи з ймовірності кожної комбінації ізотопів, відносна інтенсивність цих піків становить\(10: 6: 1\). Співвідношення\(3: 1\) ізотопів для іона з одним атомом хлору спостерігається при 49 м/z і 51 м/z. Це відповідає\(\mathrm{CH}_{2}{ }^{35} \mathrm{Cl}^{+}\) і\(\mathrm{CH}_{2}{ }^{37} \mathrm{Cl}^{+}\) фрагментам, утвореним втратою\(\mathrm{Cl}\) від молекулярного іона. Ретельне дослідження спектра також показує іони, що утворюються при втраті Н • і\(\mathrm{H}_{2}\).
Ізотоп бром достаток
Бром також має два природних ізотопи, 79 Br є найбільш поширеним і 81 Br має відносну кількість 98%, що призводить до відносної інтенсивності для цих двох піків 1:1. Це спостерігається в масовому спектрі бромбензолу, показаному на рис\(\PageIndex{3}\). Візерунок ізотопу брому спостерігається в піках при 156 м/z і 158 м/z, які мають відносну кількість 1:1, характерну для брому. Цим двом пікам відповідають молекулярний іон C 6 H 5 79 Br при 156 м/z і C 6 H 5 81 Br при 158 м/z. Базовий пік в цьому спектрі - від втрати Br до форми C 6 H 5, що спостерігається при 77 м/z.

Вуглець 13 ізотоп пік
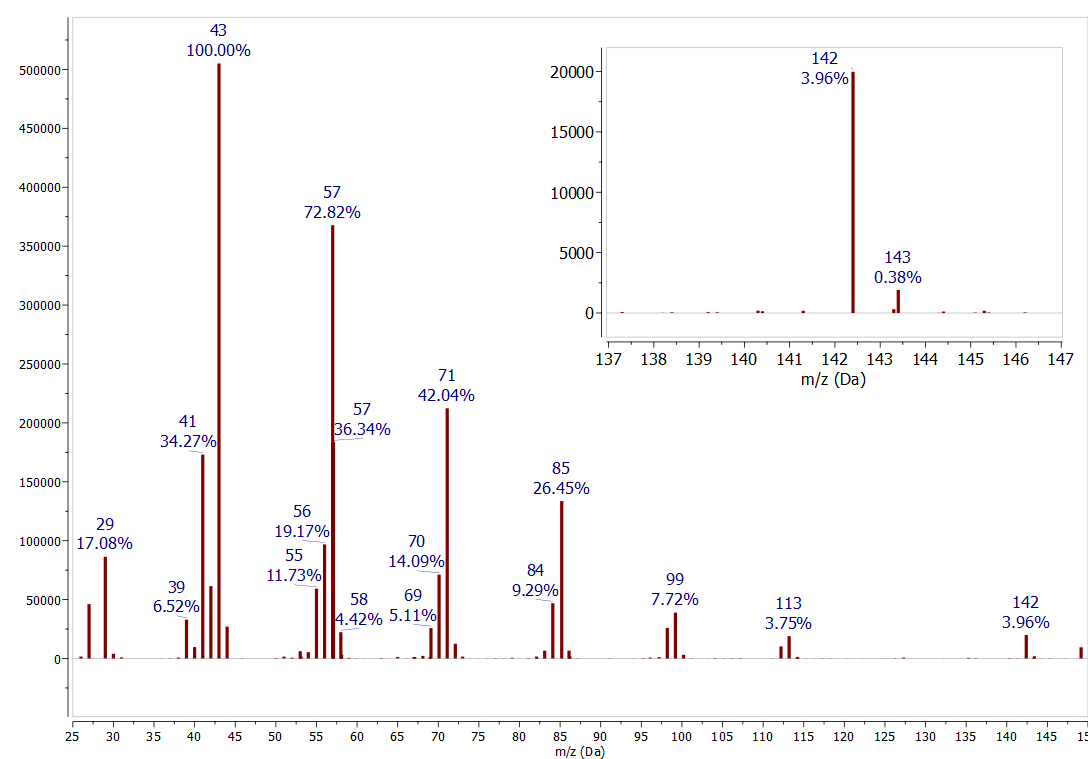
\(1.1 \%\)Природного достатку\({ }^{13} \mathrm{C}\) є ще одним корисним інструментом для інтерпретації масових спектрів. Велика кількість пікового значення на один м/z вище, де\({ }^{12} C\) одиниця замінюється на a\({ }^{13} C\), визначається кількістю вуглецю в іоні. Емпіричне правило для невеликих сполук полягає в тому, що кожен атом вуглецю в іоні збільшує велику кількість\(M+1\) піку на\(1 \%\). Цей ефект простежується у всіх спектрах, розглянутих у цій роботі. Наприклад, в спектрі маси\(n\) -декан (рис.\(\PageIndex{4}\)) Порівняйте пік для\({ }^{12} \mathrm{C}_{9}{ }^{13} \mathrm{C}^{1} \mathrm{H}_{22}\) при 143 м/z (0,38% відносної чисельності) з піковим для\({ }^{12} \mathrm{C}_{10}{ }^{1} \mathrm{H}_{22}\) 142 м/z (3,96% відносно достаток). Велика кількість\(13 \mathrm{C}\) піку - це велика кількість\(10 \%\)\({ }^{12} \mathrm{C}\) піку, що відповідає з'єднанню, що містить 10 атомів вуглецю. Тепер подивіться на деякі попередні спектри, щоб знайти більше прикладів цієї закономірності. Майте на увазі, що для сполук з низькомолекулярними іонними достатками невизначеність при вимірюванні цього співвідношення може становити +/- кілька атомів вуглецю.
Ізотопні достатки
Оскільки всі атоми мають кілька природних ізотопів, обговорювані тут закономірності стають більш складними. На щастя, більшість елементів, поширених в органічній мас-спектрометрії, мають один переважаючий ізотоп. Висока кількість двох ізотопів хлору незвично, тому їх легко визначити. Відносні ряси ізотопів часто зустрічаються елементів наведені в табл\(\PageIndex{1}\). Для молекул з більш складними ізотопними візерунками існує ряд програм і веб-сайтів, доступних для моделювання розподілів. Калькулятор, що надається службами наукових приладів, доступний за адресою: https://www.sisweb.com/mstools/isotope.htm.
| Атом | Ізотоп А | Істопе А+1 | Ізотоп А+2 | |||||
| маси | % | маси | % | маси | % | |||
| Ч | 1 | 100 | 2 | 0,015 | ||||
| C | 12 | 100 | 13 | 1.1 | ||||
| П | 14 | 100 | 15 | 0,37 | ||||
| O | 16 | 100 | 17 | 0,04 | 18 | 0,20 | ||
| F | 19 | 100 | ||||||
| СІ | 28 | 100 | 29 | 5.1 | 30 | 3.4 | ||
| Р | 31 | 100 | ||||||
| S | 32 | 100 | 33 | 0,80 | 34 | 4.4 | ||
| Cl | 35 | 100 | 37 | 32.5 | ||||
| Br | 79 | 100 | 81 | 98.0 | ||||
| Я | 127 | 100 | ||||||