8.2: Фрагментація
- Page ID
- 26306
Фрагментація
Хоча молекулярний іон корисний для ідентифікації, він не дає ніякої структурної інформації про невідоме. Структурна інформація отримана з фрагментаційних патернів масового спектра. Виявлення невідомого без аналізу зразків фрагментації - це все одно, що скласти пазл без малюнка. Шаблони фрагментації часто складні, але вони поєднуються, як шматочки головоломки, щоб визначити структуру молекули.
Після іонізації молекули молекулярний іон зберігає надлишкову енергію іонізації. Якщо ця надлишкова енергія більше енергії, необхідної для розриву хімічного зв'язку, молекула може фрагментуватися. Процеси фрагментації, як правило, класифікуються як пряме розщеплення, де розривається єдиний зв'язок або перестановка, де зв'язки розриваються і створюються одночасно (рис.\(\PageIndex{1}\)).
- Іонізація електронів: ABCD + e - → ABCD +• + 2e -
- Фрагментація:
- Пряме розщеплення ABCD +• → AB + CD •
- Перестановка ABCD +• → AD +• + B=C
Молекулярний іон, утворений електронною іонізацією, є непарним електронним іоном, радикальним видом з непарним електроном. Ці іони утворюються шляхом видалення одиночної пари електрона або зв'язкового електрона з молекули під час іонізації. Наприклад, вода іонізується шляхом видалення незв'язкового електрона з кисню виробляє\(\mathrm{H}_{2} \mathrm{O}^{+1}\). Це приклад непарного електронного іона. Непарні іони електронів мають парну масу до заряду величини. Виняток з цього становить, якщо іон має непарну кількість атомів азоту. Обчисліть масу для заряду для деяких молекулярних іонів, щоб перевірити це твердження.
Коли молекулярні іонні фрагменти шляхом прямого розщеплення один зв'язок розривається з утворенням двох фрагментів. Це зазвичай відокремлює заряд і радикал молекулярного іона. Пряме розщеплення виробляє парний електронний іон, AB +, і нейтральний непарний електронний радикал, CD •. Парний іон електронів виявляється при непарній масі до величини заряду (припускаючи відсутність азоту), і оскільки радикал є нейтральним фрагментом, він не спостерігається в масовому спектрі. Навіть іони електронів мають всі парні електрони. Приклад цього був показаний у масовому спектрі ацетону, де молекулярний іон, CH 3 —CO—CH 3 +•, фрагменти утворюють CO—CH 3 + - парний електронний іон, що спостерігається при 43 м/з. Радикальний СН 3 • має непарну масу, але оскільки він нейтральний, цей фрагмент не спостерігається в масовому спектрі. Можливо перемикання зарядного і радикального виду. В результаті розщеплення CH 3 -CO—CH 3 +• також може утворювати CH 3 +, який є парним електронним іоном, що спостерігається при 15 м/z, непарну масу. Радикал, утворений цим розщепленням, CO—CH 3 •, не спостерігався б. У масовому спектрі ацетону пік 43 м/z набагато більший, ніж пік 15 м/z, тому утворення CO-СН 3 + при 43 м/z явно сприятливе. Коли ви інтерпретуєте масові спектри, шукайте можливі фрагменти розщеплення, але майте на увазі, що будь-який або обидва фрагменти можуть спостерігатися в масовому спектрі.
Перестановки - це більш складні реакції, які передбачають як створення, так і розрив зв'язків. Ці реакції термодинамічно сприятливі, оскільки вимагають менше енергії. Однак вони також вимагають узгодженого механізму, який не настільки кінетично сприятливий у порівнянні з простою реакцією розщеплення. Іони перестановки легко ідентифікуються, оскільки вони спостерігаються як непарні електронні іони з парним значенням m/z. Ці фрагменти часто дають важливі підказки про розташування та ідентичність певних функціональних груп. Перестановки більш детально розглянуті в наступному розділі.
Масові спектри 4 різних\(\mathrm{C}_{4} \mathrm{H}_{10} \mathrm{O}\) ізомерів показані на малюнках 16 - 19. Ці спектри показують, як схеми розщеплення допомагають ідентифікувати структуру сполуки. Важливо пам'ятати, що визначення молекулярної формули - це лише перший крок в інтерпретації масових спектрів.
1-Бутанол
У цей момент дістаємо шматок скретч-паперу, намалюємо точкову структуру Льюїса для 1-бутанолу, знаходимо масу молекулярного іона, розриваємо деякі зв'язки і знаходимо масу деяких можливих фрагментів. Потім подивіться, які з цих фрагментів спостерігаються в масовому спектрі. Ця вправа займе деякий час, але практика допоможе вам навчитися інтерпретувати масові спектри. Після того, як у вас є деякі можливості, погляньте на Малюнок\(\PageIndex{2}\) і подивіться, що ви можете знайти.

Для 1-бутанолу молекулярний іон слід спостерігати при 74 м/з (4х12 + 10х1 + 1х16 = 74). У цьому місці дуже невеликий пік, який не є незвичайними спиртами - і багатьма іншими складовими класами. Якщо ви подивитеся на масові спектри для великої кількості спиртів, ви помітите, що вони часто виявляють мало або зовсім не мають інтенсивності молекулярних іонів. Це робить інтерпретацію їх спектрів складною, а ІЧ-спектри - які дуже чітко показують функціональні групи OH - компліментують масові спектри, допомагаючи ідентифікувати ці функціональні групи. Якщо ви знаєте з ІК, що сполука - це алкоголь, ви можете бути обережними щодо ідентифікації молекулярного іона, знаючи, що його може не спостерігатися.
Далі розглянемо можливе відщеплення фрагментів від молекулярного іона. Однією з можливостей є втрата водню, щоб дати 73 м/z. У масовому спектрі існує невеликий пік у 73 м/z - це вказує на те, що ця фрагментація можлива, але це не є поширеним явищем. Те ж саме справедливо і для втрати ОН • - що спостерігається при невеликому піку в 57 м/з (74 - 17). Наступна втрата - альфа-клеваж, розриваючи зв'язок С-С поруч з функціональною групою ОН, з утворенням СН 2 ОН +, що спостерігається при 31 м/з (СН 2 ОН +) або комплімент, CH 3 CH 2 CH 2 +, спостерігається при 43 м/з. Оскільки заряд може бути збережений будь-яким фрагментом, обидва спостерігаються в спектрі. Альфа-розщеплення є загальною схемою фрагментації спиртів, тому дотримання піку в 31 м/з корисно для ідентифікації первинних спиртів.
Спектр 1-бутанолу також має великий пік на рівні 56 м/z. Це рівний масовий іон, тому він не утворюється при розриві єдиного зв'язку. Дивлячись на втрати від молекулярного іона до цього фрагмента (74 - 56 = 18) - це підказка до ідентичності. Спирти часто зазнають втрати води (Н 2 О - 18 м/з, тому 56 м/з є ймовірним піком для 1-бутанолу. Ця перестановка є сприятливою, оскільки вода дуже стабільна, а отриманий радикальний іон, CH 2 = CH-CH 2 -CH 3 +, має таку ж структуру, що і алкен. Перестановки набагато більш імовірні, коли вони створюють стійкий вид. Інший значний пік у цьому масовому спектрі знаходиться на рівні 41 м/z. Неможливо отримати цю масу від розриву одного зв'язку, тому вона також повинна включати якусь перестановку. Це не є незвичайним для фрагментації та втрати Н 2, щоб цей іон міг утворитися альфа-розщепленням з подальшою втратою Н 2. Оскільки Н 2 є неушкодженою молекулою, ця фрагментація є енергетично сприятливою, хоча вона також вимагає певної перестановки.
2-Бутанол
Наступним спектром для дослідження є 2-бутанол. Перш ніж дивитися на масовий спектр, намалюйте точкову структуру Льюїса для 2-бутанолу і визначте масу можливих фрагментів альфа-розщеплення. Потім порівняйте свої результати зі спектром на малюнку\(\PageIndex{3}\).
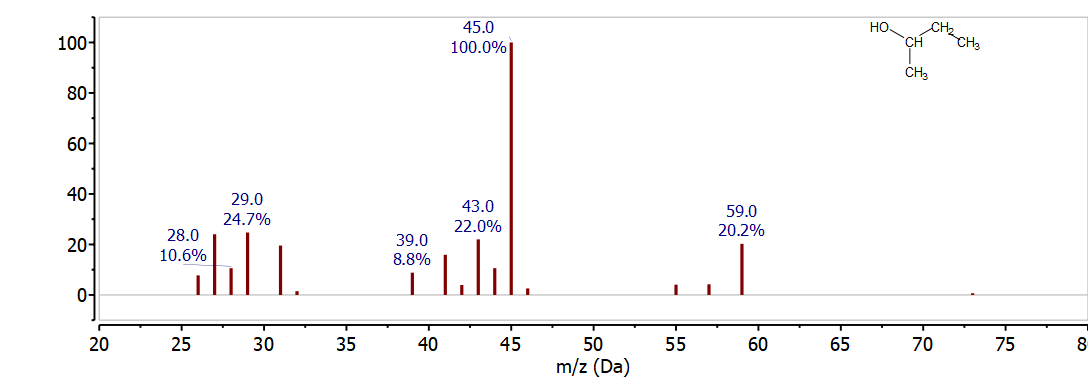
Оскільки 2-бутанол має ту ж молекулярну формулу, що і 1-бутанол, C 4 H 10 O, він також має той же молекулярний іон при 74 м/з. Молекулярний іон не видно на малюнку 17, але в масовому спектрі спостерігається кілька дуже інформативних фрагментних іонів. З аналізу 1-бутанола розумно шукати фрагменти альфа-розщеплення. Оскільки це вторинний алкоголь, існує два можливі місця альфа-розщеплення 2-бутанолу. Альфа-розщеплення може призвести до втрати СН 3 • або С 2 Н 5 • для отримання іонів, що спостерігаються при 59 м/z (74 - 15) і 45 м/z (74 - 29) відповідно. Обидва ці піки спостерігаються на малюнку 17 і їх висока інтенсивність чітко відрізняє цей масовий спектр від 1-бутанолу. Іони компліменту, CH 3 + або C 2 H 5 + спостерігаються при 15 м/z і 29 м/z, але не особливо корисні для ідентифікації, оскільки вони присутні майже у всіх спектрах органічних мас.
2-метил-1-пропанол
Наступним спектром для дослідження є 2-метил-1-пропанол. Перш ніж дивитися на масовий спектр на малюнку\(\PageIndex{4}\), намалюйте точкову структуру Льюїса для 2-метил-1-пропанолу і визначте масу можливих фрагментів альфа-розщеплення. Потім порівняйте те, що ви знайдете, зі спектром нижче.

Оскільки 2-метил-1-пропанол має ту ж молекулярну формулу, що і 1-бутанол і 2-бутанол, C 4 H 10 O, він також має той же молекулярний іон при 74 м/з. Хоча молекулярний іон при 74 м/з не спостерігався в попередніх двох спектрах, він добре видно для 2-метил-1-пропанолу на малюнку 18. Виходячи з обговорення двох попередніх спектрів, ми також повинні шукати фрагменти альфа-розщеплення. Виходячи з структури для 2-метил-1-пропанолу альфа-розщеплення призведе до втрати C 3 H 7 • до утворення CH2OH+, який спостерігається при 31 м/з і характерний для первинного спирту. Іон комплементу С 3 Н 7 + при 43 м/з також спостерігається на малюнку 18. Оскільки С 3 Н 7 + при 43 м/з є вторинним карбокатом, він більш стійкий, ніж іон С 3 Н 7 +, утворений при фрагментації 1-бутанолу. В результаті пік в 43 м/з є базовим піком в спектрі 2-метил-1-пропанолу. Відносна інтенсивність таких піків дуже важлива для розрізнення масових спектрів подібних сполук. Також можна порівняти відносну інтенсивність піків при 31 м/z і 43 м/z в спектрах 1-бутанолу і 2-метил-1-пропанолу.
2-метил-2-пропанол
Наступним спектром для дослідження є 2-метил-2-пропанол. Перш ніж дивитися на масовий спектр, намалюйте точкову структуру Льюїса для 2-метил-2-пропанолу і визначте масу можливих фрагментів альфа-розщеплення. Потім порівняйте те, що ви знайдете зі спектром на малюнку\(\PageIndex{5}\).

Молекулярний іон не спостерігається для 2-метил-1-пропанолу на малюнку 19. Однак пік альфа-розщеплення, що показує втрату CH 3 • при 59 м/z, є базовим піком і набагато рясніший, ніж будь-який інший іон у спектрі. Для цього є дві причини, перша полягає в тому, що в структурі є три різні місця, де альфа-розщеплення призводить до втрати CH 3 •. Тільки це збільшить ймовірність утворення 59 м/з, але додатковим врахуванням є те, що карбокат C 3 H 7 O +, вироблений альфа-розщепленням, є третинним карбокатом. В результаті вона набагато стабільніша і тому рідше піддається подальшій фрагментації.
C 4 Н 10 О Резюме
З спектрів, показаних на малюнках 16-19, видно, що масові спектри для цих чотирьох різних структур C 4 H 10 O легко розрізняються на основі моделей альфа-розщеплення. Вивчення загальних моделей фрагментації для різних функціональних груп дуже корисно для виявлення невідомих і для розрізнення спектрів для подібних сполук.
Толуол
Спектр маси для толуолу показаний на рис\(\PageIndex{6}\). З огляду на стабільність ароматичних сполук, не варто дивуватися тому, що молекулярний іон при 92 м/з має високу інтенсивність. Базовий пік, що спостерігається при 91 м/z, цікавий тим, що втрата H •, як правило, не така інтенсивна. Виявляється, іон тропілію, C 7 H 7 +, теж ароматичний і тому цей фрагмент дуже стійкий і часто має високу інтенсивність.
