8.1: Молекулярний іон
- Page ID
- 26298
Молекулярний іон
Молекулярний іон забезпечує молекулярну масу аналіту і є першою підказкою, яка використовується для інтерпретації масового спектру. Співвідношення маси до заряду молекулярного іона базується на масі найпоширенішого ізотопу для кожного елемента в молекулі. Це не відносна атомна маса з таблиці Менделєєва. Оскільки багато мас-спектрометри мають одиничну роздільну здатність маси, ізотопна маса зазвичай округляється до найближчого цілого числа, це називається номінальною масою. Наприклад, молекулярний іон для ChBr 3 спостерігається при 250 м/z ;( 12 + 1 + 3\(\times\) 79)=250), а не при відносній молекулярній масі 253. Маса молекулярного іона заснована на масі ізотопу з найвищим природним достатком. Найпоширеніший ізотоп брому - 79 Br. Не використовуйте середньозважену атомну вагу для Br (79.9), яка заснована на природному достатку 79 Br і 81 Br. Масовий спектр ChBr 3 включає іони для всіх природних ізотопів, і інтенсивність кожного піку залежить від ймовірності для цієї комбінації ізотопів. Ці закономірності детально розглянуті в розділі, присвяченому достатку ізотопів.
У багатьох масових спектрах молекулярний іон легко ідентифікується як іон з найвищим співвідношенням маси до заряду. Однак це призначення слід робити з обережністю, оскільки найбільшою масою для заряду іона може бути домішкою, ізотопом молекулярного іона або фрагментом. Багато сполук легко фрагментуються, і молекулярний іон не спостерігається в 70 еВ спектрі EI. Важливо уточнити, що молекулярний іон НЕ обов'язково іон з найбільшою кількістю, іон з найбільшою кількістю називається базовим піком. Базовий пік - це пік з найбільшим достатком. Спектр маси зазвичай нормалізується так, щоб цей пік мав інтенсивність 100.
Список характеристик молекулярних іонів наведено в таблиці,\(\PageIndex{1}\) щоб допомогти вам ідентифікувати їх у масовому спектрі. Низька енергія EI, де енергія іонізації знижується, часто зростає в інтенсивності молекулярного іона. Хімічна іонізація, CI, також корисна для ідентифікації молекулярного іона, оскільки іон аддукта часто є більш стабільним, ніж радикальний катіон, вироблений електронною іонізацією. Іон аддукта часто утворюється протонуванням аналіту до утворення\((\mathrm{M}+\mathrm{H})\) and спостерігається при співвідношенні маси до заряду M+1.
| Співвідношення маси до заряду повинно відповідати розумній молекулярній формулі з належною кількістю ізотопів. |
| Більшість сполук мають рівну молекулярну масу. Єдиним загальним винятком з цього є «правило азоту», розглянуте нижче. |
| Правило азоту: Будь-яка сполука з непарною кількістю атомів азоту матиме непарну молекулярну масу. Будь-яке з'єднання з парним числом атомів азоту (включаючи нуль) матиме рівну молекулярну масу. Це пояснюється тим, що азот є єдиним загальним атомом, де найпоширеніший ізотоп має непарну валентність і парну масу. Наприклад: молекулярний іон для СН 4 спостерігається при 16 м/з, молекулярний іон для NH 3 спостерігається при 17 м/з, а молекулярний іон для N 2 H 4 спостерігається при 32 м/з. |
| Якщо піком є молекулярний іон, наступний найбільший масовий фрагмент повинен відповідати втраті можливого нейтрального фрагмента. Наприклад, пік, який відповідає втраті 5 u від молекулярного іона, вкрай малоймовірний |
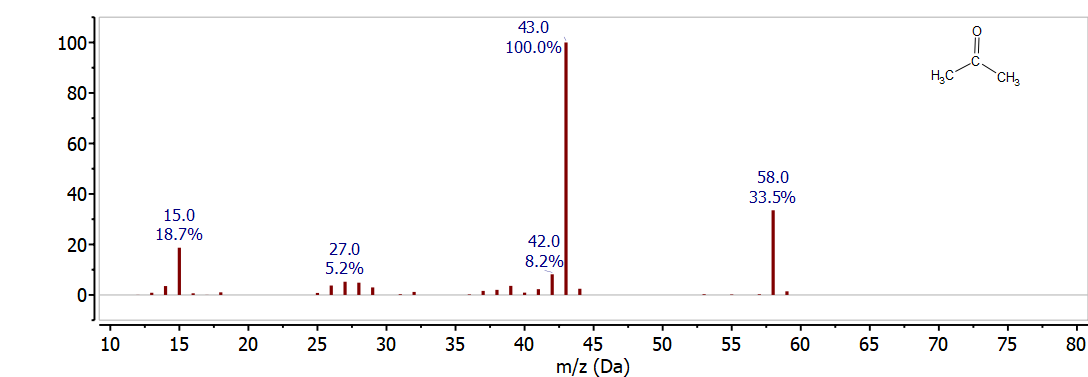
\(\PageIndex{1}\)На малюнку показаний масовий спектр ацетону (CH 3 COCH 3). Молекулярний іон чітко показаний при 58 м/з (12 х 3 + 6 х 1 + 16 = 58). Базовий пік знаходиться на рівні 43 м/z і відповідає втраті 15 м/z від інтактної молекули, це викликано розривом зв'язку C-C для втрати СН 3 • радикала, щоб дати CH 3 CO + при 43 м/z (12 х 2 + 3 х 1 + 16 = 43). Масовий спектр включає в себе і кілька інших незначних піків - пік в 59 м/з обумовлений невеликою кількістю С-13, що дає малій частці молекул ацетону масу 59; пік в 15 м/з обумовлений фрагментом СН 3, що зберігає заряду при розриві зв'язку C-C. Ці фрагментаційні та ізотопні закономірності більш детально розглянуті в наступних розділах.