12.8: Проблеми
- Page ID
- 24912
1. Наступні дані були отримані для чотирьох з'єднань, розділених на 20-метровій капілярній колоні.
| з'єднання | т р (хв) | Вт (хв) |
|---|---|---|
| A | 8.04 | 0,15 |
| Б | 8.26 | 0,15 |
| C | 8.43 | 0,16 |
(а) Обчисліть кількість теоретичних пластин для кожного з'єднання та середню кількість теоретичних пластин для колони, в мм.
(b) Обчисліть середню висоту теоретичної пластини.
(c) Поясніть, чому для кожної сполуки можна мати різну кількість теоретичних пластин.
2. Використовуючи дані з завдання 1, обчислити роздільну здатність і коефіцієнти селективності для кожної пари суміжних сполук. Для роздільної здатності використовуйте як рівняння 12.2.1, так і рівняння 12.3.3 та порівняйте результати. Обговоріть, як ви можете покращити роздільну здатність між сполуками B і C. Час утримання незбереженої розчиненої речовини становить 1,19 хв.
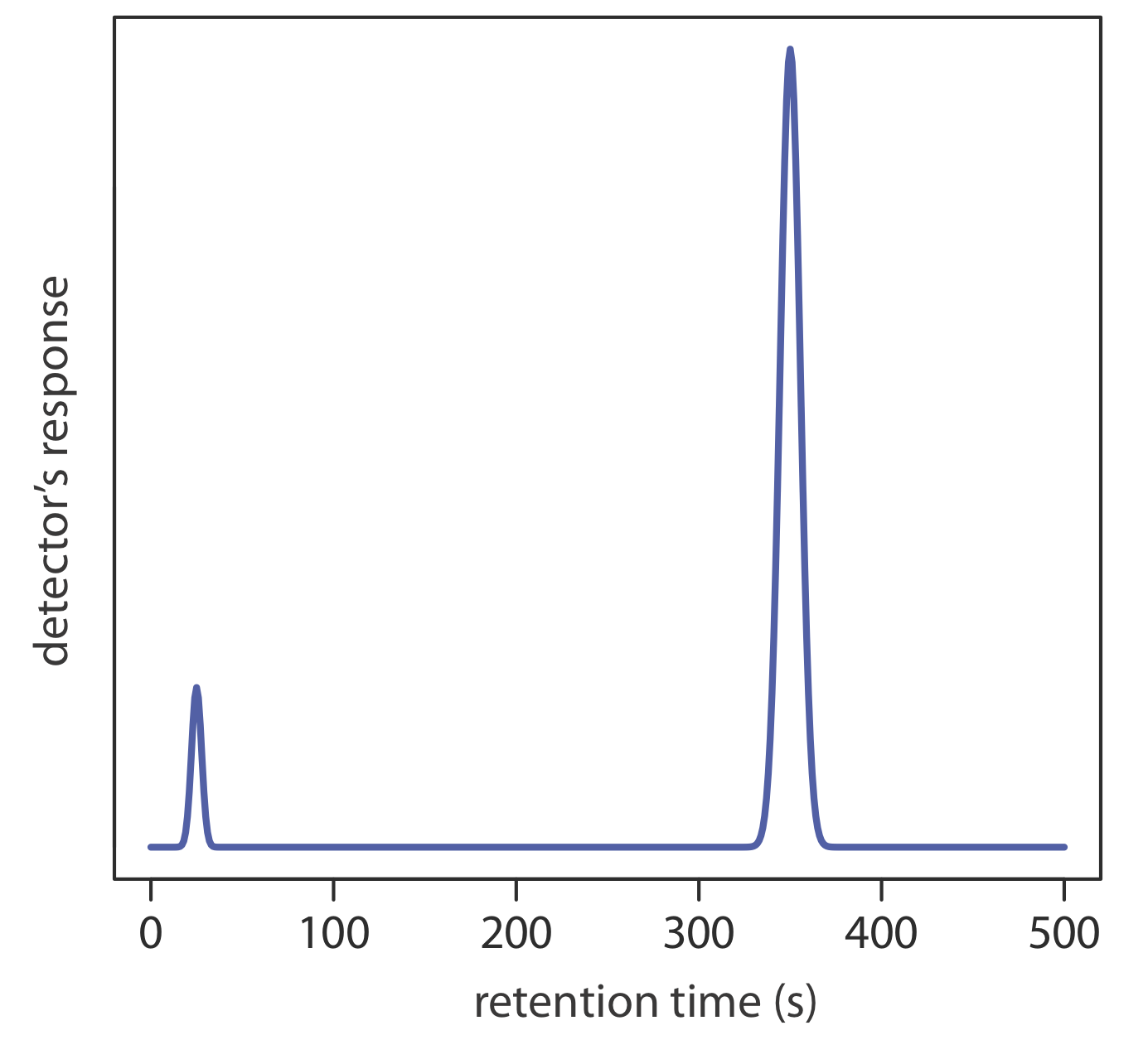
3. Використовуйте хроматограму на рисунку Template:index, отриману за допомогою 2-m стовпця, для визначення значень для t r\(t_r^{\prime}\), w,, k, N та H.
4. Використовуйте часткову хроматограму на малюнку Template:index, щоб визначити роздільну здатність між двома смугами розчинених речовин.
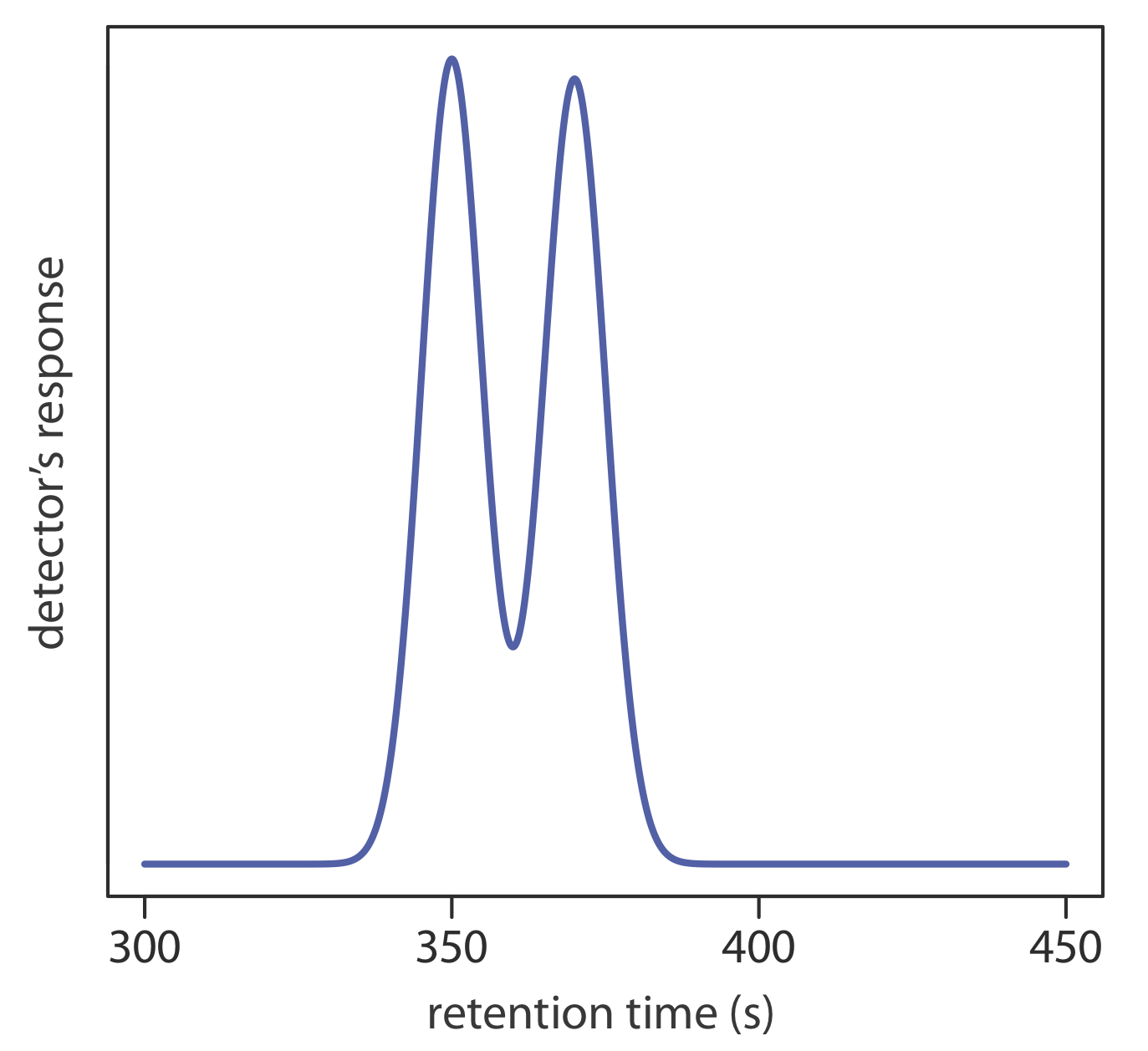
5. Хроматограма в задачі 4 була отримана на 2-м стовпці з часом мертвого відключення колонки 50 с. припустимо, ви хочете збільшити роздільну здатність між двома компонентами до 1,5. Не змінюючи висоту теоретичної плити, яка довжина колони вам потрібна? Яка висота теоретичної плити потрібна для досягнення дозволу 1,5 без збільшення довжини колони?
6. Заповніть наступну таблицю.
| Н Б | \(\alpha\) | к Б | R |
|---|---|---|---|
| 100000 | \ (\ альфа\) ">1.05 | 0,50 | |
| 10000 | \ (\ альфа\) ">1.10 | 1,50 | |
| 10000 | \ (\ альфа\) "> | 4.0 | 1.00 |
| \ (\ альфа\) ">1.05 | 3.0 | 1.75 |
7. Муді вивчав ефективність поділу GC 2-бутанону на колонці, упакованої динонілфталатом [Moody, HW J. Chem. Едук. 1982, 59, 218—219]. Оцінювання висоти пластини як функції швидкості потоку дало рівняння Ван Дімтера, для якого A дорівнює 1,65 мм, B дорівнює 25,8 мм•мл хв —1, а C дорівнює 0,0236 мм•ml —1.
(a) Підготуйте графік H проти u для швидкості потоку між 5 —120 мл/хв.
(b) Для якого діапазону витрат кожен член рівняння Ван Демтера має найбільший ефект?
(c) Яка оптимальна швидкість потоку та відповідна висота теоретичної пластини?
(d) Для відкритих трубчастих колон термін «А» більше не потрібен. Якщо терміни B і C залишаються незмінними, яка оптимальна витрата і відповідна висота теоретичної плити?
(e) У порівнянні з упакованою колоною, скільки ще теоретичних пластин знаходиться в відкритій трубчастої колоні?
8. Hsieh та Jorgenson підготували стовпчики ВЕРХ внутрішнього діаметра 12—33 мкм, упаковані сферичними стаціонарними фазовими частинками 5,44 мкм [Hsieh, S.; Jorgenson, JW Anal. Хім. 1996, 68, 1212—1217]. Для оцінки цих колонок вони вимірювали зменшену висоту плити, h, як функцію зниженої витрати, v,
\[b=\frac{H}{d_{p}} \quad v=\frac{u d_{p}}{D_{m}} \nonumber\]
де d p - діаметр частинок, а D m - коефіцієнт дифузії розчиненої речовини в рухомій фазі. Дані були проаналізовані за допомогою ділянок ван Дімтера. Наступна таблиця містить частину їх результатів для норадреналіну.
| внутрішній діаметр (мкм) | A | Б | C |
|---|---|---|---|
| 33 | 0,63 | 1.32 | 0,10 |
| 33 | 0,67 | 1.30 | 0,08 |
| 23 | 0,40 | 1.34 | 0,09 |
| 23 | 0,58 | 1.11 | 0,09 |
| 17 | 0,31 | 1.47 | 0,11 |
| 17 | 0,40 | 1.41 | 0,11 |
| 12 | 0,22 | 1.53 | 0,11 |
| 12 | 0,19 | 1.27 | 0,12 |
(a) Побудувати окремі графіки Ван Дімтера, використовуючи дані в першому рядку і в останньому рядку для зниження швидкості потоку в діапазоні 0,7—15. Визначити оптимальну витрату і висоту плити для кожного випадку задано d p = 5,44 мкм і D m =\(6.23 \times 10^{-6}\) см 2 с —1.
(b) Термін А в рівнянні ван Дімтера сильно корелює з внутрішнім діаметром колони, причому стовпці меншого діаметру забезпечують менші значення A. Запропонуйте пояснення цьому спостереженню. Підказка: подумайте, скільки частинок може поміститися на капілярі кожного діаметра.
При порівнянні колонок хроматографи часто використовують безрозмірні, зменшені параметри. Включаючи розмір частинок та коефіцієнт дифузії розчиненої речовини, зменшену висоту пластини та зменшену швидкість потоку правильні для відмінностей між пакувальним матеріалом, розчиненою речовиною та рухомою фазою.
9. Суміш n -гептану, тетрагідрофурану, 2-бутанону та n -пропанолу елютується в такому порядку при використанні полярної стаціонарної фази, такої як Carbowax. Порядок елюції точно протилежний при використанні неполярної стаціонарної фази, такої як полідиметилсилоксан. Поясніть порядок елюації в кожному конкретному випадку.
10. Аналіз тригалометанів у питній воді описаний у репрезентативному методі 12.4.1. Єдиний стандарт, який містить всі чотири тригалометани, дає наступні результати.
| з'єднання | концентрація (ppb) | пікова площа |
|---|---|---|
| ЧКЛ 3 | 1.30 | \(1.35 \times 10^4\) |
| ЧКЛ 2 Бар | 0,90 | \(6.12 \times 10^4\) |
| ХКЛ Бр 2 | 4.00 | \(1.71 \times 10^4\) |
| ЧБр 3 | 1.20 | \(1.52 \times 10^4\) |
Аналіз води, зібраної з питного фонтану, дає площі\(1.56 \times 10^4\)\(5.13 \times10^4\)\(1.49 \times 10^4\), і\(1.76 \times 10^4\) для, відповідно, ChCl 3, ChCl 2 Br, ChClBr 2 і ChBr 3. Всі пікові області були виправлені на зміни обсягів впорскування за допомогою внутрішнього стандарту 1,2-дибромопентану. Визначте концентрацію кожного з тригалометанів в пробі води.
11. Чжоу та його колеги визначили %w/w H 2 O в метанолі капілярною колоною GC за допомогою неполярної стаціонарної фази та детектора теплопровідності [Zhou, X; Hines, P. A; White, KC; Borer, MW Anal. Хім. 1998, 70, 390—394]. Серія калібрувальних стандартів дала наступні результати.
| % Вт/ш Н 2 О | пікова висота (арб. одиниць) |
|---|---|
| 0.00 | 1.15 |
| 0.0145 | 2.74 |
| 0.0472 | 6.33 |
| 0.0951 | 11.58 |
| 0,1757 | 20.43 |
| 0,2901 | 32.97 |
(а) Що таке% w/w H 2 O у зразку, який має пікову висоту 8,63?
(б)% w/w H 2 O в ліофілізованому антибіотику визначають наступним чином. Зразок 0,175 г поміщають у флакон разом з 4,489 г метанолу. Вода у флаконі потрапляє в метанол. Аналіз зразка дав пікову висоту 13,66. Що таке %w/w H 2 O в антибіотиці?
12. Локонто та колеги описують метод визначення слідових рівнів води в ґрунті [Loconto, P. R.; Pan, Y.L.; Voice, T. C. LC•GC 1996, 14, 128—132]. Метод використовує перевагу реакції води з карбідом кальцію, CaC 2, для отримання ацетиленового газу, С 2 Н 2. Проводячи реакцію в герметичному флаконі, кількість виробленого ацетилену визначають шляхом відбору проб отвору. При типовому аналізі зразок грунту поміщають в герметичний флакон з СаС 2. Аналіз головного простору дає порожній виправлений сигнал\(2.70 \times 10^5\). Другий зразок готують таким же чином, за винятком того, що додають стандартну добавку 5,0 мг Н 2 О/г грунту, що дає порожній коригований сигнал\(1.06 \times 10^6\). Визначте міліграми Н 2 О/г грунту в зразку грунту.
13. Ван Атта та Ван Атта використовували газову хроматографію для визначення %v/v метилсаліцилату в спирті для протирання [Ван Атта, Р. Е.; Ван Атта, Р.Л. Едук. 1980, 57, 230—231]. Набір стандартних добавок готували шляхом перенесення 20,00 мл протирального спирту в окремі об'ємні колби об'ємом 25 мл і піпеткою 0,00 мл, 0,20 мл і 0,50 мл метилсаліцилату в колби. Всі три колби були розведені до обсягу за допомогою ізопропанолу. Аналіз трьох зразків дав пікові висоти для метилсаліцилату 57,00 мм, 88,5 мм та 132,5 мм відповідно. Визначте %v/v метилсаліцилат в спирті для протирання.
14. Кількість камфори в знеболюючої мазі визначається ГК методом внутрішніх стандартів [Пант, С.К.; Гупта, П.Н.; Томас, К.М.; Maitin, Б.К.; Jain, C. LC•GC 1990, 8, 322—325]. Стандартний зразок готують, поміщаючи 45,2 мг камфори і 2,00 мл внутрішнього стандартного розчину терпену гідрату 6,00 мг/мл в об'ємну колбу об'ємом 25 мл і розбавляючи до об'єму CCl 4. Коли приблизно 2-мкл зразка стандарту вводять, сигнали FID для двох компонентів вимірюються (у довільних одиницях) як 67,3 для камфори та 19,8 для гідрату терпену. 53,6-мг зразок знеболюючої мазі готують до аналізу, помістивши її в 50-мл колбу Ерленмейера разом з 10 мл cCl 4. Після нагрівання до 50 о С на водяній бані зразок охолоджують до температури нижче кімнатної і фільтрують. Залишок промивають двома 5-мл порціями CcL 4 і збирають комбіновані фільтрати в об'ємну колбу об'ємом 25 мл. Після додавання 2,00 мл внутрішнього стандартного розчину вміст колби розводять до об'єму з CCL 4. Аналіз зразка приблизно 2-мкл дає сигнали FID 13,5 для терпенового гідрату і 24,9 для камфори. Повідомте про %w/w камфору в знеболюючій мазі.
15. Концентрація залишків пестицидів на сільськогосподарських продуктах, таких як апельсини, визначається GC-MS [Feigel, C. Varian GC/MS Примітка щодо застосування, № 52]. Залишки пестицидів витягують із зразка за допомогою метиленхлориду і концентрують шляхом випаровування метиленхлориду до меншого обсягу. Калібрування здійснюється за допомогою антрацена-d 10 в якості внутрішнього стандарту. У дослідженні для визначення частин на мільярд епоксиду гептахлору на апельсини подрібнюють і екстрагують 50,00 мл хлориду метилену. Після видалення будь-якого нерозчинного матеріалу фільтрацією метиленхлорид зменшують в обсязі, шипують відомим кількістю внутрішнього стандарту і розводять до 10 мл в об'ємній колбі. Аналіз зразка дає відношення пік-площа (A analyt/A intstd) 0,108. Серія калібрувальних стандартів, кожен з яких містить таку ж кількість антрацену-d 10, що і зразок, дає наступні результати.
| ppb епоксид гептахлору | A аналітик//A intest |
|---|---|
| 20.0 | 0.065 |
| 60.0 | 0.153 |
| 200,0 | 0.637 |
| 500,0 | 1.554 |
| 1000,0 | 3.198 |
Повідомте нанограми на грам залишку епоксиду гептахлору на апельсини.
16. Скориговані терміни утримання октану, толуолу та нонану на певній колонці ГК складають 15,98 хв, 17,73 хв та 20,42 хв відповідно. Який індекс утримання для кожної сполуки?
17. Наступні дані були зібрані для серії нормальних алканів з використанням стаціонарної фази Carbowax 20M.
| алкан | \(t_r^{\prime}\)(хв) |
|---|---|
| пентан | \ (t_r^ {\ прайм}\) (хв) ">0.79 |
| гексан | \ (t_r^ {\ прайм}\) (хв) ">1.99 |
| гептан | \ (t_r^ {\ прайм}\) (хв) ">4.47 |
| октан | \ (t_r^ {\ прайм}\) (хв) ">14.12 |
| нонан | \ (t_r^ {\ прайм}\) (хв) ">33.11 |
Який індекс утримання для з'єднання, скоригований час утримання якого становить 9,36 хв?
18. Наступні дані були повідомлені для газохроматографічного аналізу р -ксилолу та метилізобутилкетону (MIBK) на капілярній колонці [Marriott, PJ; Carpenter, P.D. J. Chem. Едук. 1996, 73, 96—99].
| режим впорскування | з'єднання | т р (хв) | пікова площа (арб. одиниць) | ширина піку (хв) |
|---|---|---|---|---|
| розколоти | МІБК | 1.878 | 54285 | 0,028 |
| р -ксилол | 5.234 | 123483 | 0,044 | |
| безрозщеплений | МІБК | 3.420 | 2493005 | 1.057 |
| р -ксилол | 5.795 | 339656 | 1.051 |
Поясніть різницю у часі утримання, пікових областях та ширині піків при переході від розщепленої ін'єкції до розщепленої ін'єкції.
19. Отто і Вегшейдер повідомляють про наступні фактори утримання для зворотної фази поділу 2-амінобензойної кислоти на колонці C 18 при використанні 10% v/v метанолу в якості рухомої фази [Otto, M.; Wegscheider, WJ Chromatog. 1983, 258, 11—22].
| рН | к |
|---|---|
| 2.0 | 10.5 |
| 3.0 | 16.7 |
| 4.0 | 15,8 |
| 5.0 | 8.0 |
| 6.0 | 2.2 |
| 7.0 | 1.8 |
Поясніть вплив рН на фактор ретенції 2-амінобензолу.
20. Хаддад та партнери повідомляють про наступні фактори утримання для зворотної фази поділу саліциламіду та кофеїну [Haddad, P.; Hutchins, S.; Tuffy, MJ Chem. Едук. 1983, 60, 166-168].
| % v/v метанолу | 30% | 35% | 40% | 45% | 50% | 55% |
| к сал | 2.4 | 1.6 | 1.6 | 1.0 | 0.7 | 0.7 |
| 1 кг каффа | 4.3 | 2.8 | 2.3 | 1.4 | 1.1 | 0.9 |
(а) Пояснити тенденції факторів утримання цих сполук.
(б) У чому перевага використання мобільної фази з меншим метанолом %v/v? Чи є недоліки?
21. Припустимо, вам потрібно розділити суміш бензойної кислоти, аспартама і кофеїну в дієтичній соді. Доступна наступна інформація.
| t r у водній рухомій фазі рН | ||||
| з'єднання | 3.0 | 3.5 | 4.0 | 4.5 |
| бензойна кислота | 7.4 | 7.0 | 6.9 | 4.4 |
| аспартам | 5.9 | 6.0 | 7.1 | 8.1 |
| кофеїн | 3.6 | 3.7 | 4.1 | 4.4 |
(а) Поясніть зміну часу утримання кожної сполуки.
(b) Підготуйте єдиний графік, який показує час утримання проти рН для кожної сполуки. Використовуючи свою ділянку, визначте рівень рН, який дасть прийнятне поділ.
22. Склад полівітамінної таблетки визначається за допомогою ВЕРХ з діодним масивом UV/Vis детектором. Стандартний зразок 5-мкл, який містить 170 ppm вітаміну С, 130 ppm ніацину, 120 ppm ніацинаміду, 150 ppm піридоксину, 60 ppm тіаміну, 15 ppm фолієвої кислоти та 10 ppm рибофлавіну вводять у ВЕРХ, подаючи сигнали (у довільних одиницях) відповідно 0,22, 1,35, 0,90, 1,37, 0,82, 0,36 і 0.29. Полівітамінну таблетку готують до аналізу шляхом подрібнення в порошок і перенесення в колбу Ерленмейера 125 мл, яка містить 10 мл 1% в/в NH 3 в диметилсульфоксиді. Після ультразвукової обробки в ультразвуковій ванні протягом 2 хв додають 90 мл 2% оцтової кислоти і суміш перемішують протягом 1 хв і обробляють ультразвуком при 40 o C протягом 5 хв. Потім екстракт фільтрують через мембранний фільтр 0,45 мкм. Ін'єкція зразка 5-мкл у ВЕРХ дає сигнали 0,87 для вітаміну С, 0,00 для ніацину, 1,40 для ніацинаміду, 0,22 для піридоксину, 0,19 для тіаміну, 0,11 для фолієвої кислоти та 0,44 для рибофлавіну. Повідомте про міліграмах кожного вітаміну, присутнього в таблетці.
23. Кількість кофеїну в таблетці знеболюючого засобу визначали за допомогою ВЕРХ за допомогою нормальної калібрувальної кривої. Стандартні розчини кофеїну готували і аналізували за допомогою контуру введення фіксованого об'єму 10 мкл. Результати за стандартами зведені в наступну таблицю.
| концентрація (проміле) | сигнал (арб. одиниць) |
|---|---|
| 50.0 | 8.354 |
| 100.0 | 16925 |
| 150.0 | 25218 |
| 200,0 | 33584 |
| 250.0 | 42002 |
Зразок готують, помістивши одну таблетку знеболюючого в невелику склянку і додаючи 10 мл метанолу. Давши зразку розчинитися, вміст склянки, включаючи нерозчинне в'яжуче, кількісно переносять в об'ємну колбу об'ємом 25 мл і розбавляють до об'єму метанолом. Потім пробу фільтрують, а 1,00-мл аліквоти переносять в об'ємну колбу об'ємом об'ємом об'ємом 10 мл і розбавляють до обсягу метанолом. При аналізі за допомогою ВЕРХ виявляється, що сигнал для кофеїну становить 21 469. Повідомте міліграми кофеїну в таблетці знеболюючого.
24. Кагель і Фарвелл повідомляють про зворотно-фазовий метод ВЕРХ для визначення концентрації ацетилсаліцилової кислоти (АСК) і кофеїну (CAF) в анальгетичних таблетках з використанням саліцилової кислоти (SA) в якості внутрішнього стандарту [Kagel, R.A.; Farwell, S.O.J. Chem. Едук. 1983, 60, 163—166]. Серію стандартів готували шляхом додавання відомих кількостей ас-тилсаліцилової кислоти і кофеїну в колби Ерленмейера об'ємом 250 мл і додаванням 100 мл метанолу. Потім до кожного додавали 10,00-мл аліквота стандартного розчину саліцилової кислоти. Отримано наступні результати для типового набору стандартних рішень.
| міліграмів | пікові коефіцієнти висоти для | |||
| стандартний | АСА | КАФЕ | АСА/СА | КАФ/СБ |
| 1 | 200,0 | 20.0 | 20.5 | 10.6 |
| 2 | 250.0 | 40.0 | 25.1 | 23,0 |
| 3 | 300,0 | 60.0 | 30.9 | 36.8 |
Зразок анальгетичної таблетки помістили в 250-мл колбу Ерленмейера і розчиняли в 100 мл метанолу. Після додавання 10,00-мл порції внутрішнього стандарту розчин проціджують. Аналіз зразка дав пікове співвідношення висоти 23,2 для ASA і 17,9 для CAF.
(а) Визначити міліграми ASA і CAF в таблетці.
(б) Чому необхідно фільтрувати зразок?
(c) Напрямки вказують на те, що приблизно 100 мл метанолу використовується для розчинення стандартів та зразків. Чому не варто вимірювати цей обсяг точніше?
(d) У присутності вологи ASA розкладається до SA і оцтової кислоти. Яке ускладнення може виникнути для цього аналізу? Як ви можете оцінити, чи це проблема?
25. Боман та його колеги описали зворотно-фазовий метод ВЕРХ для кількісного аналізу вітаміну А в їжі методом стандартних добавок Bohman, O.; Engdahl, K.A.; Johnsson, HJ Chem. Едук. 1982, 59, 251—252]. У типовому прикладі 10.067 г зразка крупи поміщається в 250-мл колбу Ерленмейера разом з 1 г аскорбату натрію, 40 мл етанолу і 10 мл 50% в/в КОН. Після рефлюксу протягом 30 хв додають 60 мл етанолу і охолоджують розчин до кімнатної температури. Вітамін А витягується за допомогою трьох 100-мл порцій гексану. Об'єднані порції гексану випаровують і залишок, що містить вітамін А, переносять в об'ємну колбу об'ємом 5 мл і розбавляють до об'єму метанолом. Стандартна добавка готується аналогічним чином з використанням проби 10,093-г крупи і шипування 0,0200 мг вітаміну А. Ін'єкція зразка і стандартна добавка до ВЕРХ дає пікові площі відповідно\(6.77 \times10^3\) і\(1.32 \times 10^4\). Повідомте про вміст вітаміну А в пробі в міліграмах/100 г крупи.
26. Охта і Танака повідомили про іонообмінний хроматографічний метод одночасного аналізу декількох неорганічних аніонів і катіонів Mg 2 + і Ca 2 + у воді [Ohta, K.; Tanaka, K. anal. Чим. Акт 1998, 373, 189—195]. Рухлива фаза включає ліганд 1,2,4-бензолтрикарбоксилат, який сильно поглинається при 270 нм. Непряме виявлення аналітів можливе, оскільки його поглинання зменшується при комплексі з аніоном.
(а) Процедура також вимагає додавання ліганду ЕДТА до рухомої фази. Яку роль відіграє ЕДТА в цьому аналізі?
(б) Стандартне рішення 1,0 мМ NaHCO 3, 0,20 мМ NaNO 2, 0,20 мМ MgSO 4, 0,10 мМ CaCl 2 та 0,10 мМ Ca (NO 3) 2 дає наступні пікові області (довільні одиниці).
| іон | \(\text{HCO}_3^-\) | Cl — | \(\text{NO}_2^-\) | \(\text{NO}_3^-\) |
| пікова площа | 373.5 | 322.5 | 264,8 | 262.7 |
| іон | Са 2 + | Мг 2+ | \(\text{SO}_4^{2-}\) | |
| пікова площа | 458.9 | 352.0 | 341.3 |
Аналіз проби річкової води (рН 7,49) дає наступні результати.
| іон | \(\text{HCO}_3^-\) | Cl — | \(\text{NO}_2^-\) | \(\text{NO}_3^-\) |
| пікова площа | 310.0 | 403.1 | 3.97 | 157.6 |
| іон | Са 2 + | Мг 2+ | \(\text{SO}_4^{2-}\) | |
| пікова площа | 734.3 | 193.6 | 324,3 |
Визначте концентрацію кожного іона в зразку.
(c) Виявлення\(\text{HCO}_3^-\) фактично дає загальну концентрацію карбонату в розчині ([\(\text{CO}_3^{2-}\)\(\text{HCO}_3^-\)] + [H 2 CO 3]). З огляду на, що рН води дорівнює 7,49, яка реальна концентрація\(\text{HCO}_3^-\)?
(г) незалежний аналіз дає наступні додаткові концентрації для іонів у зразку: [Na +] = 0,60 мМ; [\(\text{NH}_4^+\)] = 0,014 мМ; і [K +] = 0,046 мМ. Іонний баланс розчину визначається як відношення загального катіонного заряду до загального аніонного заряду. Визначте залишок заряду для цього зразка води і прокоментуйте, чи є результат розумним.
27. Концентрації Cl —\(\text{NO}_2^-\), і\(\text{SO}_4^{2-}\) визначаються методом іонної хроматографії. Стандартний зразок 50 мкл 10,0 ppm Cl -, 2,00 ppm\(\text{NO}_2^-\) та 5.00 ppm\(\text{SO}_4^{2-}\) подавав сигнали (у довільних одиницях) 59,3, 16.1 та 6.08 відповідно. Пробу стоків з очисної споруди розводять в десятки разів і 50-мкл порція подає сигнали 44,2 для Cl -, 2,73 для\(\text{NO}_2^-\), і 5,04 для\(\text{SO}_4^{2-}\). Повідомте про частини на мільйон для кожного аніону в зразку стоків.
28. Ряд стандартів полівінілпіридину різної молекулярної маси проаналізовано методом виключеної за розмірами хроматографії, що дало наступні результати.
| формула вага | обсяг утримання (мл) |
|---|---|
| 600000 | 6.42 |
| 100000 | 7.98 |
| 30000 | 9.30 |
| 3000 | 10.94 |
При аналізі препарату полівінілпіридину невідомої формули маси ретенційний обсяг становить 8,45 мл. Повідомте середню формулу ваги для препарату.
29. Дієтичні безалкогольні напої містять помітну кількість аспартама, бензойної кислоти, кофеїну. Який очікуваний порядок елюції для цих сполук при поділі електрофорезу капілярної зони з використанням буфера рН 9,4, враховуючи, що аспартам має р К а значення 2,964 і 7,37, бензойна кислота має р К а 4,2, а р К а для кофеїну менше 0. Рисунок Template:index надає структури цих сполук.
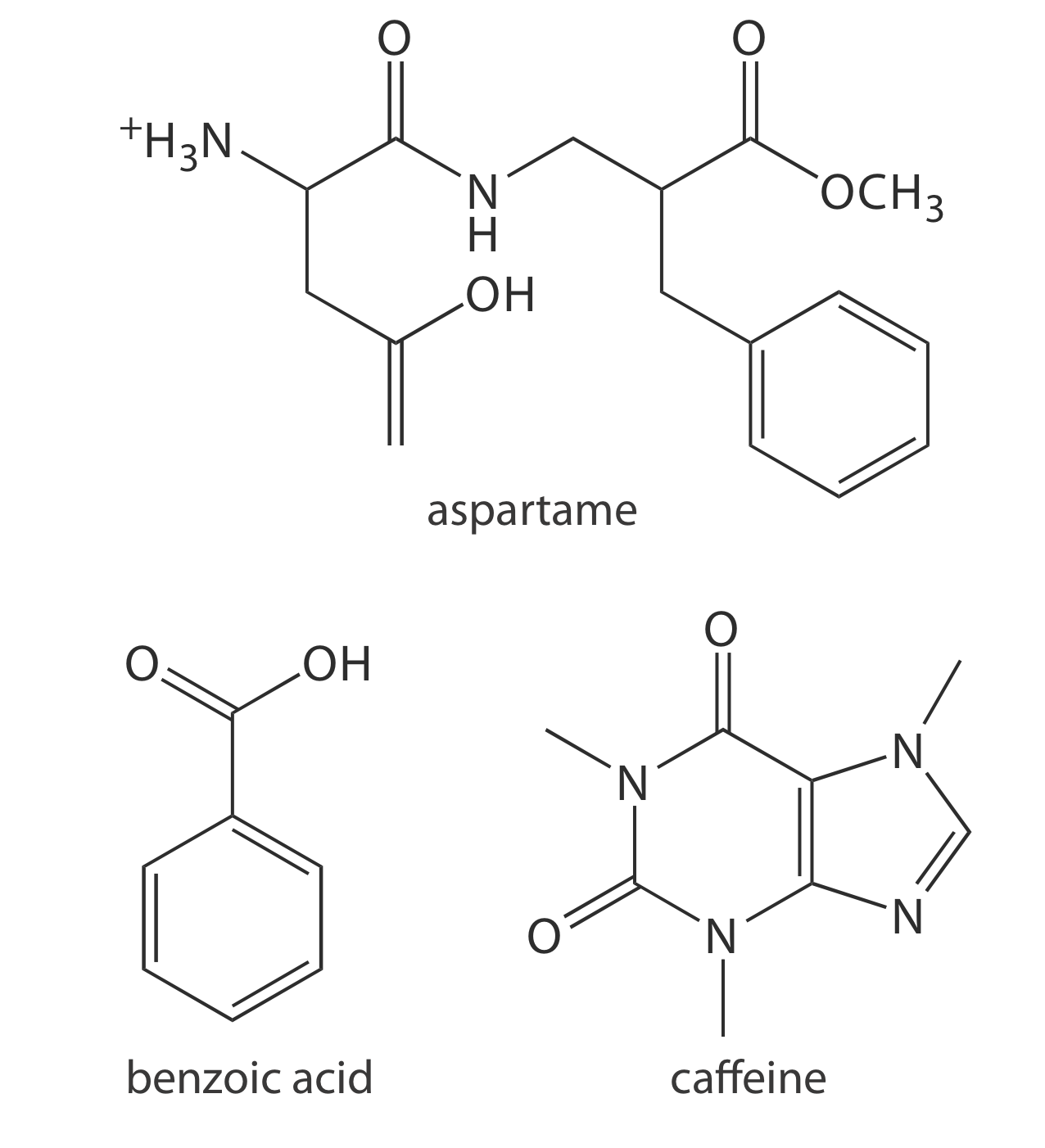 Рисунок Template:index. Структури для сполук у задачі 29.
Рисунок Template:index. Структури для сполук у задачі 29.30. Януса та колеги описують визначення хлориду за CZE [Януса, М.А.; Андерманн, Л.Дж.; Kliebert, N.M.; Nannie, MH JJ Chem. Едук. 1998, 75, 1463—1465]. Аналіз ряду зовнішніх стандартів дає наступну калібрувальну криву.
\[\text { area }=-883+5590 \times \mathrm{ppm} \text{ Cl}^{-} \nonumber\]
Стандартна проба 57,22% w/w Cl — аналізується шляхом розміщення порцій по 0,11011 г в окремі об'ємні колби об'ємом 100 мл і розведення до об'єму. Три невідомі готують шляхом піпетування 0,250 мл, 0,500 мл, 0,750 мл об'ємної маси невідомої в окремі об'ємні колби об'ємом 50 мл і розведення до об'єму. Аналіз трьох невідомих дає області 15 310, 31 546 і 47 582 відповідно. Оцініть точність цього аналізу.
31. Аналіз\(\text{NO}_3^-\) в акваріумній воді здійснюється за допомогою CZE в\(\text{IO}_4^-\) якості внутрішнього стандарту. Стандартне рішення 15,0 проміле\(\text{NO}_3^-\) і 10,0 проміле\(\text{IO}_4^-\) дає пікові висоти (довільні одиниці) 95,0 і 100,1 відповідно. Пробу води з акваріума розводять 1:100 і додають достатню внутрішню норму, щоб зробити її концентрацію 10,0 ppm в\(\text{IO}_4^-\). Аналіз дає сигнали 29,2 і 105,8 для\(\text{NO}_3^-\) і\(\text{IO}_4^-\), відповідно. Повідомте проміле\(\text{NO}_3^-\) в пробі акваріумної води.
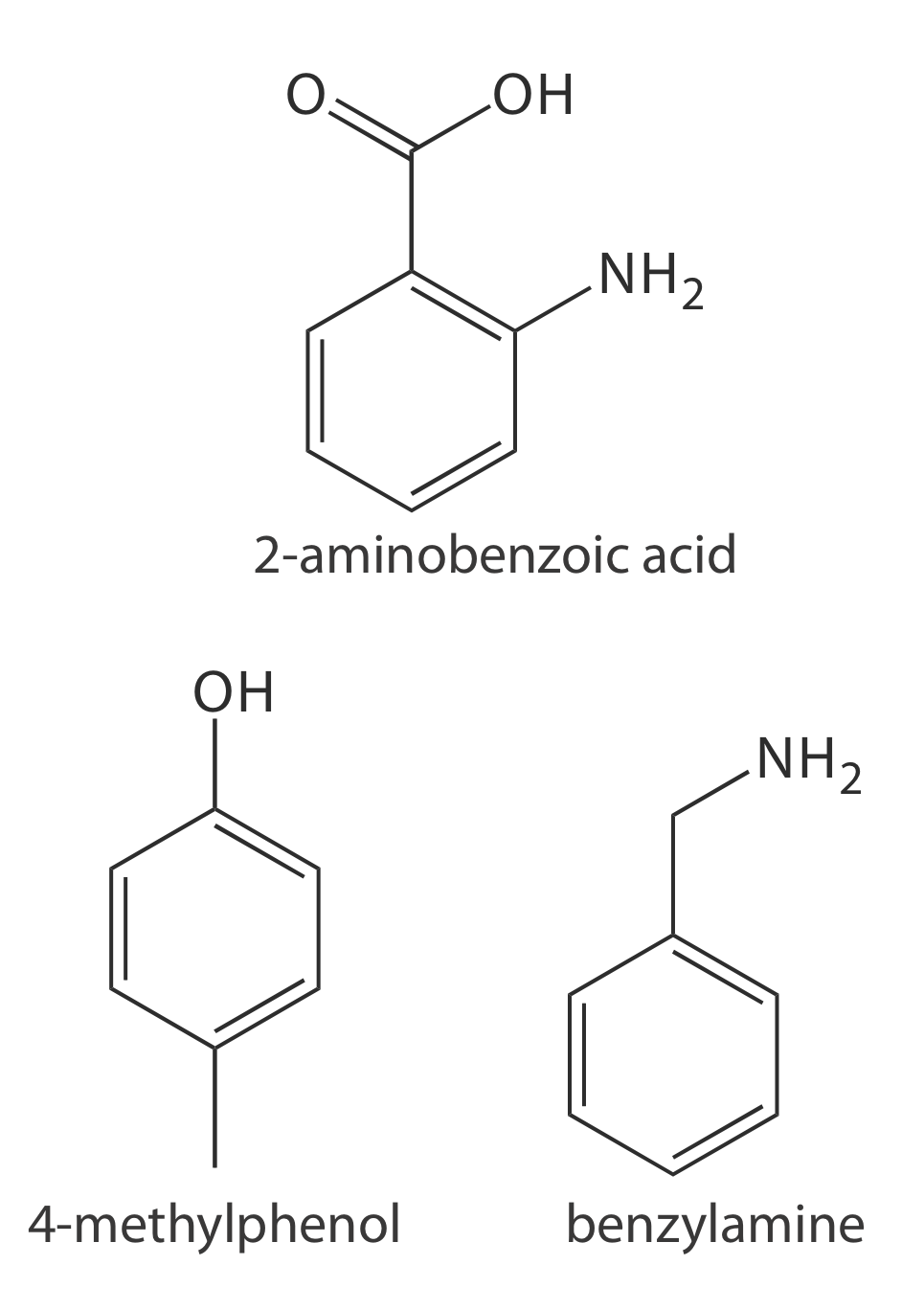
32. Запропонуйте умови поділу суміші 2-амінобензойної кислоти (р К a1 = 2,08, р К а2 = 4,96), бензиламіну (р К а = 9,35) та 4-метилфенолу (р К а2 = 10,26) шляхом електрофорезу капілярної зони. На малюнку\(PageIndex{4}\) наводяться структури цих з'єднань.
33. Маккіллоп та асоційовані досліджували електрофоретичне поділ деяких алкілпіридинів за допомогою CZE [McKillop, A.G.; Сміт, Р.М.; Rowe, R. C.; Wren, S.A. Хім. 1999, 71, 497—503]. Поділ проводили з використанням капілярів внутрішнього діаметра 50 мкм або 75 мкм, загальною довжиною 57 см і довжиною 50 см від точки введення до детектора. Буфер запуску був рН 2,5 літій-фосфатний буфер. Поділ досягався за допомогою прикладеної напруги 15 кВ. Встановлено, що електроосмотична рухливість μ eof, виміряна за допомогою нейтрального маркера, становить\(6.398 \times 10^{-5}\) см 2 V —1 с —1. Коефіцієнт дифузії алкілпіридинів становить\(1.0 \times 10^{-5}\) см 2 с —1.
(а) Обчисліть електрофоретичну рухливість для 2-етилпіридину, враховуючи, що час його елюації становить 8,20 хв.
(б) Скільки теоретичних пластин існує для 2-етилпіридину?
(c) Електрофоретичні рухливості для 3-етилпіридину та 4-етилпіридину\(3.366 \times 10^{-4}\) становлять см 2 V —1 s —1 і\(3.397 \times 10^{-4} \text{ cm}^2 \text{ V}^{-1} \text{ s}^{-1}\) відповідно. Яка очікувана роздільна здатність між цими двома алкілпіридинами?
(d) Пояснити тенденції електрофоретичної рухливості, наведені в наступній таблиці.
| алкілпіридин | \(\mu_{ep}\)(см 2 В —1 с —1) |
| 2-метилпіридин | \(3.581 \times 10^{-4}\) |
| 2-етилпіридин | \(3.222 \times 10^{-4}\) |
| 2-пропілпіридин | \(2.923 \times 10^{-4}\) |
| 2-пентилпіридин | \(2.534 \times 10^{-4}\) |
| 2-гексилпіридин | \(2.391 \times 10^{-4}\) |
(e) Поясніть тенденції електрофоретичної рухливості, наведені в наступній таблиці.
| алкілпіридин | \(\mu_{ep}\)(см 2 В —1 с —1) |
| 2-етилпіридин | \(3.222 \times 10^{-4}\) |
| 3-етилпіридин | \(3.366 \times 10^{-4}\) |
| 4-етилпіридин | \(3.397 \times 10^{-4}\) |
(f) р К а для піридину становить 5,229. При рН 2,5 електрофоретична рухливість піридину становить\(4.176 \times 10^{-4}\) см 2 В —1 с —1. Яка очікувана електрофоретична рухливість, якщо рН буфера запуску становить 7,5?
