12.7: Електрофорез
- Page ID
- 24905
Електрофорез - це клас методів поділу, в якому ми відокремлюємо аналіти за їх здатністю рухатися через провідне середовище - зазвичай водний буфер - у відповідь на застосоване електричне поле. При відсутності інших ефектів катіони мігрують до негативно зарядженого катода електричного поля. Катіони з більшими співвідношеннями заряду до розміру - що сприяє іонам більшого заряду та меншого розміру - мігрують швидше, ніж більші іони кішки з меншими зарядами. Аніони мігрують до позитивно зарядженого анода, а нейтральні види не відчувають електричного поля і залишаються нерухомими.
Як ми побачимо незабаром, в нормальних умовах навіть нейтральні види та аніони мігрують до катода.
Існує кілька форм електрофорезу. У сляб-гелевому електрофорезі провідний буфер утримується всередині пористого гелю агарози або поліакриламіду. Сляби формуються шляхом заливки гелю між двома скляними пластинами, розділеними розпірками. Типові товщини 0,25-1 мм. Гелевий електрофорез є важливою методикою в біохімії, де він часто використовується для поділу фрагментів ДНК і білків. Хоча це потужний інструмент для якісного аналізу складних сумішей, він менш корисний для кількісної роботи.
При капілярному електрофорезі провідний буфер утримується в капілярній трубці з внутрішнім діаметром, який зазвичай становить 25-75 мкм. Зразок вводиться в один кінець капілярної трубки, і в міру міграції через капіляр компоненти зразка відокремлюються і елітуються з колони в різний час. Отримана електроферограма виглядає схожа на хроматограму ГХ або ВЕРХ, і надає як якісну, так і кількісну інформацію. Далі розглядаються в цьому розділі тільки капілярні електрофоретичні методи.
теорія електрофорезу
При капілярному електрофорезі ми вводимо зразок в буферний розчин, що зберігається в капілярній трубці. При застосуванні електричного поля по капілярній трубці компоненти зразка мігрують в результаті двох типів дій: електрофоретичної рухливості та електроосмотичної рухливості. Електрофоретична рухливість - це реакція розчиненої речовини на застосоване електричне поле, в якому катіони рухаються до негативно зарядженого катода, аніони рухаються до позитивно зарядженого анода, а нейтральні види залишаються нерухомими. Іншим внеском у міграцію розчиненої речовини є електроосмотичний потік, який виникає, коли буфер рухається через капіляр у відповідь на застосоване електричне поле. У нормальних умовах буфер рухається до катода, підмітаючи більшість розчинених речовин, включаючи аніони та нейтральні види, до негативно зарядженого катода.
Електрофоретична рухливість
Швидкість, з якою розчинена речовина рухається у відповідь на прикладене електричне поле, називається його електрофоретичною\(\nu_{ep}\) швидкістю, вона визначається як
\[\nu_{ep}=\mu_{ep} E \label{12.1}\]
де\(\mu_{ep}\) - електрофоретична рухливість розчиненого речовини, а Е - величина прикладеного електричного поля. Електрофоретична рухливість розчиненої речовини визначається як
\[\mu_{ep}=\frac{q}{6 \pi \eta r} \label{12.2}\]
де q - заряд розчиненої речовини,\(\eta\) в'язкість буфера, а r - радіус розчиненої речовини. Використовуючи Equation\ ref {12.1} та Equation\ ref {12.2}, ми можемо зробити кілька важливих висновків щодо електрофоретичної швидкості розчиненої речовини. Електрофоретична рухливість і, отже, електрофоретична швидкість, збільшується для більш сильно заряджених розчинених речовин і для розчинених речовин меншого розміру. Оскільки q є позитивним для катіона та негативним для аніону, ці види мігрують у протилежних напрямках. Нейтральний вид, для якого q дорівнює нулю, має електрофоретичну швидкість нуль.
Електроосмотична мобільність
Коли електричне поле прикладається до капіляра, заповненого водним буфером, ми очікуємо, що іони буфера будуть мігрувати у відповідь на їх електрофоретичну рухливість. Оскільки розчинник, H 2 O, є нейтральним, ми можемо обґрунтовано очікувати, що він залишиться нерухомим. Однак ми спостерігаємо за нормальних умов, це те, що буфер рухається до катода. Це явище називається електроосмотичним потоком.
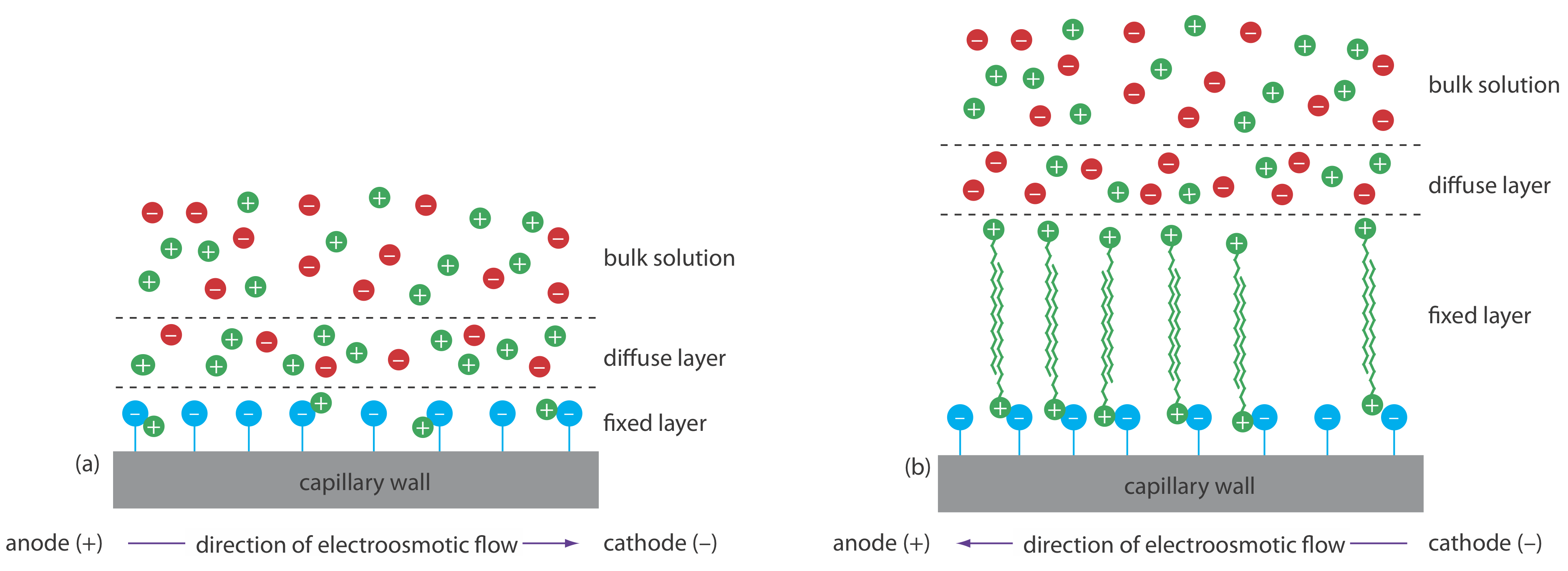
Електроосмотичний потік виникає через те, що стінки капілярної трубки несуть заряд. Поверхня кремнеземного капіляра містить велику кількість силанольних груп (—SiOH). При рівні рН, що перевищує приблизно 2 або 3, силанольні групи іонізуються з утворенням негативно заряджених іонів силанату (—SiO -). Катіони з буфера притягуються до іонів силанату. Як показано на малюнку Template:index, деякі з цих катіонів щільно зв'язуються з іонами силанату, утворюючи нерухомий шар. Оскільки катіони у фіксованому шарі лише частково нейтралізують негативний заряд на стінках капілярів, розчин, що прилягає до фіксованого шару, який називається дифузним шаром, містить більше катіонів, ніж аніонів. Разом ці два шари відомі як подвійний шар. Катіони в дифузному шарі мігрують до катода. Оскільки ці катіони розчиняються, розчин також тягнеться вздовж, виробляючи електроосмотичний потік.
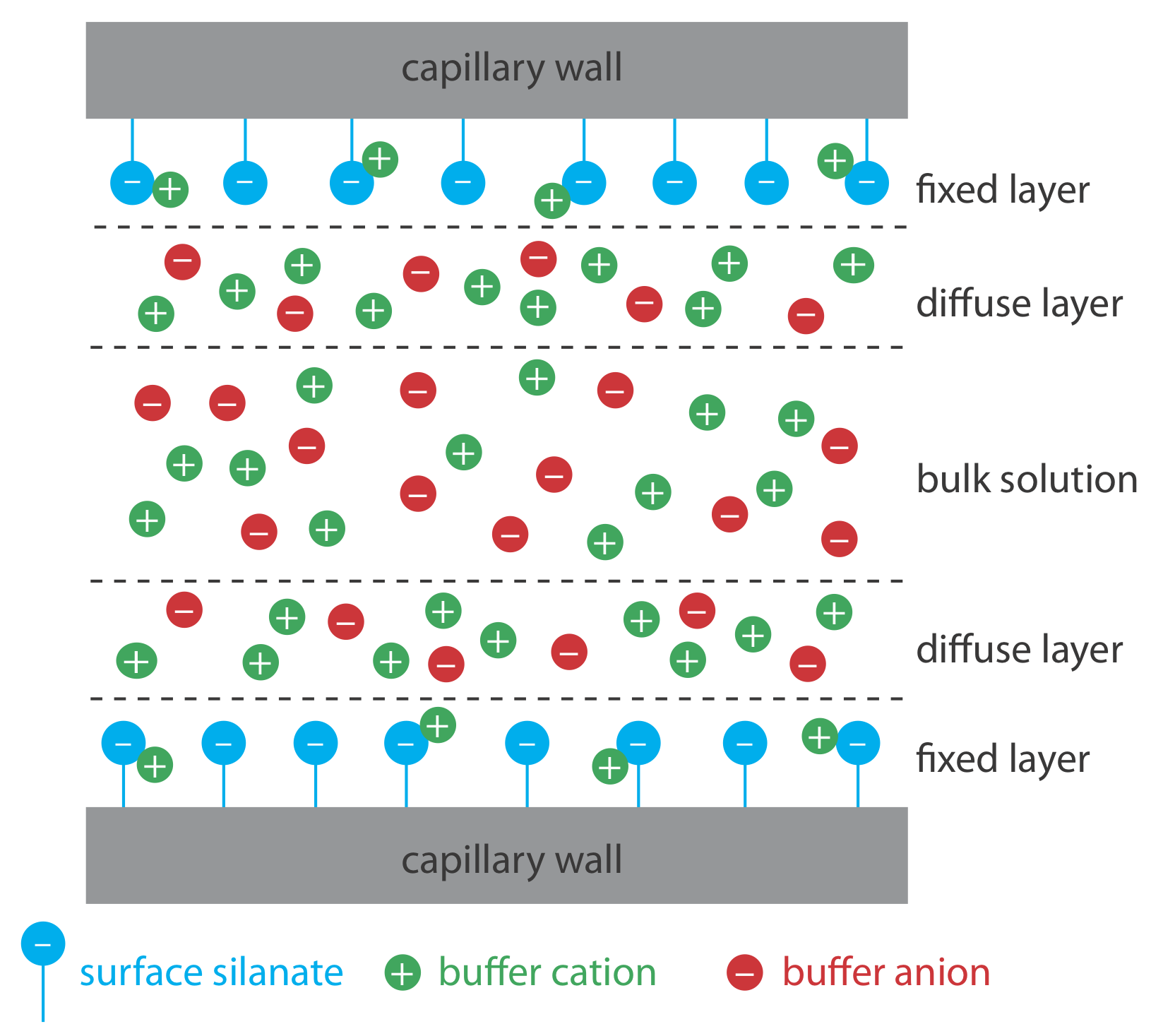
Аніони в дифузному шарі, які також розчиняються, намагаються рухатися в бік анода. Оскільки катіонів більше, ніж аніонів, однак катіони виграють, і електроосмотичний потік рухається у напрямку катода.
Швидкість, з якою буфер рухається через капіляр, що ми називаємо його електроосмотичною швидкістю потоку\(\nu_{eof}\), є функцією застосованого електричного поля Е та електроосмотичної рухливості буфера\(\mu_{eof}\).
\[\nu_{eof}=\mu_{e o f} E \label{12.3}\]
Електроосмотична мобільність визначається як
\[\mu_{eof}=\frac{\varepsilon \zeta}{4 \pi \eta} \label{12.4}\]
де\(\epsilon\) - буферна діелектрична\(\zeta\) проникність, - дзета-потенціал і\(\eta\) в'язкість буфера.
Важливу роль у визначенні швидкості електроосмотичного потоку відіграє дзета-потенціал — потенціал дифузного шару на кінцевій відстані від стінки капілярів. Два фактори визначають значення дзета-потенціалу. По-перше, дзета-потенціал прямо пропорційний заряду на стінках капілярів, при цьому більша щільність іонів силаната відповідає більшому дзета-потенціалу. Нижче рН 2 є мало іонів силанату, а дзета-потенціал і швидкість електроосмотичного потоку наближається до нуля. Зі збільшенням рН збільшується як дзета-потенціал, так і швидкість електроосмотичного потоку. По-друге, дзета-потенціал прямо пропорційний товщині подвійного шару. Збільшення іонної міцності буфера забезпечує більш високу концентрацію катіонів, що зменшує товщину подвійного шару і зменшує електроосмотичний потік.
Визначення дзета-потенціалу, наведене тут, за загальним визнанням, трохи нечітке. Більш детальне пояснення див. Дельгадо, А.В.; Гонсалес-Кабальеро, Ф.; Хантер, Р.Дж.; Koopal, Л.К.; Lyklema, J. «Вимірювання та інтерпретація електрокінетичних явищ,» Чистий. Застосовувати. Хім. 2005, 77, 1753—1805. Хоча це дуже технічний звіт, розділи 1.3—1.5 дають гарне вступ до складності визначення дзета-потенціалу та вимірювання його значення.
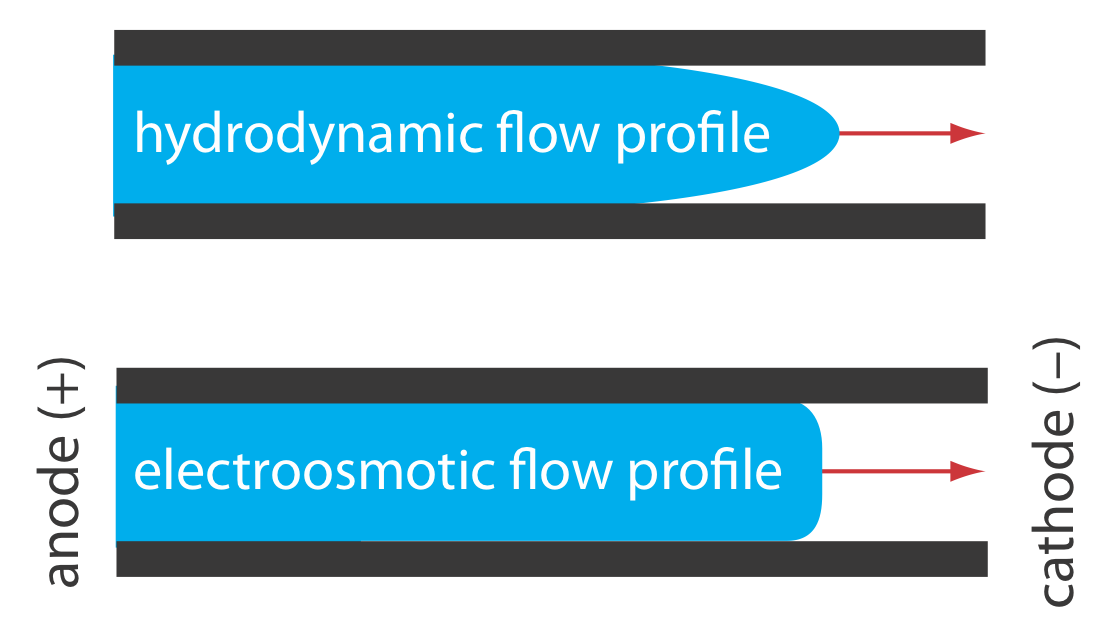
Профіль електроосмотичного потоку сильно відрізняється від профілю рідини, що рухається під примусовим тиском. Рисунок Template:index порівнює профіль електроосмотичного потоку з профілем гідродинамічного потоку в газовій хроматографії та рідинної хроматографії. Рівномірний, плоский профіль для електроосмосу допомагає мінімізувати розширення смуги при капілярному електрофорезі, підвищуючи ефективність поділу.
Загальна мобільність
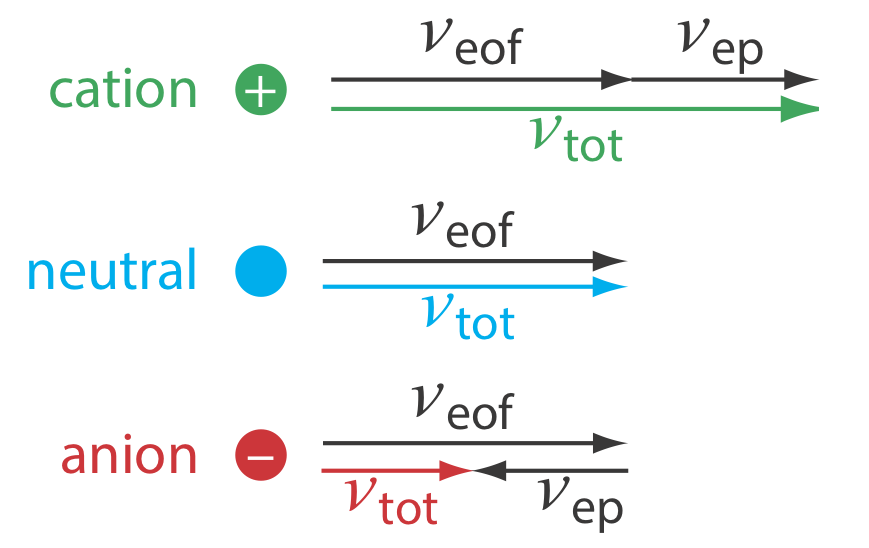
Загальна швидкість розчиненої речовини\(\nu_{tot}\), коли вона рухається через капіляр, є сумою його електрофоретичної швидкості та швидкості електроосмотичного потоку.
\[\nu_{t o t}=\nu_{ep}+\nu_{eof} \nonumber\]
Як показано на рисунку Template:index, за звичайних умов наступні загальні зв'язки мають значення.
\[(\nu_{tot})_{cations} > \nu_{eof} \nonumber\]
\[(\nu_{tot})_{neutrals} = \nu_{eof} \nonumber\]
\[(\nu_{tot})_{anions} < \nu_{eof} \nonumber\]
Катіони виділяють спочатку в порядку, який відповідає їх електрофоретичної рухливості, з невеликими, сильно зарядженими катіонами, елюючими перед більшими катіонами нижчого заряду. Нейтральні види елітуються як єдина смуга зі швидкістю елюції, рівною швидкості електроосмотичного потоку. Нарешті, аніони є останніми компонентами для елюції, причому менші, сильно заряджені аніони мають найдовший час елюції.
Час міграції
Інший спосіб висловити швидкість розчиненої речовини - розділити відстань, яку він проходить, на минулий час.
\[\nu_{tot}=\frac{l}{t_{m}} \label{12.5}\]
де l - відстань між точкою впорскування і детектором, а t m - час міграції розчиненої речовини. Щоб зрозуміти експериментальні змінні, які впливають на час міграції, ми почнемо з того, що
\[\nu_{tot} = \mu_{tot}E = (\mu_{ep} + \mu_{eof})E \label{12.6}\]
Поєднання рівняння\ ref {12.5} та рівняння\ ref {12.6} та розв'язування для t m залишає нас з
\[t_{\mathrm{m}}=\frac{l}{\left(\mu_{ep}+\mu_{eof}\right) E} \label{12.7}\]
Величина електричного поля дорівнює
\[E=\frac{V}{L} \label{12.8}\]
де V - прикладений потенціал, а L - довжина капілярної трубки. Нарешті, заміна Equation\ ref {12.8} на Equation\ ref {12.7} залишає нам наступне рівняння для часу міграції розчиненої речовини.
\[t_{\mathrm{m}}=\frac{lL}{\left(\mu_{ep}+\mu_{eof}\right) V} \label{12.9}\]
Щоб зменшити час міграції розчиненої речовини, що скорочує час аналізу, ми можемо застосувати більш високу напругу або використовувати коротшу капілярну трубку. Ми також можемо скоротити час міграції, збільшивши електроосмотичний потік, хоча це зменшує роздільну здатність.
Ефективність
Як ми дізналися в розділі 12.2, ефективність поділу задається кількістю теоретичних пластин N. При капілярному електрофорезі кількість теоретичних пластин дорівнює
\[N=\frac{l^{2}}{2 D t_{m}}=\frac{\left(\mu_{e p}+\mu_{eof}\right) E l}{2 D L} \label{12.10}\]
де D - коефіцієнт дифузії розчиненої речовини. З Equation\ ref {12.10} ефективність капілярного електрофоретичного поділу зростає з більш високими напругами. Збільшення швидкості електроосмотичного потоку підвищує ККД, але за рахунок дозволу. Два додаткових спостереження заслуговують на коментар. По-перше, розчинені речовини з більшою електрофоретичною рухливістю - у тому ж напрямку, що і електроосмотичний потік - мають більшу ефективність; таким чином, менші, більш сильно заряджені катіони є не тільки першими розчиненими речовинами для елюту, але роблять це з більшою ефективністю. По-друге, ефективність капілярного електрофорезу не залежить від довжини капіляра. Теоретичні підрахунки плит приблизно 100 000—200 000 не є незвичайними.
Можна розробити електрофоретичний експеримент, щоб аніони елютували перед катіонами - докладніше про це пізніше - в якому менші, більш сильно заряджені аніони елітуються з більшою ефективністю.
Вибірковість
У хроматографії ми визначили селективність між двома розчиненими речовинами як співвідношення їх факторів утримання. При капілярному електрофорезі аналогічним експресією для селективності є
\[\alpha=\frac{\mu_{ep, 1}}{\mu_{ep, 2}} \nonumber\]
де\(\mu_{ep,1}\) і\(\mu_{ep,2}\) є електрофоретичні рухливості для двох розчинених речовин, обраних таких, що\(\alpha \ge 1\). Ми часто можемо покращити селективність, регулюючи рН буферного розчину. Наприклад,\(\text{NH}_4^+\) слабка кислота з р К а 9,75. При рН 9,75 концентрації\(\text{NH}_4^+\) і NH 3 рівні. Зниження рН нижче 9,75 збільшує його електрофоретичну рухливість, оскільки більша частка розчиненої речовини присутня як катіон\(\text{NH}_4^+\). З іншого боку, підвищення рН вище 9,75 збільшує частку нейтрального NH 3, зменшуючи його електрофоретичну рухливість.
Дозвіл
Роздільна здатність між двома розчиненими речовинами становить
\(\mu_{avg}\)де середня електрофоретична рухливість двох розчинених речовин. Збільшення прикладеної напруги та зменшення швидкості електроосмотичного потоку покращує роздільну здатність. Останній ефект особливо важливий. Хоча збільшення електроосмотичного потоку покращує час та ефективність аналізу, він зменшує роздільну здатність.
Контрольно-вимірювальні прилади
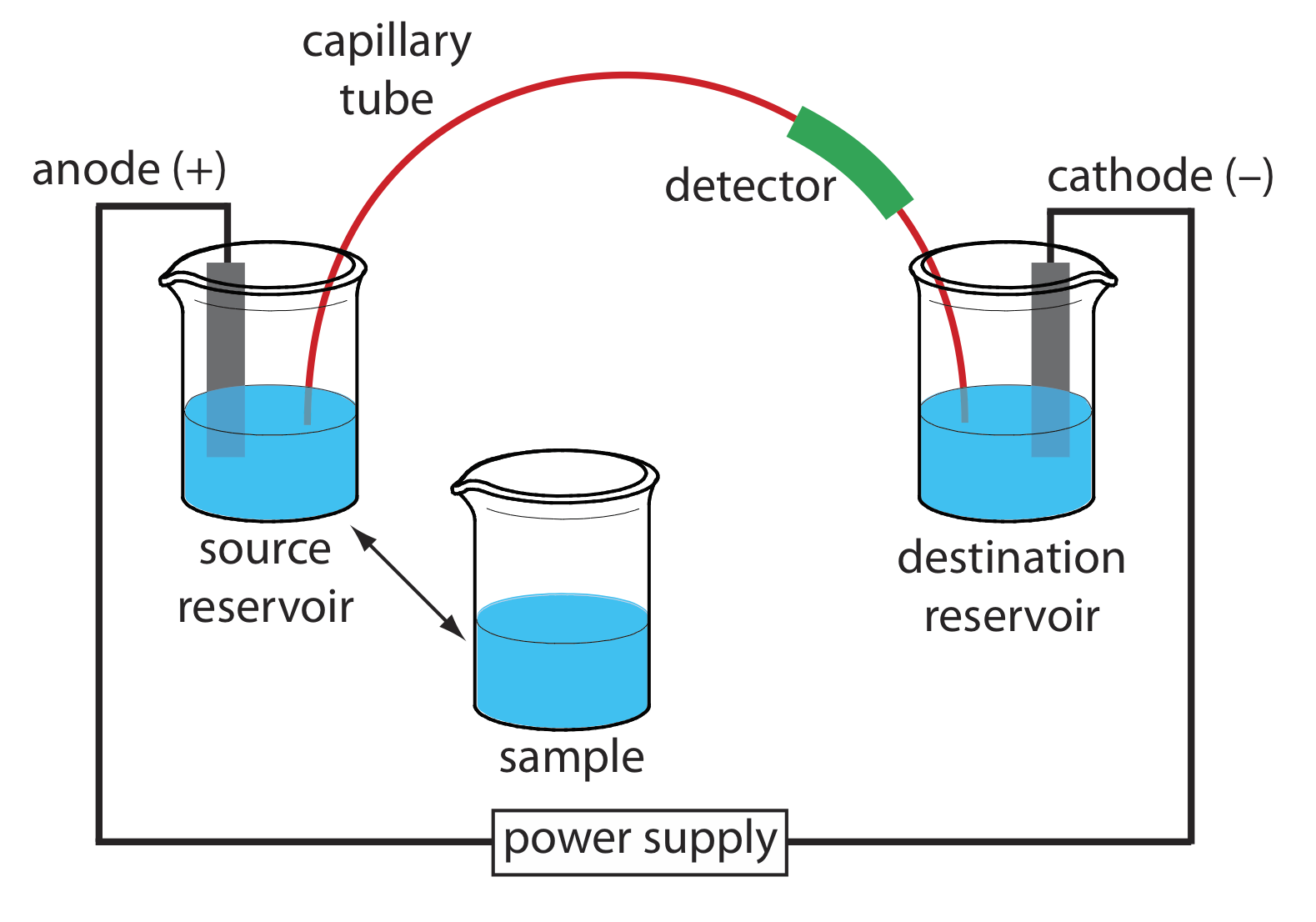
Основний прилад для капілярного електрофорезу наведено на малюнку Template:index і включає блок живлення для подачі електричного поля, анодний і катодний відсіки, які містять резервуари буферного розчину, пробу, що містить зразок, капілярну трубку та детектор . Кожна частина інструменту отримує подальший розгляд в цьому розділі.
Капілярні трубки
На малюнку Template:index показано поперечний переріз типової капілярної трубки. Більшість капілярних трубок виготовляються з плавленого кремнезему, покритого шаром полііміду 15-35 мкм для додання йому механічної міцності. Внутрішній діаметр зазвичай становить 25-75 мкм, що менше внутрішнього діаметра капілярної колонки ГК, із зовнішнім діаметром 200—375 мкм.
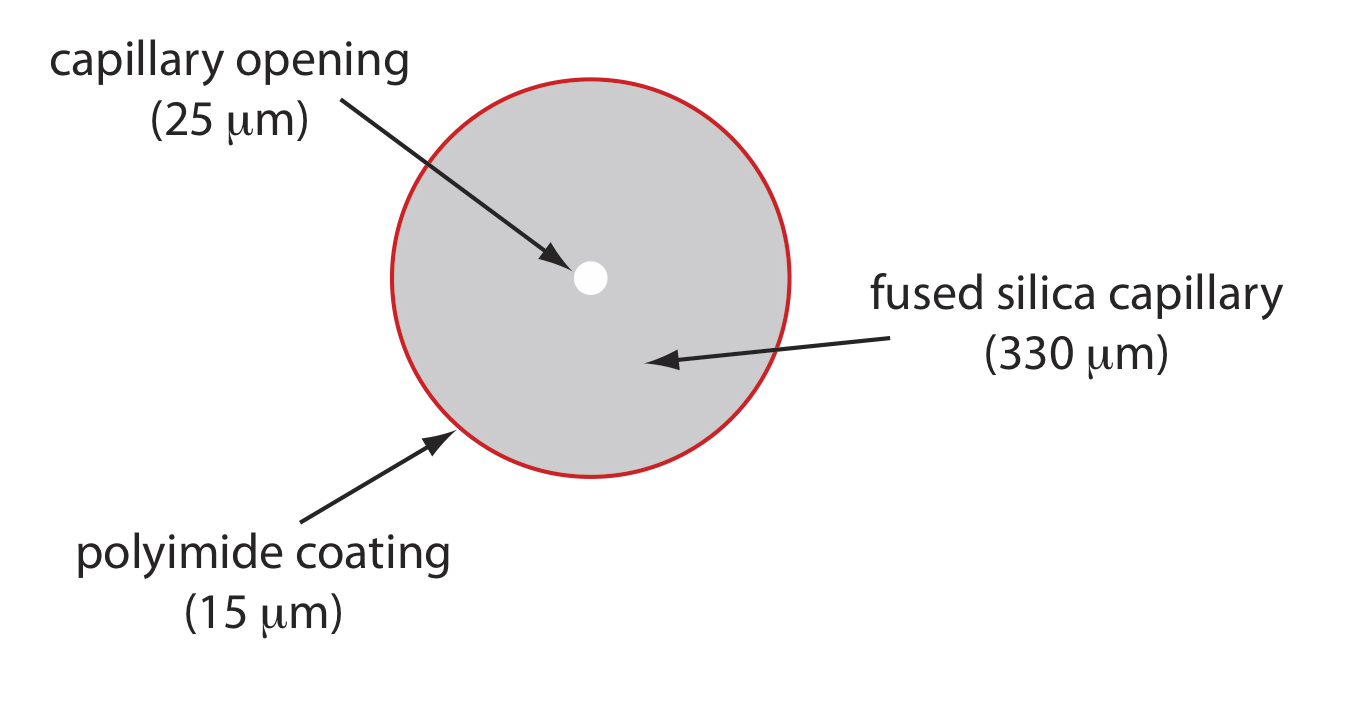
Важливе значення має вузький отвір капілярної колони і товщина її стінок. При подачі електричного поля на буферний розчин через капіляр протікає струм. Цей струм призводить до виділення тепла, яке ми називаємо Джоулевим нагріванням. Кількість виділеного тепла пропорційно радіусу капіляра і величині електричного поля. Нагрівання джоуля є проблемою, оскільки воно змінює в'язкість буфера, причому розчин в центрі капіляра менш в'язкий, ніж у стінок капілярів. Оскільки електрофоретична рухливість розчиненої речовини залежить від його в'язкості (див. Рівняння\ ref {12.2}), розчинені речовини в центрі капіляра мігрують швидше, ніж ті, що знаходяться поблизу стінок капілярів. Результатом є додаткове джерело розширення смуги, що погіршує поділ. Капіляри з меншими внутрішніми діаметрами генерують менше Джоуля нагрівання, а капіляри з більшими зовнішніми діаметрами більш ефективні при розсіюванні тепла. Розміщення капілярної трубки всередині терморегульованої сорочки - ще один метод мінімізації ефекту Джоуля нагрівання; в цьому випадку менший зовнішній діаметр дозволяє більш швидке розсіювання теплової енергії.
Ін'єкція зразка
Існує два поширених методу введення зразка в колонку капілярного електрофорезу: гідродинамічна ін'єкція і електрокінетична ін'єкція. В обох методах капілярна трубка заповнюється буферним розчином. Один кінець капілярної трубки поміщають в резервуар призначення, а інший кінець поміщають у флакон для зразків.
Гідродинамічне впорскування використовує тиск, щоб змусити невелику частину зразка в капілярну трубку. Різниця в тиску застосовується через капіляр або шляхом тиску флакона зразка, або шляхом нанесення вакууму до резервуара призначення. Обсяг введеної проби, в літрах, задається наступним рівнянням
\[V_{\text {inj}}=\frac{\Delta P d^{4} \pi t}{128 \eta L} \times 10^{3} \label{12.12}\]
де\(\Delta P\) - різниця тиску по капіляру в паскалі, d - внутрішній діаметр капіляра в метрах, t - кількість часу прикладання тиску в секундах,\(\eta\) в'язкість буфера в кг м —1 с —1, і L - довжина капілярної трубки в метрах. Коефіцієнт 10 3 змінює одиниці з кубічних метрів на літри.
Для гідродинамічного нагнітання переміщаємо капіляр з вихідного резервуара до зразка. Анод залишається в резервуарі джерела. Гідродинамічна ін'єкція також можлива, якщо ми піднімаємо флакон із зразком над резервуаром призначення і коротко вставимо заповнений капіляр.
При гідродинамічному уприскуванні наносимо різницю тиску\(2.5 \times 10^3\) Па (а\(\Delta P \approx 0.02 \text{ atm}\)) протягом 2 с на капілярну трубку довжиною 75 см з внутрішнім діаметром 50 мкм. Якщо припустити, що в'язкість буфера становить 10 —3 кг м —1 с —1, який обсяг і довжину зразка ми вводили?
Рішення
Внесення відповідних замін в Equation\ ref {12.12} дає обсяг зразка як
\[V_{inj}=\frac{\left(2.5 \times 10^{3} \text{ kg} \text{ m}^{-1} \text{ s}^{-2}\right)\left(50 \times 10^{-6} \text{ m}\right)^{4}(3.14)(2 \text{ s})}{(128)\left(0.001 \text{ kg} \text{ m}^{-1} \text{ s}^{-1}\right)(0.75 \text{ m})} \times 10^{3} \mathrm{L} / \mathrm{m}^{3} \nonumber\]
\[V_{inj} = 1 \times 10^{-9} \text{ L} = 1 \text{ nL} \nonumber\]
Оскільки внутрішня частина капіляра циліндрична, довжину зразка, л, легко обчислити, використовуючи рівняння для об'єму циліндра; таким чином
\[l=\frac{V_{\text {inj}}}{\pi r^{2}}=\frac{\left(1 \times 10^{-9} \text{ L}\right)\left(10^{-3} \text{ m}^{3} / \mathrm{L}\right)}{(3.14)\left(25 \times 10^{-6} \text{ m}\right)^{2}}=5 \times 10^{-4} \text{ m}=0.5 \text{ mm} \nonumber\]
Припустимо, вам потрібно обмежити свою ін'єкцію менше 0,20% довжини капіляра. Використовуючи інформацію з Example Template:index, який максимальний час впорскування для гідродинамічного впорскування?
- Відповідь
-
Довжина капіляра 75 см, що означає, що 0,20% максимальної довжини цього зразка становить 0,15 см. Щоб перетворити це на максимальний об'єм вибірки, ми використовуємо рівняння об'єму циліндра.
\[V_{i n j}=l \pi r^{2}=(0.15 \text{ cm})(3.14)\left(25 \times 10^{-4} \text{ cm}\right)^{2}=2.94 \times 10^{-6} \text{ cm}^{3} \nonumber\]
З огляду на, що 1 см 3 еквівалентно 1 мл, максимальний об'єм -\(2.94 \times 10^{-6}\) мл або\(2.94 \times 10^{-9}\) л. Щоб знайти максимальний час ін'єкції, спочатку вирішимо рівняння\ ref {12.12} для t
\[t=\frac{128 V_{inj} \eta L}{P d^{4} \pi} \times 10^{-3} \text{ m}^{3} / \mathrm{L} \nonumber\]
а потім зробити відповідні заміни.
\[t=\frac{(128)\left(2.94 \times 10^{-9} \text{ L}\right)\left(0.001 \text{ kg } \text{ m}^{-1} \text{ s}^{-1}\right)(0.75 \text{ m})}{\left(2.5 \times 10^{3} \text{ kg } \mathrm{m}^{-1} \text{ s}^{-2}\right)\left(50 \times 10^{-6} \text{ m}\right)^{4}(3.14)} \times \frac{10^{-3} \text{ m}^{3}}{\mathrm{L}} = 5.8 \text{ s} \nonumber\]
Максимальний час впорскування, отже, становить 5,8 с.
При електрокінетичної ін'єкції поміщаємо і капіляр, і анод в зразок і коротко застосовуємо потенціал. Обсяг введеного зразка - це добуток площі поперечного перерізу капіляра та довжини капіляра, зайнятого зразком. У свою чергу, ця довжина є добутком швидкості розчиненої речовини (див. Рівняння\ ref {12.6}) і часу; таким чином
\[V_{inj} = \pi r^2 L = \pi r^2 (\mu_{ep} + \mu_{eof})E^{\prime}t \label{12.13}\]
де r - радіус капіляра, L - довжина капіляра, і\(E^{\prime}\) є ефективним електричним полем у зразку. Важливим наслідком Equation\ ref {12.13} є те, що електрокінетична ін'єкція зміщується до розчинених речовин з більшою електрофоретичною рухливістю. Якщо два розчинених речовини мають однакові концентрації в зразку, ми вводимо більший об'єм - і, отже, більше молів - розчиненої речовини з більшим\(\mu_{ep}\).
Електричне поле в зразку відрізняється від електричного поля в іншій частині капіляра, оскільки зразок і буфер мають різні іонні склади. Взагалі іонна сила зразка менша, що робить його провідність меншою. Ефективним електричним полем є
\[E^{\prime} = E \times \frac {\chi_\text{buffer}} {\chi_\text{sample}}\nonumber\]
де\(\chi_\text{buffer}\)\(\chi_{sample}\) і - провідності буфера і зразка відповідно.
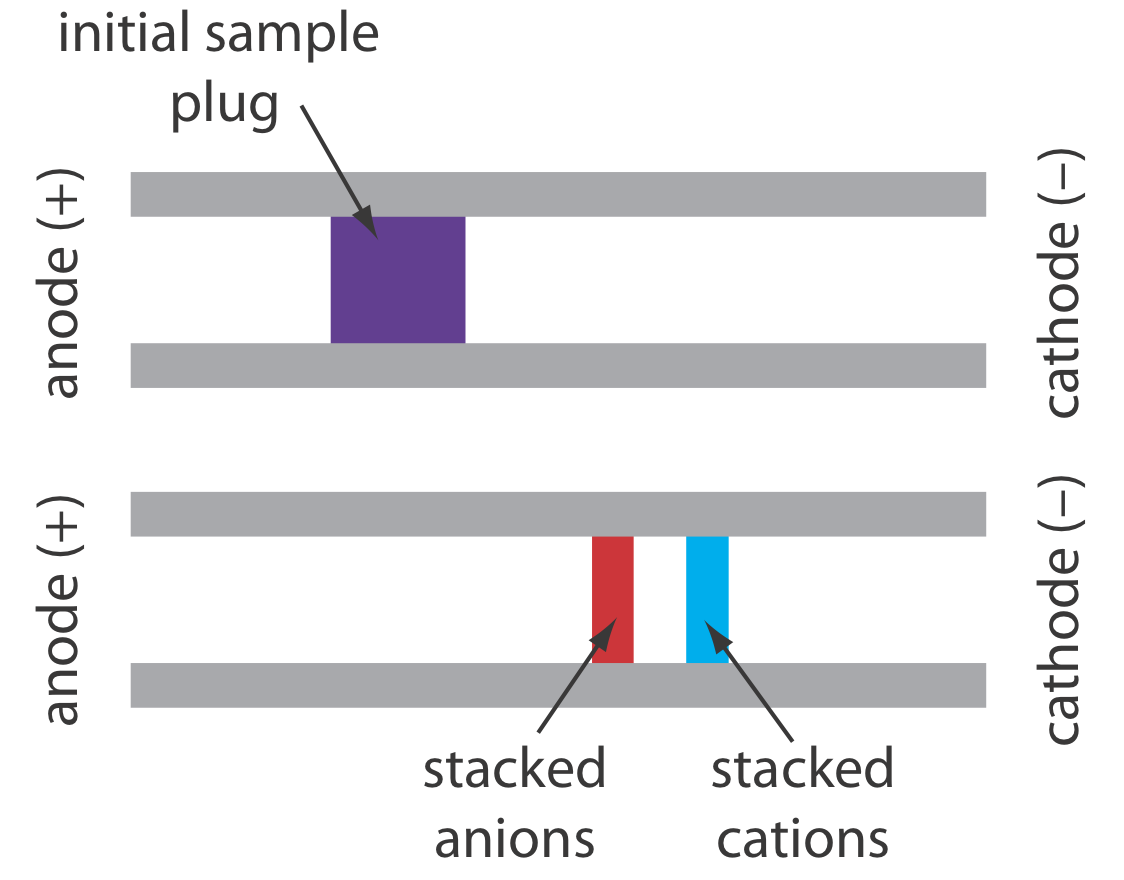
Коли концентрація аналіту занадто мала для надійного виявлення, можливо, можна ввести його таким чином, що збільшує його концентрацію. Такий спосіб ін'єкції називається укладанням. Укладання здійснюється шляхом розміщення зразка в розчин, іонна сила якого значно менше, ніж у буфера в капілярній трубці. Оскільки пробка зразка має меншу концентрацію буферних іонів, ефективна напруженість поля через пробку зразка більша\(E^{\prime}\), ніж у решті капіляра.
З Equation\ ref {12.1} відомо, що швидкість електрофорезу прямо пропорційна електричному полю. В результаті катіони в пробці зразка мігрують до катода з більшою швидкістю, а аніони мігрують повільніше - нейтральні види не впливають і рухаються з електроосмотичним потоком. Коли іони досягають відповідних меж між пробкою зразка та буфером, електричне поле зменшується, а електрофоретична швидкість катіонів зменшується, а для аніонів збільшується. Як показано на малюнку Template:index, результатом є укладання катіонів і аніонів в окремі, менші зони вибірки. Згодом буфер всередині капіляра стає більш однорідним і поділ протікає без додаткової укладання.
Застосування електричного поля
Міграція при електрофорезі відбувається у відповідь на прикладене електричне поле. Можливість застосування великого електричного поля важлива, оскільки більш високі напруги призводять до коротшого часу аналізу (Equation\ ref {12.9}), більш ефективного поділу (Equation\ ref {12.10}) та кращої роздільної здатності (Equation\ ref {12.11}). Оскільки вузькі розсвердлені капілярні трубки настільки ефективно розсіюють Джоульський нагрів, можливі напруги до 40 кВ.
Через високі напруги обов'язково дотримуйтесь правил безпеки вашого приладу.
Детектори
Більшість детекторів, що використовуються у ВЕРХ, також знаходять застосування в капілярному електрофорезі. Серед найбільш поширених детекторів є ті, що засновані на поглинанні УФ-випромінювання, флуоресценції, провідності, амперометрії та мас-спектрометрії. Коли це можливо, виявлення проводиться «на колоні» до того, як розчинені речовини елітуть з капілярної трубки і відбувається додаткове розширення смуги.
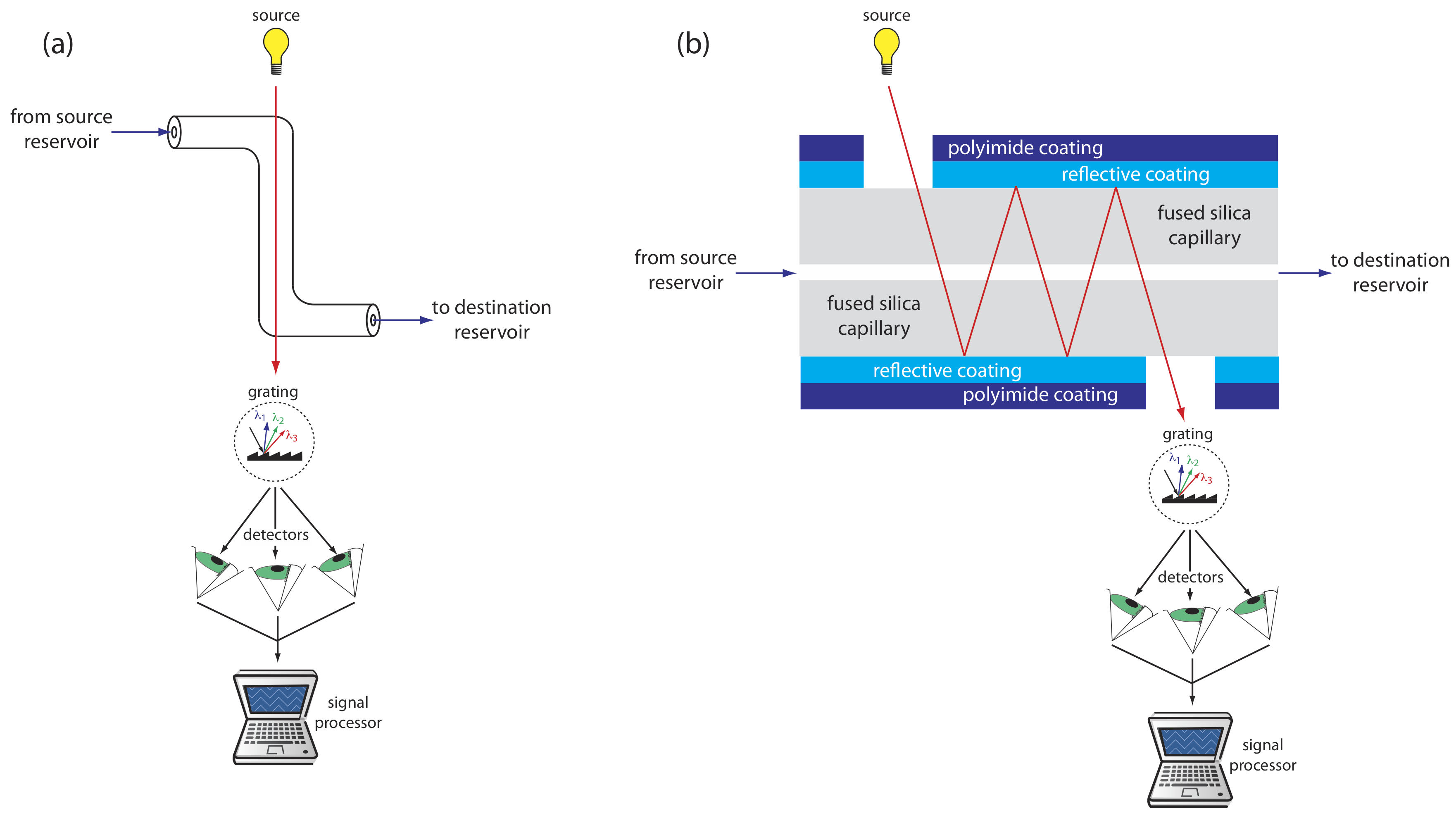
УФ/ВІС детектори є одними з найпопулярніших. Оскільки поглинання прямо пропорційно довжині шляху, невеликий діаметр капілярної трубки призводить до сигналів, менших, ніж ті, що отримані у ВЕРХ. Для збільшення довжини шляху було використано декілька підходів, включаючи Z-подібну клітинку зразка та множинні відображення (див. Рисунок Template:index). Межі виявлення становлять близько 10 —7 М.
Кращі межі виявлення отримують за допомогою флуоресценції, особливо при використанні лазера в якості джерела збудження. При використанні флуоресцентного виявлення невелика частина захисного покриття капіляра видаляється і лазерний промінь фокусується на внутрішній частині капілярної трубки. Вимірювання випромінювання вимірюється під кутом 90 о до лазера. Оскільки лазер забезпечує інтенсивне джерело випромінювання, яке може бути сфокусовано на вузькій точці, межі виявлення становлять лише 10 —16 М.
Розчини, які не поглинають УФ-випромінювання або не піддаються флуоресценції, можуть бути виявлені іншими детекторами. У таблиці Template:index наведено перелік детекторів капілярного електрофорезу разом з деякими їх важливими характеристиками.
| детектор | вибірковість (універсальний або аналітичний повинен...) | виявлення обмежене (родимки вводяться) | межа виявлення (молярність) | виявлення на колонці? |
|---|---|---|---|---|
| Поглинання УФ/Віс | мають УФ/VIS хромофор | \(10^{-13} - 10^{-16}\) | \(10^{-5} - 10^{-7}\) | так |
| непряме поглинання | універсальні | \(10^{-12} - 10^{-15}\) | \(10^{-4} - 10^{-6}\) | так |
| флуоресценції | мають сприятливий квантовий вихід | \(10^{-13} - 10^{-17}\) | \(10^{-7} - 10^{-9}\) | так |
| лазерна флуоресценція | мають сприятливий квантовий вихід | \(10^{-18} - 10^{-20}\) | \(10^{-13} - 10^{-16}\) | так |
| мас-спектрометр |
універсальний (загальний іон) селективний (одиночний іон) |
\(10^{-16} - 10^{-17}\) | \(10^{-8} - 10^{-10}\) | ні |
| амперометрія | піддаються окисленню або відновленню | \(10^{-18} - 10^{-19}\) | \(10^{-7} - 10^{-10}\) | ні |
| провідність | універсальні | \(10^{-15} - 10^{-16}\) | \(10^{-7} - 10^{-9}\) | ні |
| радіометричних | бути радіоактивним | \(10^{-17} - 10^{-19}\) | \(10^{-10} - 10^{-12}\) | так |
Методи капілярного електрофорезу
Існує кілька різних форм капілярного електрофорезу, кожна з яких має свої особливі переваги. Чотири з цих способів описані коротко в цьому розділі.
Електрофорез капілярної зони (CZE)
Найпростіша форма капілярного електрофорезу - електрофорез капілярної зони. У ЧЗЕ заповнюємо капілярну трубку буфером і після завантаження зразка поміщаємо кінці капілярної трубки в резервуари, які містять додатковий буфер. Зазвичай кінець капіляра, що містить зразок, є анодом, а розчинені речовини мігрують до катода зі швидкістю, визначеною їх відповідними електрофоретичними рухливістю та електроосмотичним потоком. Спочатку виділяють катіони, з меншими, більш сильно зарядженими катіонами, що елютують перед більшими катіонами з меншими зарядами Нейтральні види елют як єдина смуга. Аніони - останній вид, який елітує, причому менші, більш негативно заряджені аніони є останніми, хто елітує.
Ми можемо змінити напрямок електроосмотичного потоку, додавши в буферний розчин алкіламмонієву сіль. Як показано на рисунку Template:index}, позитивно заряджений кінець іонів алкіламонію зв'язується з негативно зарядженими іонами силанату на стінках капілярів. Хвіст іона алкіламонію гідрофобний і асоціюється з хвостом іншого алкіламонійного іона. В результаті виходить шар позитивних зарядів, які притягують аніони в буфері. Міграція цих розчинених аніонів до анода змінює напрямок електроосмотичного потоку. Порядок елюції прямо протилежний тому, що спостерігається в нормальних умовах.
Покриття стінок капіляра неіоногенним реагентом усуває електроосмотичний потік. У такому вигляді ЦЗЕ катіони мігрують від анода до катода. Аніони елітують у вихідний резервуар, а нейтральні види залишаються нерухомими.
Електрофорез капілярної зони забезпечує ефективне відділення заряджених видів, включаючи неорганічні аніони та катіони, органічні кислоти та аміни, а також великі біомолекули, такі як білки. Наприклад, CZE використовувався для поділу суміші 36 неорганічних і органічних іонів менш ніж за три хвилини [Jones, W.R.; Jandik, P. J Chromatog. 1992, 608, 385—393]. Суміш нейтральних видів, звичайно, не може бути дозволена.
Міцелярна електрокінетична капілярна хроматографія (MEKC)
Одним з обмежень до CZE є його нездатність відокремлювати нейтральні види. Міцелярна електрокінетична капілярна хроматографія долає це обмеження, додаючи до буферного розчину поверхнево-активну речовину, таку як додецилсульфат натрію (рис. Template:index a). Додецилсульфат натрію, або SDS, складається з довголанцюгового гідрофобного хвоста і негативно зарядженої іонної функціональної групи на його голові. Коли концентрація СДС досить велика, утворюється міцелла. Міцелла складається з сферичної агломерації 40-100 молекул поверхнево-активної речовини, в якій хвости вуглеводнів спрямовані всередину, а негативно заряджені головки спрямовані назовні (рис. Template:index b).
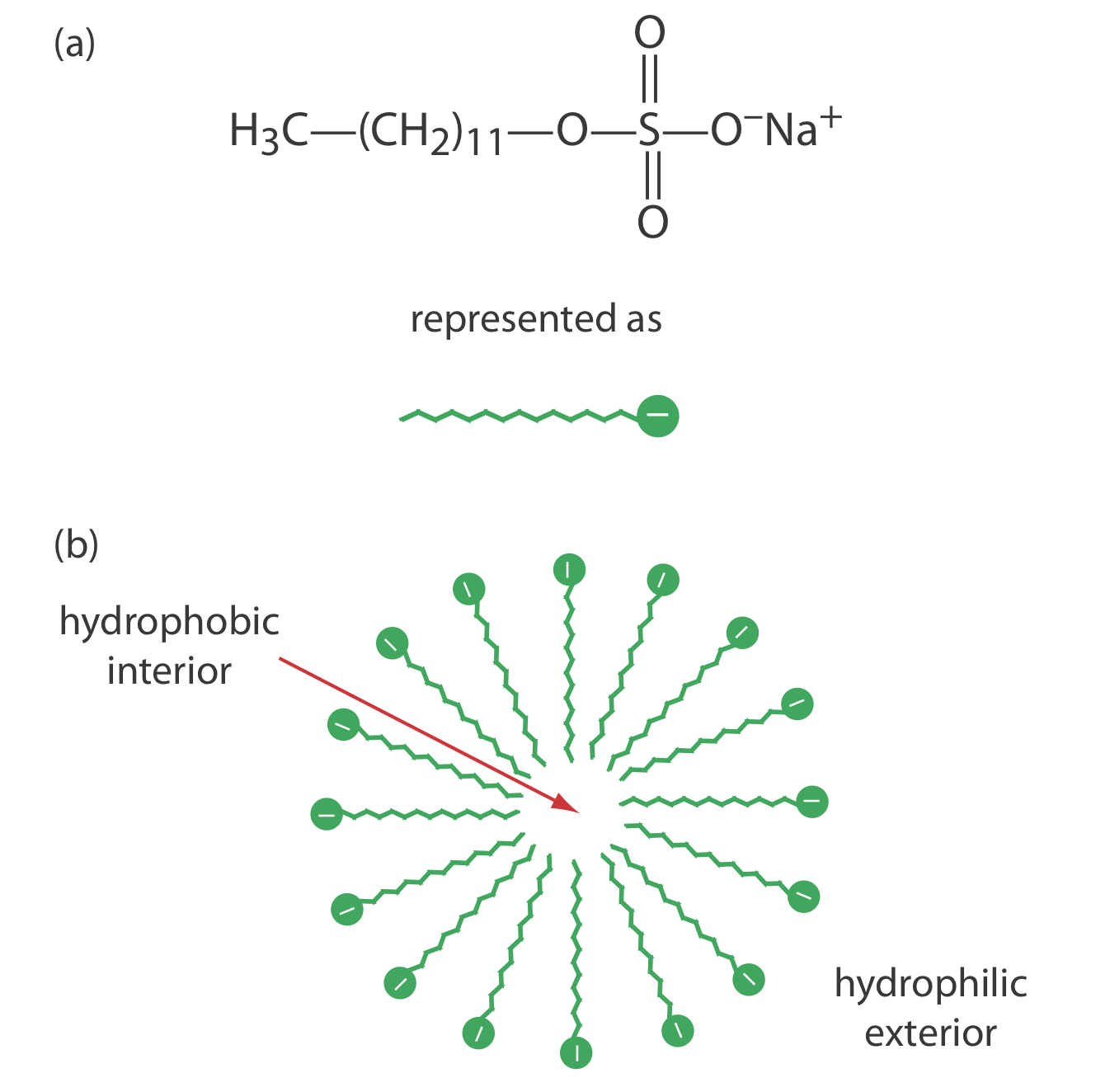
Оскільки міцели мають негативний заряд, вони мігрують до катода зі швидкістю, меншою за швидкість електроосмотичного потоку. Нейтральні види розподіляють себе між міцелами та буферним розчином таким чином, як розподіл розчинених речовин між двома рідкими фазами у ВЕРХ. Оскільки існує поділ між двома фазами, ми включаємо описовий термін хроматографія в назву техніки. Зверніть увагу, що в MEKC обидві фази рухливі.
Порядок елюції для нейтральних видів у MEKC залежить від того, наскільки кожен вид розділяється на міцели. Гідрофільні нейтрали нерозчинні у гідрофобному внутрішньому середовищі міцели і елутуються як одна смуга, як це було б у CZE. Нейтральні розчинні речовини, які надзвичайно гідрофобні, повністю розчиняються в міцеллі, елююючи міцелами як єдину смугу. Ті нейтральні види, які існують в рівновазі перегородки між буфером і міцелами, елютують між повністю гідрофільними і повністю гідрофобними нейтральними видами. Ті нейтральні види, які сприяють буферному елюту перед тими, що надають перевагу міцелам. Міцелярна електрокінетична хроматографія використовується для поділу найрізноманітніших зразків, включаючи суміші фармацевтичних сполук, вітамінів та вибухових речовин.
Капілярний гель електрофорез (CGE)
При капілярному гелевому електрофорезі капілярна трубка заповнюється полімерним гелем. Оскільки гель пористий, розчинена речовина мігрує через гель зі швидкістю, що визначається як його електрофоретичної рухливістю, так і розміром. Здатність впливати на поділ за розміром корисна, коли розчинені речовини мають подібні електрофоретичні рухливості. Наприклад, фрагменти ДНК різної довжини мають схожі співвідношення заряду до розміру, що ускладнює їх поділ за допомогою CZE. Оскільки фрагменти ДНК мають різний розмір, можливе поділ КГЕ.
Капіляр, що використовується для КГЕ, зазвичай обробляється для усунення електроосмотичного потоку, щоб запобігти екструзії гелю з капілярної трубки. Зразки вводять електрокінетично, оскільки гель забезпечує занадто великий опір для гідродинамічного відбору проб. Первинне застосування КГЕ - поділ великих біомолекул, включаючи фрагменти ДНК, білки та олігонуклеотиди.
Капілярна електрохроматографія (ЦВК)
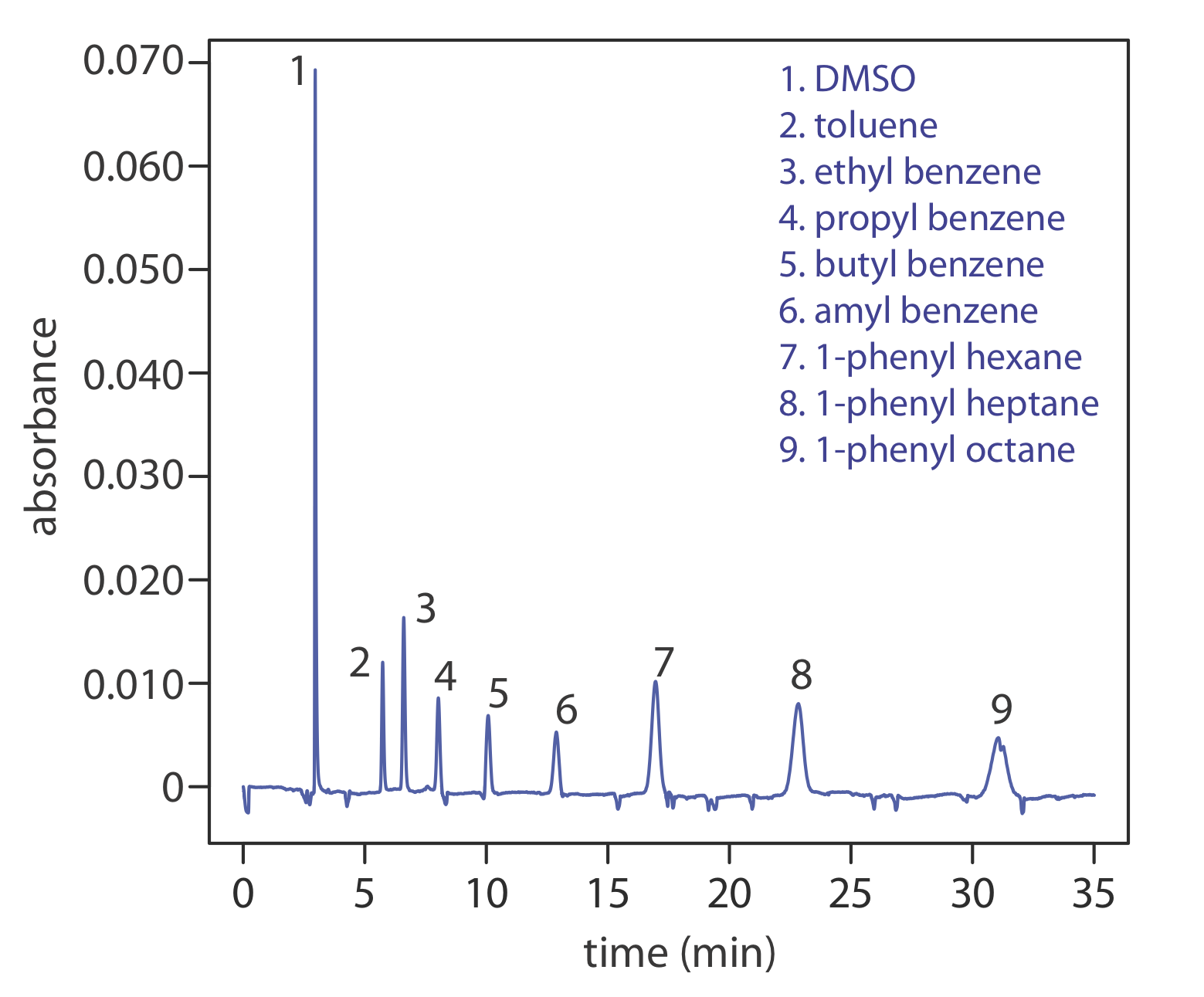
Ще одним підходом до поділу нейтральних видів є капілярна електрохроматографія. У ЦВК капілярна трубка упакована частинками 1,5-3 мкм, покритими зв'язаною стаціонарною фазою. Нейтральні види відокремлюються виходячи з їх здатності розділяти між стаціонарною фазою і буфером, який рухається в результаті електроосмотичного потоку; рис. Template:index є репрезентативним прикладом для поділу суміші вуглеводнів. Розділення CEC схоже на аналогічне поділу ВЕРХ, але без необхідності використання насосів високого тиску. Ефективність у ЦВК краща, ніж у ВЕРХ, а час аналізу коротший.
Найкращий спосіб оцінити теоретичні та практичні деталі, розглянуті в цьому розділі, - це уважно вивчити типовий аналітичний метод. Хоча кожен метод унікальний, наступний опис визначення комплексу вітаміну В методом електрофорезу капілярної зони або за допомогою міцелярної електрокінетичної капілярної хроматографії дає повчальний приклад типової процедури. Опис тут заснований на Сміт, У.Ф. Аналітична хімічна історія складних матриць, Willey Teubner: Чичестер, Англія, 1996, pp. 154—156.
Представницький метод 12.7.1: Визначення комплексу вітаміну В методом CZE або MEKC
Опис методу
Водорозчинні вітаміни В 1 (гідрохлорид тіаміну), B 2 (рибофлавін), B 3 (ніацинамід) та B 6 (піридоксину гідрохлорид) визначаються за допомогою CZE за допомогою рН 9 натрію тетраборат-дигідрофосфатного буфера, або MEKC за допомогою того ж буфера з додавання додецилсульфату натрію. Виявлення відбувається шляхом поглинання УФ при 200 нм. Внутрішній стандарт о -етоксибензаміду використовується для стандартизації методу.
Порядок дій
Подрібніть таблетку комплексу вітаміну В і помістіть її в склянку з 20,00 мл 50% v/v розчину метанолу, який 20 мМ в тетрабораті натрію і 100,0 ppm в o -етоксибензамід. Після перемішування протягом 2 хв, щоб забезпечити розчинення вітамінів групи В, пропустіть порцію 5,00 мл через фільтр 0,45 мкм для видалення нерозчинних в'яжучих речовин. Завантажте зразок приблизно 4 нЛ в капілярну колону з внутрішнім діаметром 50 мкм. Для CZE капілярна колонка містить 20 мМ рН 9 натрію тетраборат-дигідрофосфатний буфер. Для MEKC буфер також становить 150 мМ у додецилсульфаті натрію. Застосовуйте електричне поле 40 кВ/м, щоб впливати як на поділ CZE, так і MEKC.
Питання
1. Метанол, який елююється при 4,69 хв, включається як нейтральний вид для позначення електроосмотичного потоку. При використанні стандартних розчинів кожного вітаміну піки CZE виявляються на 3,41 хв, 4,69 хв, 6,31 хв і 8,31 хв. Вивчіть структури і p K a інформацію на рис. Template:index і визначити порядок, в якому виділяються чотири вітаміни групи В.
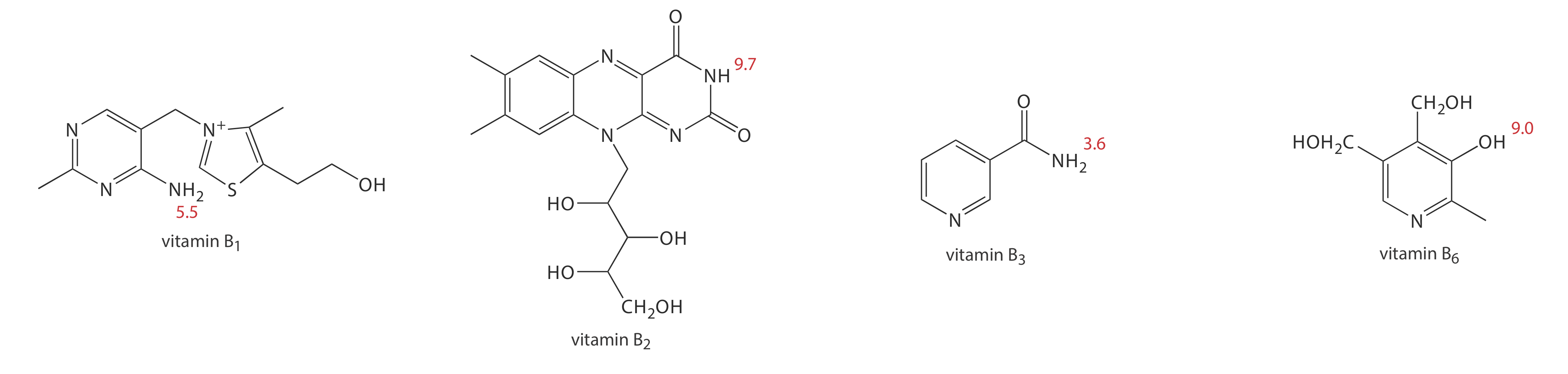
При рН 9 вітамін B 1 є катіоном і елююється перед нейтральним видом метанолу; таким чином, це сполука, яка елююється за 3,41 хв. Вітамін В 3 - нейтральний вид при рН 9 і елютується метанолом при 4,69 хв. Решта два вітаміни групи В - це слабкі кислоти, які частково іонізуються до слабких базових аніонів при рН 9. З двох вітамін В 6 є сильнішою кислотою (а р К а 9,0 проти р К а 9,7) і присутній більшою мірою в аніонній формі. Отже, вітамін B 6 є останнім з вітамінів, які слід елітувати.
2. Порядок елюції при використанні МЕКЦ - вітамін В 3 (5,58 хв), вітамін В 6 (6,59 хв), вітамін В 2 (8,81 хв) і вітамін В 1 (11,21 хв). Які висновки можна зробити про розчинність вітамінів групи В в міцелах додецилсульфату натрію? Міцели елютуються на 17,7 хв.
Час елюції вітаміну В1 показує найбільшу зміну, збільшившись з 3,41 хв до 11,21 хв. Ясно вітамін В 1 має найбільшу розчинність в міцелах. Вітамін В 2 і вітамін В3 мають більш обмежену розчинність в міцелах і показують лише трохи більше часу елюції в присутності міцел. Цікаво, що час елюції вітаміну В6 зменшується в присутності міцел.
3. Для кількісної роботи до всіх зразків і стандартів додається внутрішній стандарт о -етоксибензаміду. Навіщо потрібен внутрішній стандарт?
Хоча метод уприскування не вказаний, ні гідродинамічна ін'єкція, ні електрокінетична ін'єкція не особливо відтворюються. Використання внутрішнього стандарту компенсує це обмеження.
Оцінка
У порівнянні з ГК та ВЕРХ капілярний електрофорез забезпечує аналогічні рівні точності, точності та чутливості, і забезпечує порівнянну ступінь селективності. Кількість матеріалу, що вводиться в капілярну електрофоретичну колонку, значно менша, ніж для ГК та ВЭЖХ - зазвичай 1 нЛ проти 0,1 мкл для капілярної ГК та 1—100 мкл для ВЕРХ. Однак межі виявлення капілярного електрофорезу в 100—1000 разів бідніші, ніж для ГК та ВЕРХ. Найбільш значними перевагами капілярного електрофорезу є поліпшення ефективності поділу, часу та вартості. Капілярні електрофоретичні колони містять значно більше теоретичних пластин (\(\approx 10^6\)пластин/м), ніж у ВЕРХ (\(\approx 10^5\)пластини/м) та капілярних колонках ГК (\(\approx 10^3\)пластини/м), забезпечуючи неперевершену роздільну здатність та пікову потужність. Виділення при капілярному електрофорезі проходять швидко і ефективно. Крім того, невеликий обсяг капілярної колонки означає, що для поділу капілярного електрофорезу потрібно лише кілька мікролітрів буфера, порівняно з 20-30 мл рухомої фази для типового поділу ВЕРХ.
