12.2: Загальна теорія колоночної хроматографії
- Page ID
- 24902
З двох методів приведення стаціонарної фази і рухомої фаз в контакт найважливішим є колонкова хроматографія. У цьому розділі ми розробляємо загальну теорію, яку ми можемо застосувати до будь-якої форми колоночної хроматографії.
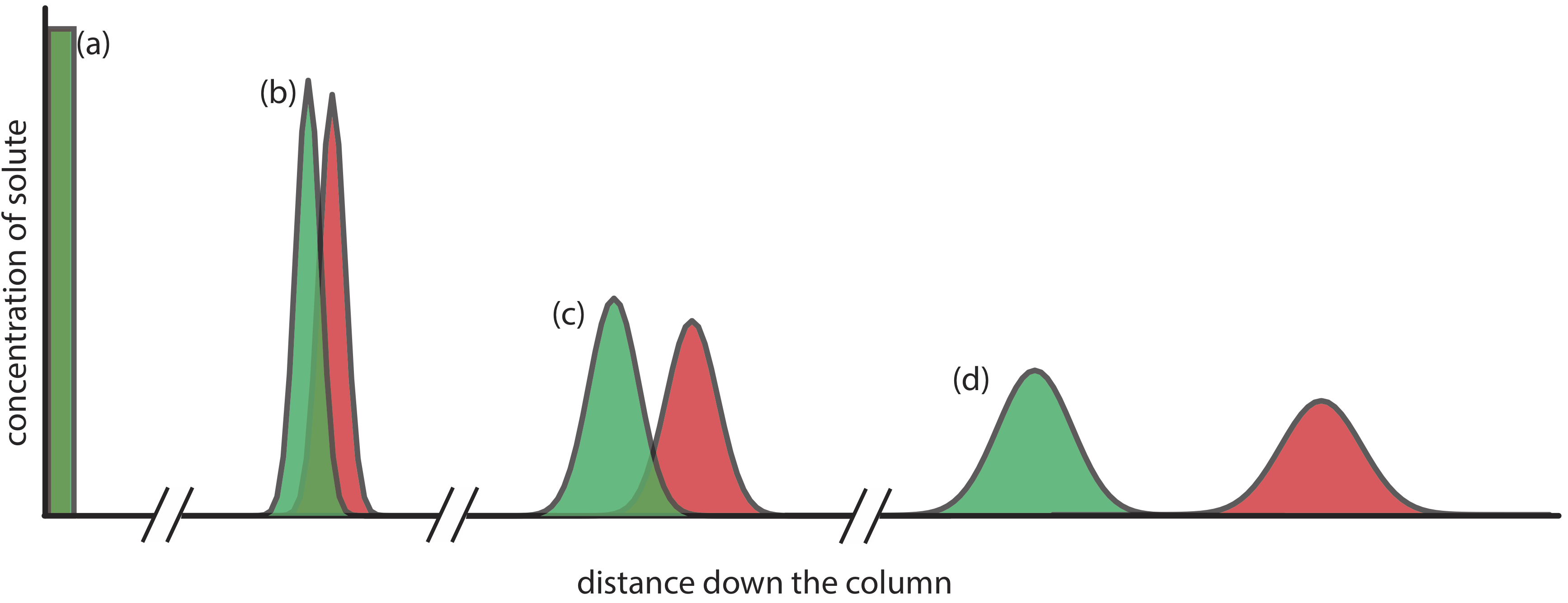
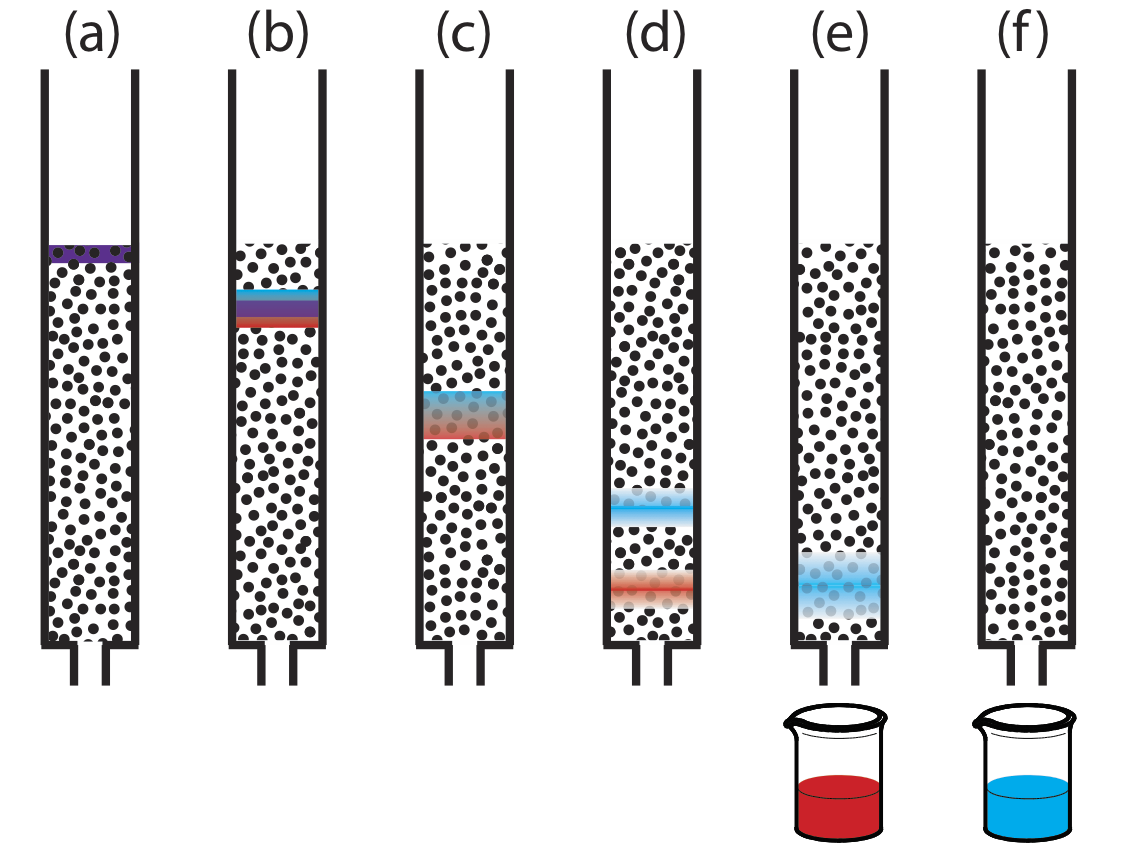
Рисунок Template:index надає простий вигляд експерименту з хроматографії рідина — тверда колонка. Зразок вводиться у вигляді вузької смуги у верхній частині колони. В ідеалі початковий профіль концентрації розчиненої речовини прямокутний (Рисунок Template:index a). Коли зразок рухається вниз по колонці, розчинні речовини починають відокремлюватися (рис. Template:index b, c) і окремі смуги розчинених речовин починають розширюватися і розвивати профіль Гаусса (Рисунок Template:index b, c). Якщо сила взаємодії кожного розчиненого речовини зі стаціонарною фазою досить різна, то розчинні речовини поділяються на окремі смуги (рис. Template:index d та Figure {{Template.index (ID:2)} d).
|
Рисунок Template:index. Альтернативний вид поділу на рисунку Template:index показує концентрацію кожного розчиненого речовини як функцію відстані вниз по колонці. |
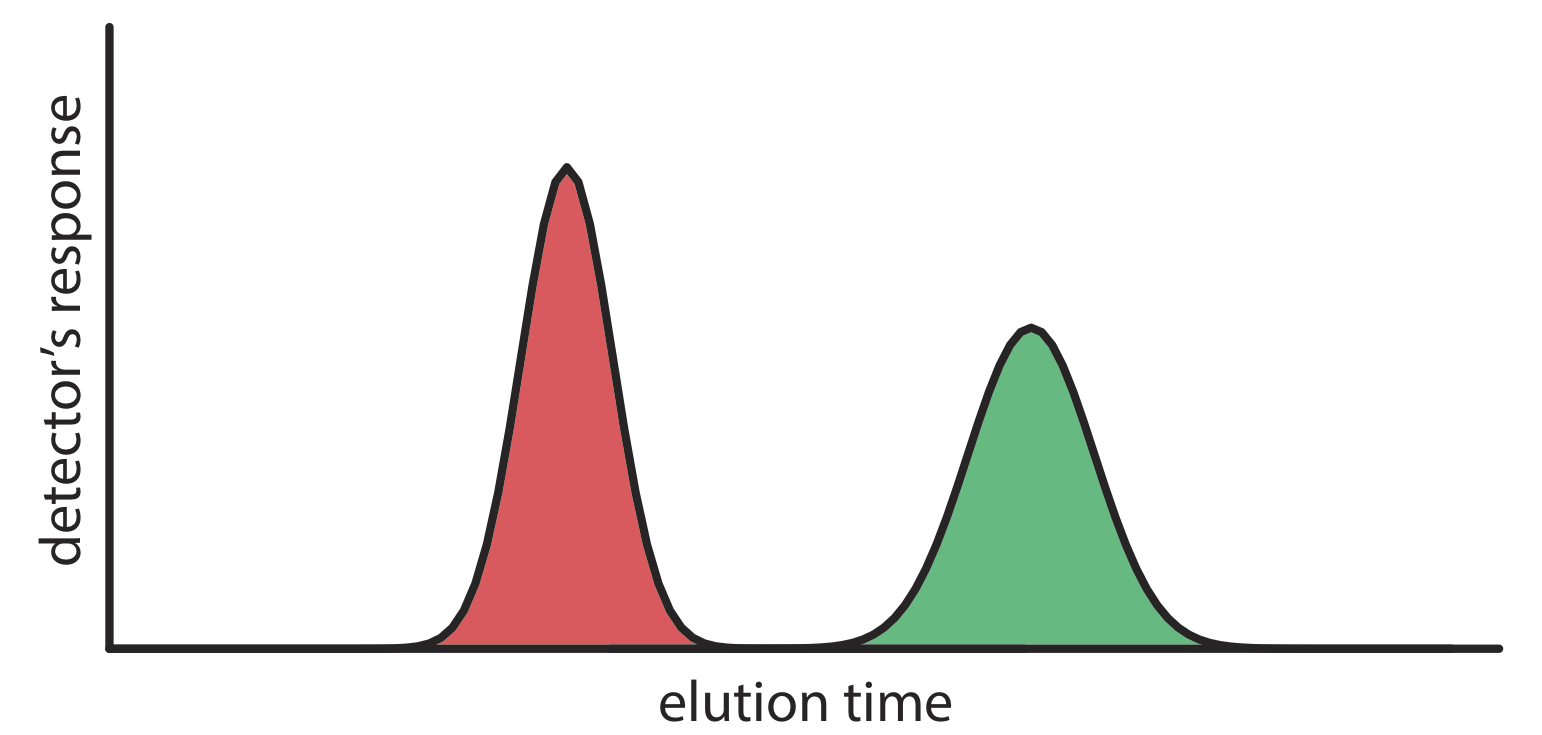
Ми можемо стежити за ходом поділу, збираючи дроби, коли вони вилучаються зі стовпця (Рисунок Template:index e, f) або розміщуючи відповідний детектор в кінці стовпця. Графік відгуку детектора як функція часу елюції або як функція об'єму рухомої фази, відомий як хроматограма (рис. Template:index і складається з піку для кожного розчиненого речовини.
Існує багато можливих детекторів, які ми можемо використовувати для моніторингу поділу. Пізніше розділи цієї глави описують деякі з найпопулярніших.
Охарактеризувати властивості хроматографічного піку можна кількома способами, два з яких показані на малюнку Template:index. Час утримання, t r, - це час між ін'єкцією зразка та максимальною реакцією на пік розчиненої речовини. Ширина базової лінії хроматографічного піку w, як показано на рисунку Template:index, визначається шляхом розширення дотичних ліній від точок перегину по обидва боки піку через базову лінію. Хоча зазвичай ми повідомляємо t r і w, використовуючи одиниці часу, ми можемо повідомити про них, використовуючи одиниці об'єму, множивши кожну на швидкість рухомої фази, або повідомляти про них в лінійних одиницях, вимірюючи відстані за допомогою лінійки.
Наприклад, обсяг утримання розчиненої речовини, V r, - це\(t_\text{r} \times u\) де u - швидкість рухомої фази через колону.
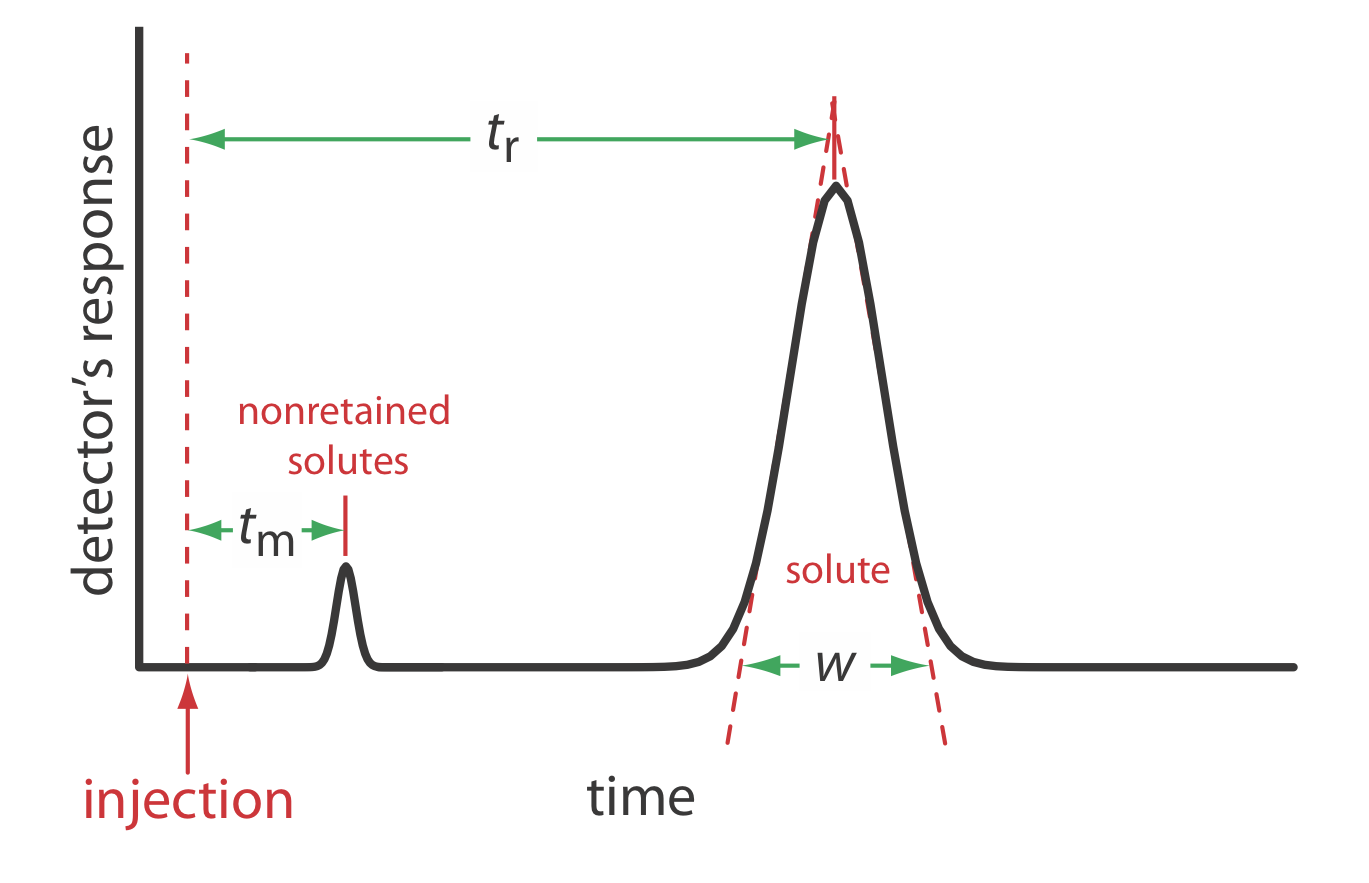
На додаток до піку розчиненої речовини, Рисунок Template:index також показує невеликий пік, який елююється незабаром після введення зразка в рухливу фазу. Цей пік містить всі незбережені розчинені речовини, які рухаються по колоні з тією ж швидкістю, що і рухлива фаза. Час, необхідний для відведення незатриманих розчинених речовин, називається часом порожнечі колони, т м.
Хроматографічна роздільна здатність
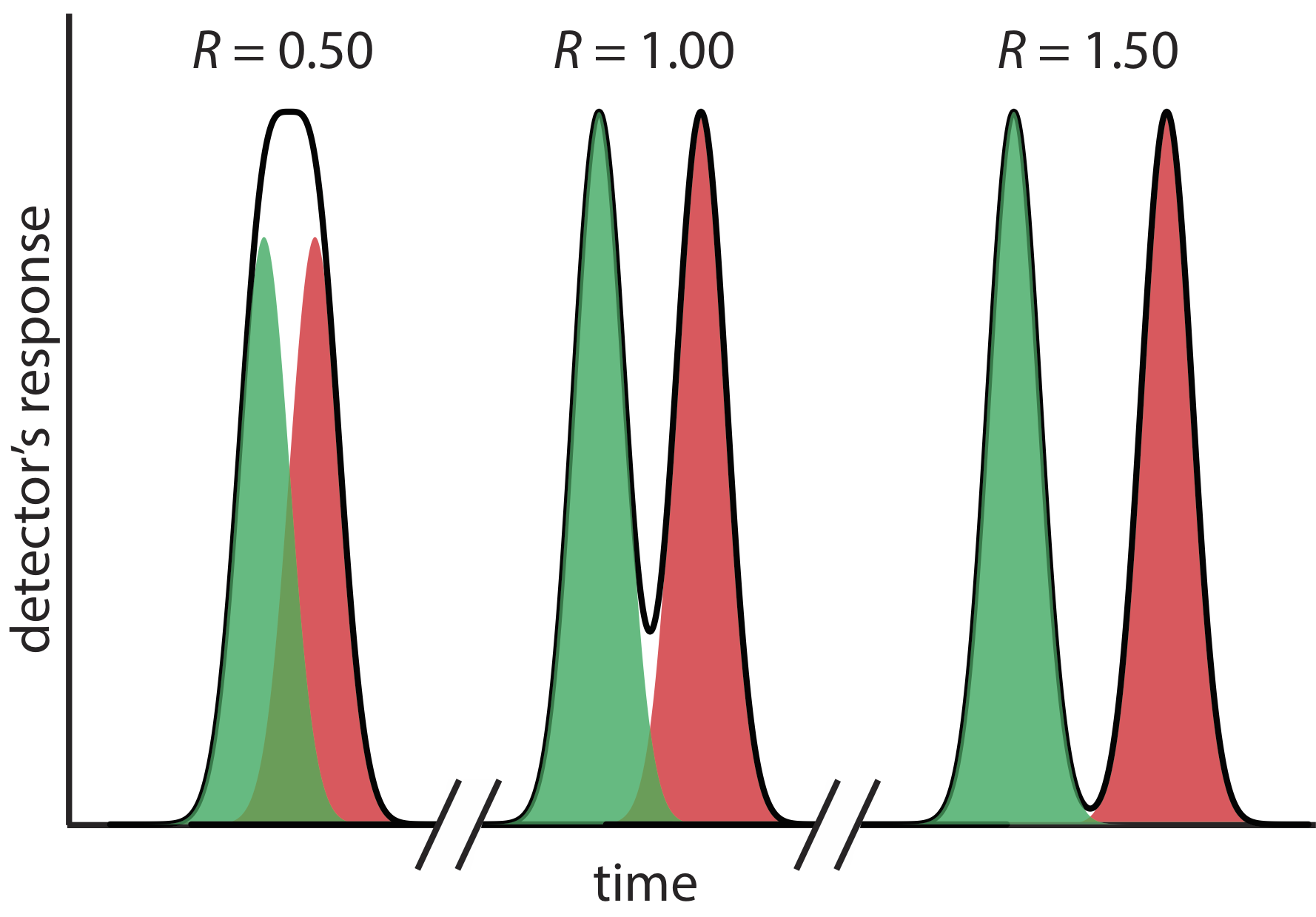
Метою хроматографії є поділ суміші на ряд хроматографічних піків, кожен з яких становить єдиний компонент суміші. Роздільна здатність між двома хроматографічними піками, R AB, є кількісною мірою їх поділу, і визначається як
де B - пізніша елюація двох розчинених речовин. Як показано на малюнку Template:index, поділ двох хроматографічних піків поліпшується зі збільшенням R AB. Якщо ділянки під двома вершинами однакові - як це відбувається на малюнку Template:index, то роздільна здатність 1,50 відповідає перекриттю лише 0,13% для двох профілів елюації. Оскільки роздільна здатність є кількісною мірою успіху поділу, це корисний спосіб визначити, чи призводить зміна експериментальних умов до кращого поділу.
При хроматографічному аналізі лимонної олії пік для лімонен має час утримання 8,36 хв при ширині базової лінії 0,96 хв. \(\gamma\)-Терпінен елютує при 9,54 хв при ширині базової лінії 0,64 хв. Яка роздільна здатність між двома піками?
Рішення
Використовуючи Equation\ ref {12.1}, ми знаходимо, що роздільна здатність
\[R_{A B}=\frac{2 \Delta t_{r}}{w_{B}+w_{A}}=\frac{2(9.54 \text{ min}-8.36 \text{ min})}{0.64 \text{ min}+0.96 \text{ min}}=1.48 \nonumber\]
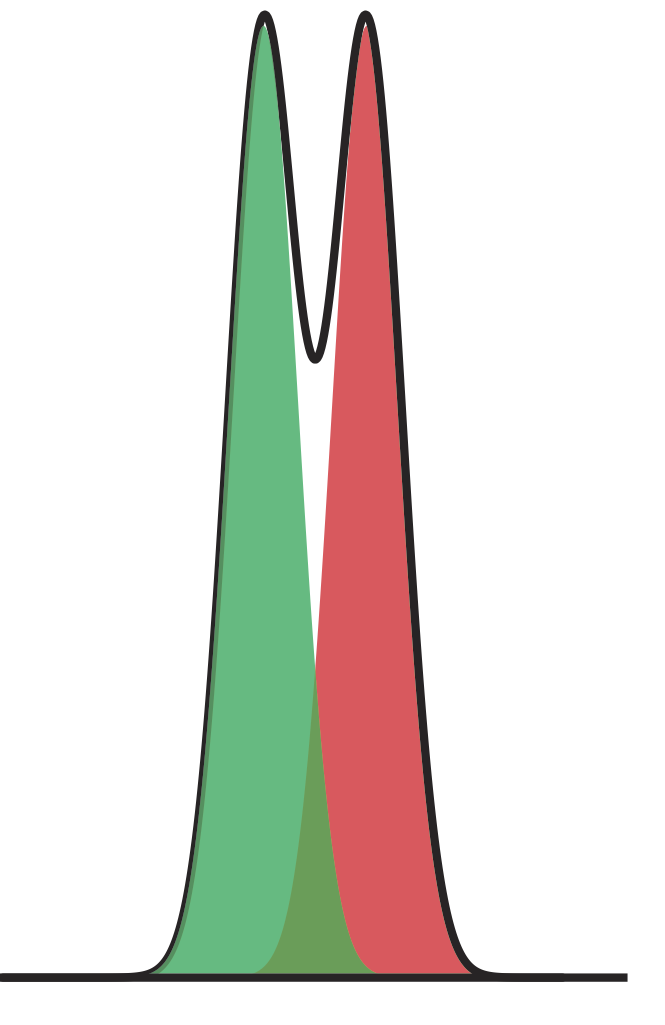
На малюнку Template:index показано поділ двокомпонентної суміші. Яка роздільна здатність між двома компонентами? Використовуйте лінійку для вимірювання\(\Delta t_\text{r}\), w A і w B в міліметрах.
- Відповідь
-
Оскільки зв'язок між часом елюції та відстанню пропорційна, ми можемо виміряти\(\Delta t_\text{r}\), w A та w B за допомогою лінійки. Мої вимірювання становлять 8,5 мм для\(\Delta t_\text{r}\), і 12,0 мм кожен для w A і w B. Використовуючи ці значення, роздільна здатність дорівнює
\[R_{A B}=\frac{2 \Delta t_{t}}{w_{A}+w_{B}}=\frac{2(8.5 \text{ mm})}{12.0 \text{ mm}+12.0 \text{ mm}}=0.70 \nonumber\]
Ваші вимірювання для\(\Delta t_\text{r}\), w A та w B залежатимуть від відносного розміру монітора або роздруківки; однак ваше значення роздільної здатності має бути подібним до відповіді вище.
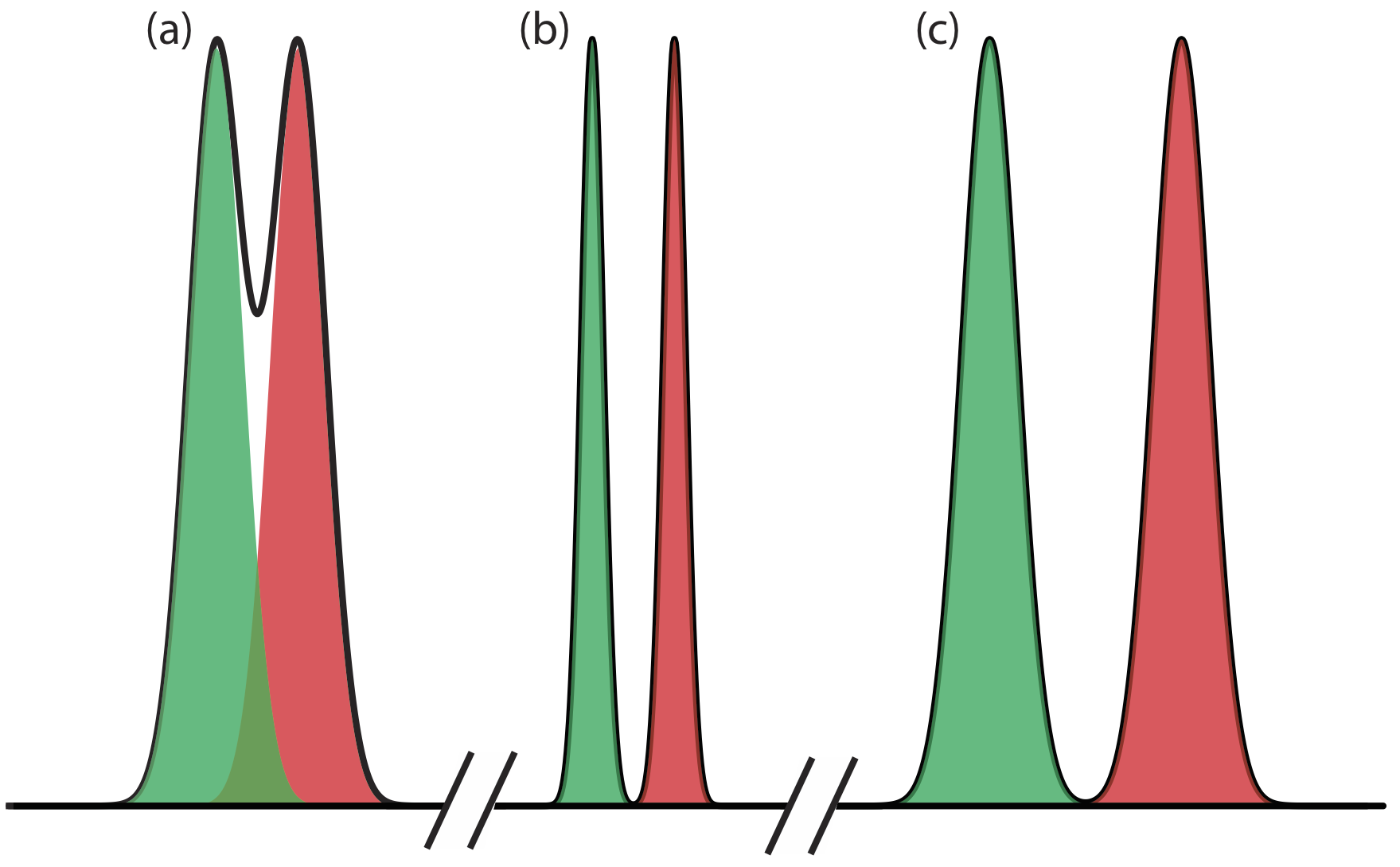
Рівняння\ ref {12.1} говорить про те, що ми можемо покращити роздільну здатність\(\Delta t_\text{r}\), збільшивши або зменшивши w A та w B (Рисунок Template:index). Для збільшення\(\Delta t_\text{r}\) ми можемо використовувати одну з двох стратегій. Один з підходів полягає в регулюванні умов поділу так, щоб обидва розчинених речовини витрачали менше часу в мобільній фазі - тобто ми збільшуємо коефіцієнт утримання кожного розчиненого речовини - що забезпечує більше часу для здійснення поділу. Другий підхід полягає в підвищенні вибірковості шляхом коригування умов так, щоб лише одна розчинена речовина зазнала значної зміни часу його утримання. Базова ширина піку розчиненої речовини залежить від руху розчинених речовин всередині та між рухомою фазою та стаціонарною фазою, і регулюється кількома факторами, які в сукупності ми називаємо ефективністю колонки. Ми розглянемо кожен з цих підходів для поліпшення дозволу більш детально, але спочатку треба визначитися з деякими термінами.
Фактор утримання розчинених речовин
Припустимо, що ми можемо описати розподіл розчиненої речовини між рухомою фазою та стаціонарною фазою, використовуючи наступну реакцію рівноваги
\[S_{\text{m}} \rightleftharpoons S_{\text{s}} \nonumber\]
де S m - розчинена речовина в рухомій фазі, а S - розчинена речовина в стаціонарній фазі. Відповідно до того ж підходу, який ми використовували в розділі 7.7 для екстракції рідина-рідина, постійною рівноваги для цієї реакції є коефіцієнт рівноважного розподілу, K D.
\[K_{D}=\frac{\left[S_{\mathrm{s}}\right]}{\left[S_\text{m}\right]} \nonumber\]
Це не банальне припущення. У цьому розділі ми фактично обробляємо рівновагу розчиненої речовини між рухомою фазою та стаціонарною фазою так, ніби вона ідентична рівновазі при екстракції рідини та рідини. Ви можете поставити під сумнів, чи є це розумним припущенням. Існує важлива різниця між двома експериментами, які нам потрібно розглянути. У екстракції рідина-рідина, яка відбувається в сепараторній воронці, дві фази залишаються в контакті один з одним у будь-який час, що дозволяє досягти справжньої рівноваги. Однак у хроматографії рухлива фаза знаходиться в постійному русі. Розчинена речовина, яка рухається в стаціонарну фазу з рухомої фази, врівноважиться назад в іншу частину рухомої фази; це не описує справжньої рівноваги.
Отже, ми знову запитуємо: Чи можемо ми розглядати розподіл розчиненої речовини між рухомою фазою та стаціонарною фазою як рівноважний процес? Відповідь - так, якщо швидкість рухомої фази повільна щодо кінетики руху розчиненої речовини вперед-назад між двома фазами. Загалом, це розумне припущення.
При відсутності будь-яких додаткових реакцій рівноваги в рухомій фазі або стаціонарній фазі K D еквівалентний коефіцієнту розподілу, D,
де V s і V m - обсяги стаціонарної фази і рухомої фази відповідно.
Збереження маси вимагає, щоб загальні молі розчиненої речовини залишалися постійними протягом усього поділу; таким чином, ми знаємо, що наступне рівняння є істинним.
Розв'язування рівняння\ ref {12.3} для молів розчиненої речовини в стаціонарній фазі та заміщення на рівняння\ ref {12.2} залишає нас
\[D = \frac{\left\{(\text{mol S})_{\text{tot}} - (\text{mol S})_\text{m}\right\} / V_{\mathrm{s}}}{(\text{mol S})_{\mathrm{m}} / V_{\mathrm{m}}} \nonumber\]
Перестановка цього рівняння і розв'язування для частки розчиненої речовини в рухомій фазі, f m, дає
який ідентичний результату для екстракції рідина-рідина (див. Розділ 7). Оскільки ми можемо не знати точних обсягів стаціонарної фази та рухомої фази, ми спрощуємо Equation\ ref {12.4} діливши чисельник і знаменник на V m; таким чином
де k
\[k=D \times \frac{V_\text{s}}{V_\text{m}} \label{12.6}\]
є фактором утримання розчиненої речовини. Зверніть увагу, що чим більший коефіцієнт утримання, тим більше коефіцієнт розподілу сприяє стаціонарній фазі, що призводить до більш сильно затриманого розчиненого речовини та більш тривалого часу утримання.
Іншими (старими) іменами коефіцієнта збереження є коефіцієнт ємності, коефіцієнт ємності та коефіцієнт розділів, і іноді йому надається символ\(k^{\prime}\). Майте це на увазі, якщо ви використовуєте інші ресурси. Коефіцієнт утримання - це затверджена назва із Золотої книги IUPAC.
Ми можемо визначити коефіцієнт утримання розчиненої речовини з хроматограми, вимірюючи час порожнечі стовпця, t m та час утримання розчиненої речовини, t r (див. Рисунок Template:index). Розв'язуючи рівняння\ ref {12.5} для k, ми знаходимо, що
\[k=\frac{1-f_\text{m}}{f_\text{m}} \label{12.7}\]
Раніше ми визначали f m як частку розчиненої речовини в рухомій фазі. Припускаючи постійну рухливу фазову швидкість, ми також можемо визначити f m як
\[f_\text{m}=\frac{\text { time spent in the mobile phase }}{\text { time spent in the stationary phase }}=\frac{t_\text{m}}{t_\text{r}} \nonumber\]
Підставляючи назад в рівняння\ ref {12.7} і перестановка залишає нас
де\(t_\text{r}^{\prime}\) - скоригований час утримання.
При хроматографічному аналізі низькомолекулярних кислот масляна кислота елютується з часом утримання 7,63 хв. Час порожнечі колонки становить 0,31 хв. Розрахуйте коефіцієнт утримання масляної кислоти.
Рішення
\[k_{\mathrm{but}}=\frac{t_{\mathrm{r}}-t_{\mathrm{m}}}{t_{\mathrm{m}}}=\frac{7.63 \text{ min}-0.31 \text{ min}}{0.31 \text{ min}}=23.6 \nonumber\]
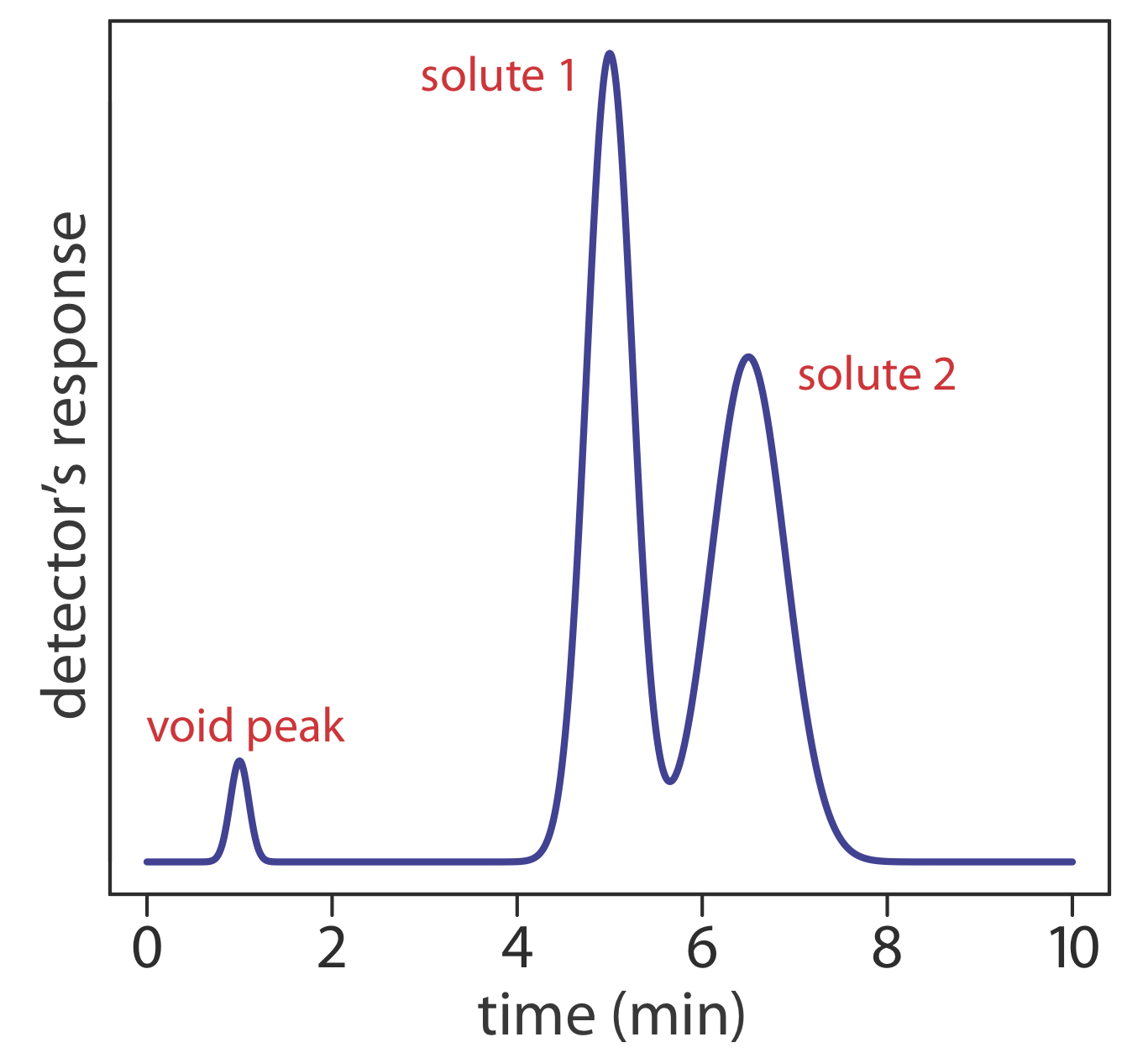
Рисунок Template:index - хроматограма для двокомпонентної суміші. Визначте коефіцієнт утримання для кожного розчиненого речовини, припускаючи, що зразок був введений під час t = 0.
- Відповідь
-
Оскільки зв'язок між часом елюції та відстанню пропорційна, ми можемо виміряти t m, t r,1 та t r2 за допомогою лінійки. Мої виміри - 7,8 мм, 40,2 мм, і 51,5 мм відповідно. Використовуючи ці значення, коефіцієнти утримання розчиненої речовини A та розчиненої речовини B є
\[k_{1}=\frac{t_{\mathrm{r} 1}-t_\text{m}}{t_\text{m}}=\frac{40.2 \text{ mm}-7.8 \text{ mm}}{7.8 \text{ mm}}=4.15 \nonumber\]
\[k_{2}=\frac{t_{\mathrm{r} 2}-t_\text{m}}{t_\text{m}}=\frac{51.5 \text{ mm}-7.8 \text{ mm}}{7.8 \text{ mm}}=5.60 \nonumber\]
Ваші вимірювання для t m, t r,1 та t r2 залежатимуть від відносного розміру вашого монітора або роздруківки; однак ваше значення роздільної здатності має бути подібним до відповіді вище.
Вибірковість
Селективність - це відносна міра утримання двох розчинених речовин, яку ми визначаємо за допомогою коефіцієнта селективності,\(\alpha\)
\[\alpha=\frac{k_{B}}{k_{A}}=\frac{t_{r, B}-t_{\mathrm{m}}}{t_{r, A}-t_{\mathrm{m}}} \label{12.9}\]
де розчинена речовина А має менший час утримання. Коли два розчинені речовини елют з однаковим часом утримання,\(\alpha = 1.00\); для всіх інших умов\(\alpha > 1.00\).
У хроматографічному аналізі для низькомолекулярних кислот, описаних у прикладі Template:index, час утримання ізобатинової кислоти становить 5,98 хв. Який коефіцієнт селективності для ізотмасляної кислоти та масляної кислоти?
Рішення
Спочатку ми повинні розрахувати коефіцієнт утримання для ізотмасляной кислоти. Використовуючи час порожнечі з Приклад Template:index, ми маємо
\[k_{\mathrm{iso}}=\frac{t_{\mathrm{r}}-t_{\mathrm{m}}}{t_{\mathrm{m}}}=\frac{5.98 \text{ min}-0.31 \text{ min}}{0.31 \text{ min}}=18.3 \nonumber\]
Отже, коефіцієнт вибірковості є
\[\alpha=\frac{k_{\text {but }}}{k_{\text {iso }}}=\frac{23.6}{18.3}=1.29 \nonumber\]
Визначте коефіцієнт селективності для хроматограми у Вправі Template:index.
- Відповідь
-
Використовуючи результати вправи Template:index, коефіцієнт вибірковості дорівнює
\[\alpha=\frac{k_{2}}{k_{1}}=\frac{5.60}{4.15}=1.35 \nonumber\]
Ваша відповідь може дещо відрізнятися через відмінності у ваших значеннях для двох факторів збереження.
Колонка Ефективність
Припустимо, ми вводимо зразок, який має єдиний компонент. На даний момент ми вводимо зразок, це вузька смуга скінченної ширини. Коли зразок проходить через колонку, ширина цієї смуги постійно збільшується в процесі, який ми називаємо розширенням смуги. Ефективність колонки є кількісним показником ступеня розширення смуги.
Див. Рисунок Template:index та рисунок Template:index. Коли ми впорскуємо зразок, він має рівномірний або прямокутний профіль концентрації щодо відстані вниз по колоні. Коли він проходить через колону, смуга розширюється і набуває профіль концентрації Гаусса.
У своїй оригінальній теоретичній моделі хроматографії Мартін і Синге розділили хроматографічну колону на дискретні розділи, які вони назвали теоретичними пластинами. Усередині кожної теоретичної пластини існує рівновага між розчиненою речовиною, присутньою в стаціонарній фазі, і розчиненою речовиною, присутньою в рухомій фазі [Мартін, А.Дж. П.; Синге, Р.Л. Дж. 1941, 35, 1358—1366]. Вони описали ККД колонки в перерахунку на кількість теоретичних пластин, N,
\[N=\frac{L}{H} \label{12.10}\]
де L - довжина колони, а H - висота теоретичної пластини. Для будь-якої даної колонки ефективність колони покращується - і хроматографічні піки стають вужчими - коли є більше теоретичних пластин.
Якщо припустити, що хроматографічний пік має профіль Гаусса, то ступінь розширення смуги задається дисперсією піку або стандартним відхиленням. Висота теоретичної пластини - це дисперсія піку на одиницю довжини колони
\[H=\frac{\sigma^{2}}{L} \label{12.11}\]
де стандартне відхилення\(\sigma\), має одиниці відстані. Оскільки час утримання та пікова ширина зазвичай вимірюються в секундах або хвилинах, зручніше виражати стандартне відхилення в одиницях часу\(\tau\),\(\sigma\) діливши на середню лінійну швидкість розчиненої речовини\(\overline{u}\), що еквівалентно поділу відстані, яку він проходить, L, за часом його утримання, т р.
\[\tau=\frac{\sigma}{\overline{u}}=\frac{\sigma t_{r}}{L} \label{12.12}\]
Для форми піку Гаусса ширина на базовій лінії w в чотири рази перевищує стандартне відхилення\(\tau\).
Об'єднання рівняння\ ref {12.11}, Equation\ ref {12.12} і Equation\ ref {12.13} визначає висоту теоретичної пластини через легко вимірювані хроматографічні параметри t r і w.
\[H=\frac{L w^{2}}{16 t_\text{r}^{2}} \label{12.14}\]
Розчісування рівняння\ ref {12.14} і рівняння\ ref {12.10} дає кількість теоретичних пластин.
\[N=16 \frac{t_{\mathrm{r}}^{2}}{w^{2}}=16\left(\frac{t_{\mathrm{r}}}{w}\right)^{2} \label{12.15}\]
Хроматографічний аналіз хлорованого пестициду Дільдрін дає пік з часом утримання 8,68 хв і базовою шириною 0,29 хв. Розрахувати кількість теоретичних табличок? З огляду на, що колона довжиною 2,0 м, яка висота теоретичної плити в мм?
Рішення
Використовуючи рівняння\ ref {12.15}, кількість теоретичних пластин дорівнює
\[N=16 \frac{t_{\mathrm{r}}^{2}}{w^{2}}=16 \times \frac{(8.68 \text{ min})^{2}}{(0.29 \text{ min})^{2}}=14300 \text{ plates} \nonumber\]
Розв'язування рівняння\ ref {12.10} для H дає середню висоту теоретичної пластини як
\[H=\frac{L}{N}=\frac{2.00 \text{ m}}{14300 \text{ plates}} \times \frac{1000 \text{ mm}}{\mathrm{m}}=0.14 \text{ mm} / \mathrm{plate} \nonumber\]
Для кожного розчиненого речовини в хроматограмі для вправи Template:index обчислити кількість теоретичних пластин і середню висоту теоретичної пластини. Колона довжиною 0,5 м.
- Відповідь
-
Оскільки зв'язок між часом елюції та відстанню пропорційна, ми можемо виміряти t r,1, t r,2, w 1 та w 2 за допомогою лінійки. Мої розміри 40,2 мм, 51,5 мм, 8,0 мм і 13,5 мм відповідно. Використовуючи ці значення, кількість теоретичних пластин для кожного розчиненого речовини становить
\[N_{1}=16 \frac{t_{r,1}^{2}}{w_{1}^{2}}=16 \times \frac{(40.2 \text{ mm})^{2}}{(8.0 \text{ mm})^{2}}=400 \text { theoretical plates } \nonumber\]
\[N_{2}=16 \frac{t_{r,2}^{2}}{w_{2}^{2}}=16 \times \frac{(51.5 \text{ mm})^{2}}{(13.5 \text{ mm})^{2}}=233 \text { theoretical plates } \nonumber\]
Висота теоретичної пластини для кожного розчиненого речовини
\[H_{1}=\frac{L}{N_{1}}=\frac{0.500 \text{ m}}{400 \text { plates }} \times \frac{1000 \text{ mm}}{\mathrm{m}}=1.2 \text{ mm} / \mathrm{plate} \nonumber\]
\[H_{2}=\frac{L}{N_{2}}=\frac{0.500 \text{ m}}{233 \text { plates }} \times \frac{1000 \text{ mm}}{\mathrm{m}}=2.15 \text{ mm} / \mathrm{plate} \nonumber\]
Ваші вимірювання для t r,1, t r,2, w 1 та w 2 залежатимуть від відносного розміру вашого монітора або роздруківки; однак ваші значення для N та H повинні бути подібними до відповідь вище.
Важливо пам'ятати, що теоретична пластина - це штучна конструкція і що хроматографічна колонка не містить фізичних пластин. Насправді кількість теоретичних пластин залежить як від властивостей колони, так і від розчиненого речовини. В результаті кількість теоретичних пластин для колони може варіюватися від розчиненої речовини до розчиненої речовини.
Пікова ємність
Однією з переваг підвищення ефективності колонки є те, що ми можемо розділити більше розчинених речовин з базовою роздільною здатністю. Однією з оцінок кількості розчинених речовин, які ми можемо розділити, є
\[n_{c}=1+\frac{\sqrt{N}}{4} \ln \frac{V_{\max }}{V_{\min }} \label{12.16}\]
де n c - пікова потужність колони, а V хв і V max - найменші та найбільші обсяги рухомої фази, в якій ми можемо елютувати та виявляти розчинену речовина [Giddings, J.C. Unified Separation Наука, Вілі-Міжнаукові: Нью-Йорк, 1991]. Колона з 10 000 теоретичних табличок, наприклад, може дозволити не більше
\[n_{c}=1+\frac{\sqrt{10000}}{4} \ln \frac{30 \mathrm{mL}}{1 \mathrm{mL}}=86 \text { solutes } \nonumber\]
якщо V min і V max становлять 1 мл і 30 мл відповідно. Ця оцінка забезпечує верхню межу кількості розчинених речовин і може допомогти нам виключити з розгляду стовпець, який не має достатньої кількості теоретичних пластин для поділу складної суміші. Тільки тому, що теоретична пікова потужність колонки більша за кількість розчинених речовин, однак, не означає, що поділ можливий. У більшості ситуацій практична пікова ємність менше теоретичної пікової ємності, оскільки характеристики утримання деяких розчинених речовин настільки схожі, що розділення неможливо. Проте, колони з більшою кількістю теоретичних пластин, або з більшим діапазоном можливих обсягів елюації, частіше виділяють складну суміш.
Найменший обсяг, який ми можемо використовувати, - це обсяг порожнечі стовпця. Найбільший обсяг визначається або нашим терпінням - максимальним часом аналізу, який ми можемо терпіти, або нашою нездатністю виявити розчинені речовини, оскільки існує занадто велике розширення смуги.
Асиметричні піки
Наше лікування хроматографії в цьому розділі передбачає, що розчинена речовина елюює як симетричний гауссовий пік, такий, як показано на малюнку Template:index. Ця ідеальна поведінка виникає, коли коефіцієнт поділу розчиненої речовини, K D
\[K_{\mathrm{D}}=\frac{[S_\text{s}]}{\left[S_\text{m}\right]} \nonumber\]
однаковий для всіх концентрацій розчиненої речовини. Якщо це не так, то хроматографічний пік має асиметричну форму піку, подібну до тих, які наведені на малюнку Template:index. Хроматографічний пік на малюнку Template:index a є прикладом пікового хвоста, який виникає, коли деякі ділянки на стаціонарній фазі утримують розчинену речовина сильніше, ніж інші сайти. Рисунок Template:index b, який є прикладом пікового фронтування найчастіше є результатом перевантаження стовпця зразком.
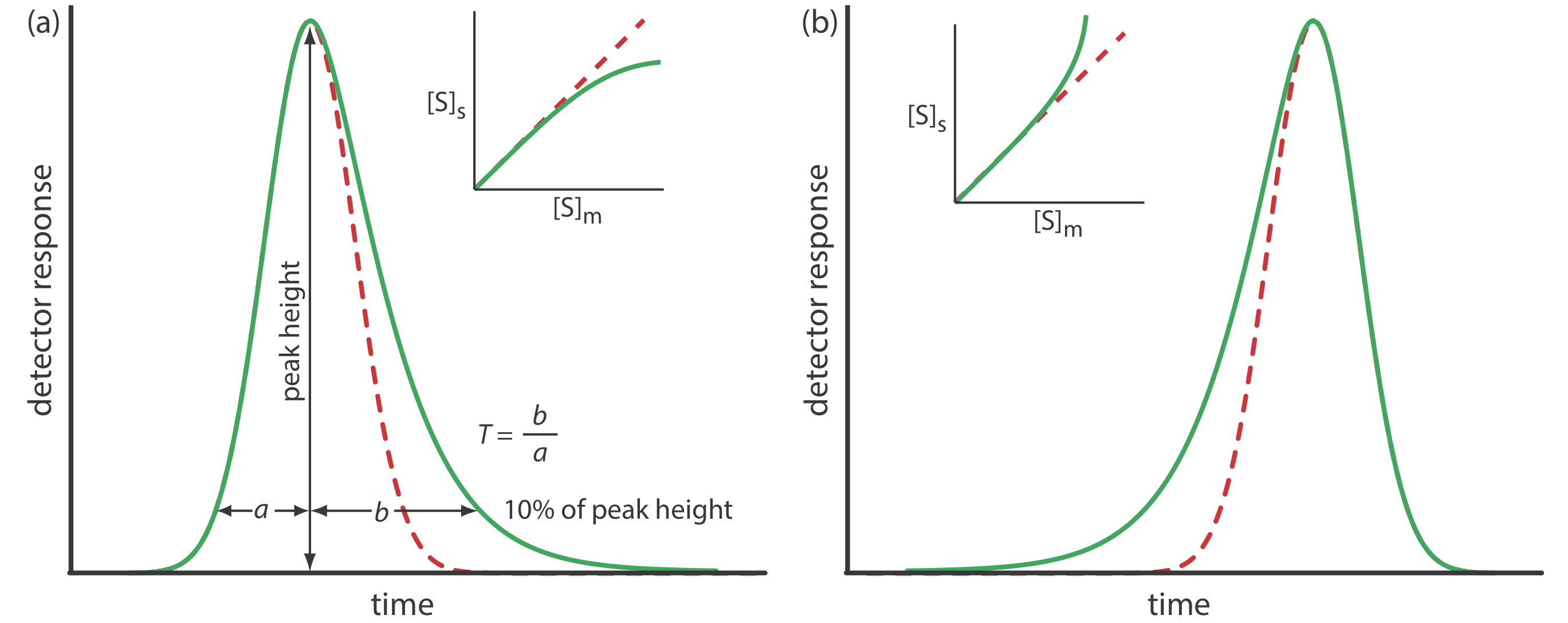
Як показано на малюнку Template:index a, ми можемо повідомити про асиметрію піку, намалювавши горизонтальну лінію на 10% від максимальної висоти піку та виміряючи відстань від кожного боку піку до лінії, проведеної вертикально через максимум піку. Фактор асиметрії, Т, визначається як
\[T=\frac{b}{a} \nonumber\]
Кількість теоретичних пластин для асиметричної форми піку приблизно
\[N \approx \frac{41.7 \times \frac{t_{r}^{2}}{\left(w_{0.1}\right)^{2}}}{T+1.25}=\frac{41.7 \times \frac{t_{r}^{2}}{(a+b)^{2}}}{T+1.25} \nonumber\]
де w 0.1 - ширина на 10% висоти піку [Фолі, Дж. П.; Дорсі, Дж. анал. Хім. 1983, 55, 730—737].
Асиметричні піки мають менше теоретичних пластин, і чим асиметричніше пік, тим менше кількість теоретичних пластин. Наприклад, наступна таблиця дає значення N для елюювання розчиненої речовини з часом утримання 10,0 хв і піковою шириною 1,00 хв.
| б | a | Т | N |
|---|---|---|---|
|
0,5 |
0,5 |
1.00 | 1850 |
|
0.6 |
0.4 |
1,50 | 1520 |
|
0.7 |
0.3 |
2.33 | 1160 |
| 0.8 | 0.2 | 4.00 | 790 |