11.2: Потенціометричні методи
- Page ID
- 24958
У потенціометрії вимірюється потенціал електрохімічного елемента в статичних умовах. Оскільки через електрохімічну комірку не протікає струм - або лише незначний струм, його склад залишається незмінним. З цієї причини потенціометрія є корисним кількісним методом аналізу. Перші кількісні потенціометричні додатки з'явилися незабаром після формулювання, в 1889 році, рівняння Нернста, яке пов'язує потенціал електрохімічної клітини з концентрацією електроактивних видів у клітині [Лелека, J.T. Anal. Хім. 1993, 65, 344—351А].
Для он-лайн вступу до більшої частини матеріалу в цьому розділі див Аналітична електрохімія: потенціометрія Ерін Гросс, Річард Келлі та Дональд М. Кеннон молодший, ресурс, який є частиною цифрової бібліотеки аналітичних наук.
Потенціометрія спочатку була обмежена окислювально-відновними рівновагами на металевих електродах, що обмежувало її застосування кількома іонами. У 1906 році Кремер виявив, що різниця потенціалів на тонкій скляній мембрані є функцією рН, коли протилежні сторони мембрани контактують з розчинами, які мають різну концентрацію H 3 O +. Це відкриття призвело до розробки скляного pH-електрода в 1909 році. Інші типи мембран також дають корисні потенціали. Наприклад, в 1937 році Колтофф і Сандерс показали, що гранулу AgCl можна використовувати для визначення концентрації Ag +. Електроди на основі мембранних потенціалів називаються іоноселективними електродами, а їх подальший розвиток поширює потенціометрію на різноманітний масив аналітів.
Потенціометричні вимірювання
Як показано на малюнку 11.1.3, ми використовуємо потенціометр для визначення різниці потенціалу двох електродів. Потенціал одного електрода - робочого або індикаторного електрода - реагує на активність аналіта, а інший електрод - лічильник або еталонний електрод - має відомий, фіксований потенціал. У цьому розділі ми введемо умовні позначення для опису потенціометричних електрохімічних клітин, а також взаємозв'язок між виміряним потенціалом і активністю аналіта.
У розділі 6 ми зазначили, що положення рівноваги хімічної реакції є функцією діяльності реагентів і продуктів, а не їх концентрацій. Щоб бути правильним, ми повинні написати рівняння Нернста з точки зору діяльності. Так чому ж ми не використовували діяльність у розділі 9, коли ми обчислювали криві окислювально-відновного титрування? Є дві причини такого вибору. По-перше, концентрації завжди легше підрахувати, ніж діяльність. По-друге, при окислювально-відновному титруванні ми визначаємо концентрацію аналіта з кінцевої точки титрування, а не з потенціалу в кінцевій точці. Єдині причини розрахунку кривої титрування - оцінити її доцільність і допомогти нам вибрати корисний показник. У більшості випадків помилка, яку ми вводимо, припускаючи, що концентрація та активність ідентичні, занадто мала, щоб викликати значне занепокоєння.
У потенціометрії ми не можемо ігнорувати різницю між активністю та концентрацією. Пізніше в цьому розділі ми розглянемо, як ми можемо розробити потенціометричний метод, щоб ми могли ігнорувати різницю між активністю та концентрацією. Див. Розділ 6.9, щоб переглянути наше попереднє обговорення активності та концентрації.
Потенціометричні електрохімічні клітини
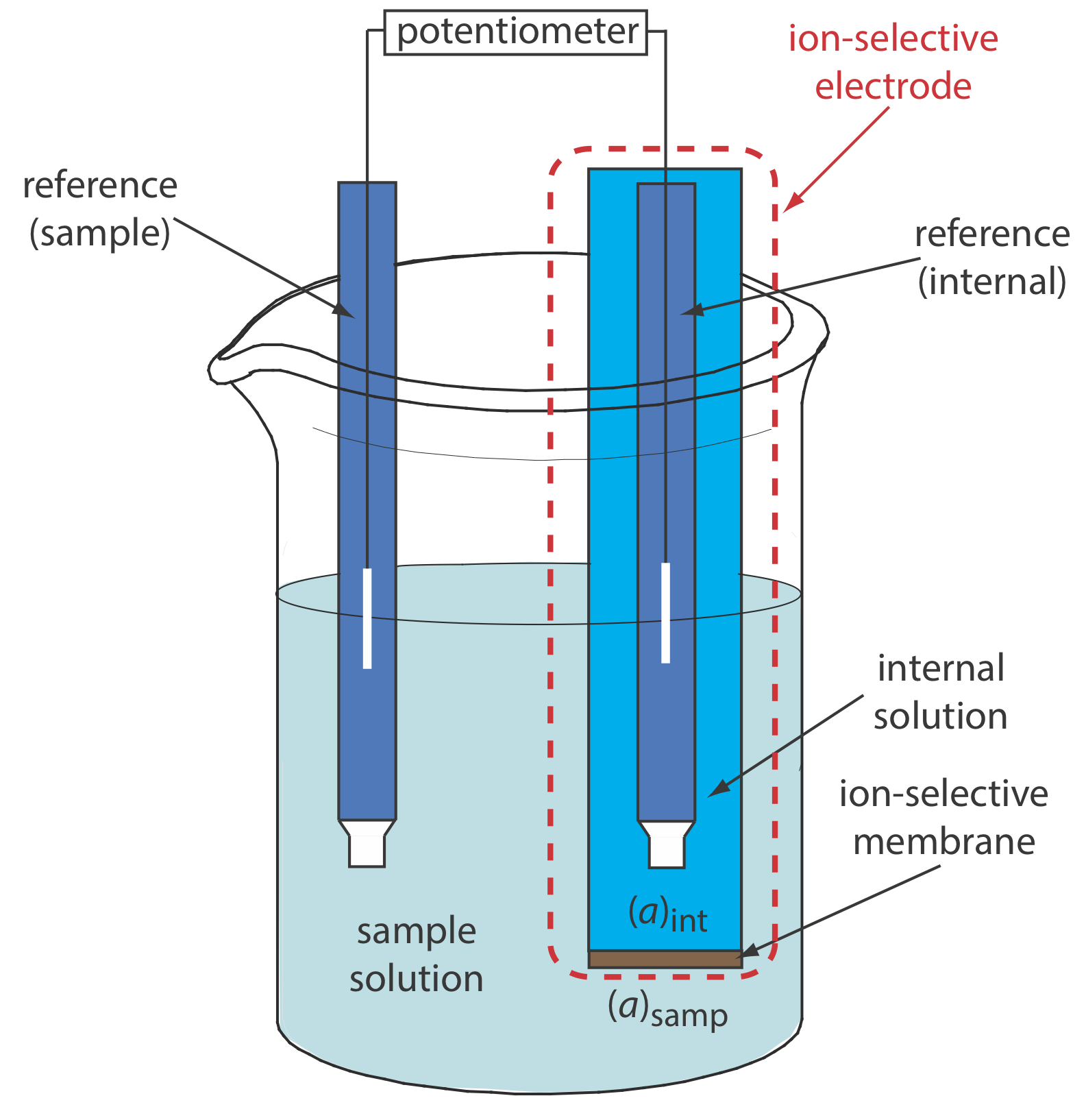
Принципова схема типової потенціометричної електрохімічної комірки показана на малюнку Template:index. Електрохімічна комірка складається з двох напівосередків, кожна з яких містить електрод, занурений в розчин іонів, діяльність яких визначає потенціал електрода. Сольовий міст, який містить інертний електроліт, такий як KCl, з'єднує дві напівклітини. Кінці соляного містка закріплені пористими фритами, які дозволяють іонам електроліту вільно переміщатися між напівосередками і соляним містком. Цей рух іонів в соляному мосту завершує електричний ланцюг.
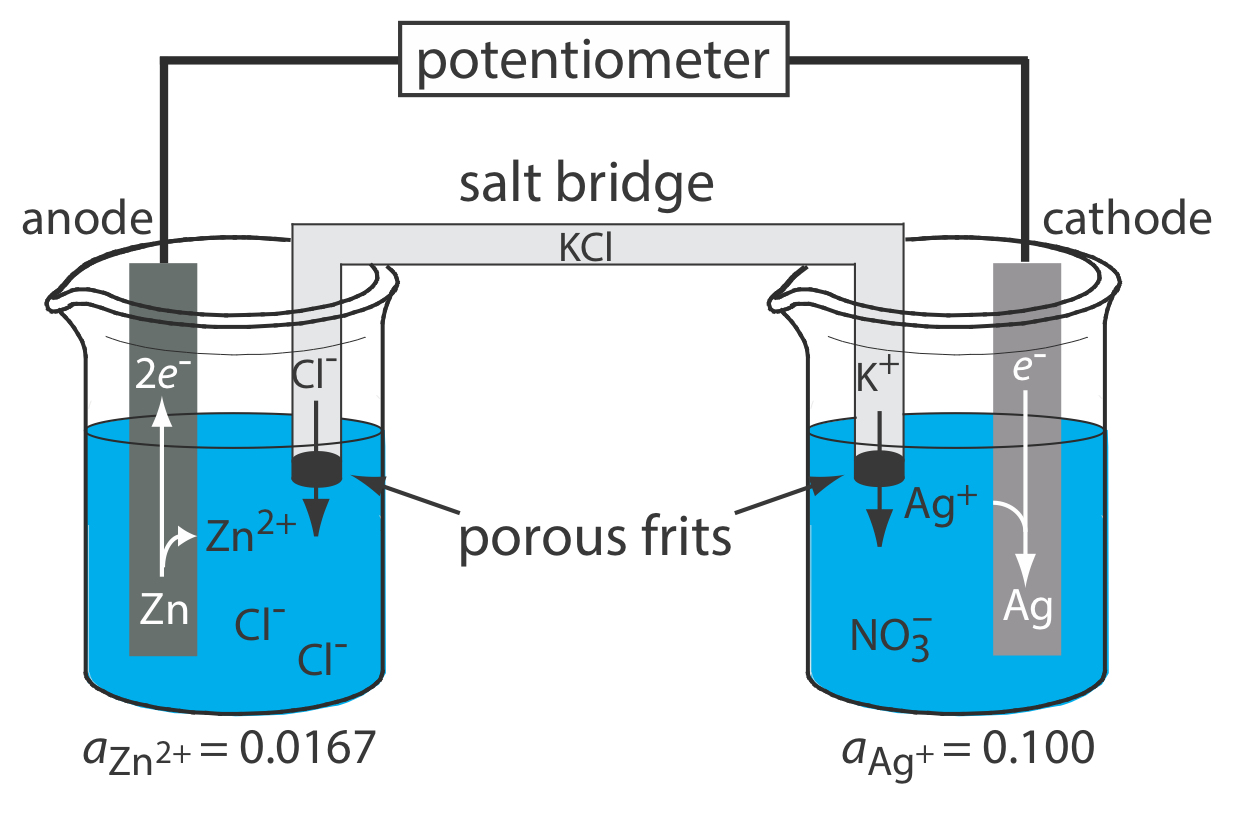
За умовністю ідентифікуємо електрод зліва як анод і привласнюємо йому реакцію окислення; таким чином
\[\mathrm{Zn}(s) \rightleftharpoons \text{ Zn}^{2+}(a q)+2 e^{-} \nonumber\]
Електрод праворуч є катодом, де відбувається реакція відновлення.
\[\mathrm{Ag}^{+}(a q)+e^{-} \rightleftharpoons \mathrm{Ag}(s) \nonumber\]
Потенціал електрохімічної комірки на малюнку Template:index для реакції
\[\mathrm{Zn}(s)+2 \mathrm{Ag}^{+}(a q) \rightleftharpoons 2 \mathrm{Ag}(s)+\mathrm{Zn}^{2+}(\mathrm{aq}) \nonumber\]
Ми також визначаємо потенціометричні електрохімічні елементи, такі, що катод є індикаторним електродом, а анод - опорним електродом.
Причина поділу електродів полягає в запобіганні реакції окислення і реакції відновлення на одному з електродів. Наприклад, якщо помістити смужку металу Zn в розчин AgNO 3, відновлення Ag + до Ag відбувається на поверхні Zn одночасно з тим, як зілля металу Zn окислюється до Zn 2 +. Оскільки перенесення електронів від Zn до Ag + відбувається на поверхні електрода, ми не можемо пропустити їх через потенціометр.
Стенографічне позначення для електрохімічних клітин
Хоча Figure Template:index надає корисну картину електрохімічної комірки, це не зручний спосіб її представляти (Уявіть, що потрібно намалювати зображення кожної електрохімічної клітинки, яку ви використовуєте!). Більш корисним способом опису електрохімічної клітини є стенографічне позначення, яке використовує символи для ідентифікації різних фаз і перераховує склад кожної фази. Ми використовуємо вертикальну косу риску (|), щоб визначити межу між двома фазами, де розвивається потенціал, і комою (,) для відокремлення видів у тій самій фазі або для виявлення кордону між двома фазами, де потенціал не розвивається. Стенографічні позначення осередків починаються з анода і продовжуються до катода. Наприклад, ми описуємо електрохімічну комірку на рисунку Template:index за допомогою наступних скорочених позначень.
\[\text{Zn}(s) | \text{ZnCl}_2(aq, a_{\text{Zn}^{2+}} = 0.0167) || \text{AgNO}_3(aq, a_{\text{Ag}^+} = 0.100) | \text{Ag} (s) \nonumber\]
Подвійний вертикальний слеш (||) являє собою соляний міст, вміст якого ми зазвичай не перераховуємо. Зверніть увагу, що подвійний вертикальний слеш означає, що існує різниця потенціалів між соляним містком і кожною половиною осередку.
Які анодні, катодні та загальні реакції відповідають за потенціал електрохімічної клітини на малюнку Template:index? Напишіть стенографічні позначення для електрохімічної осередку.
Рішення
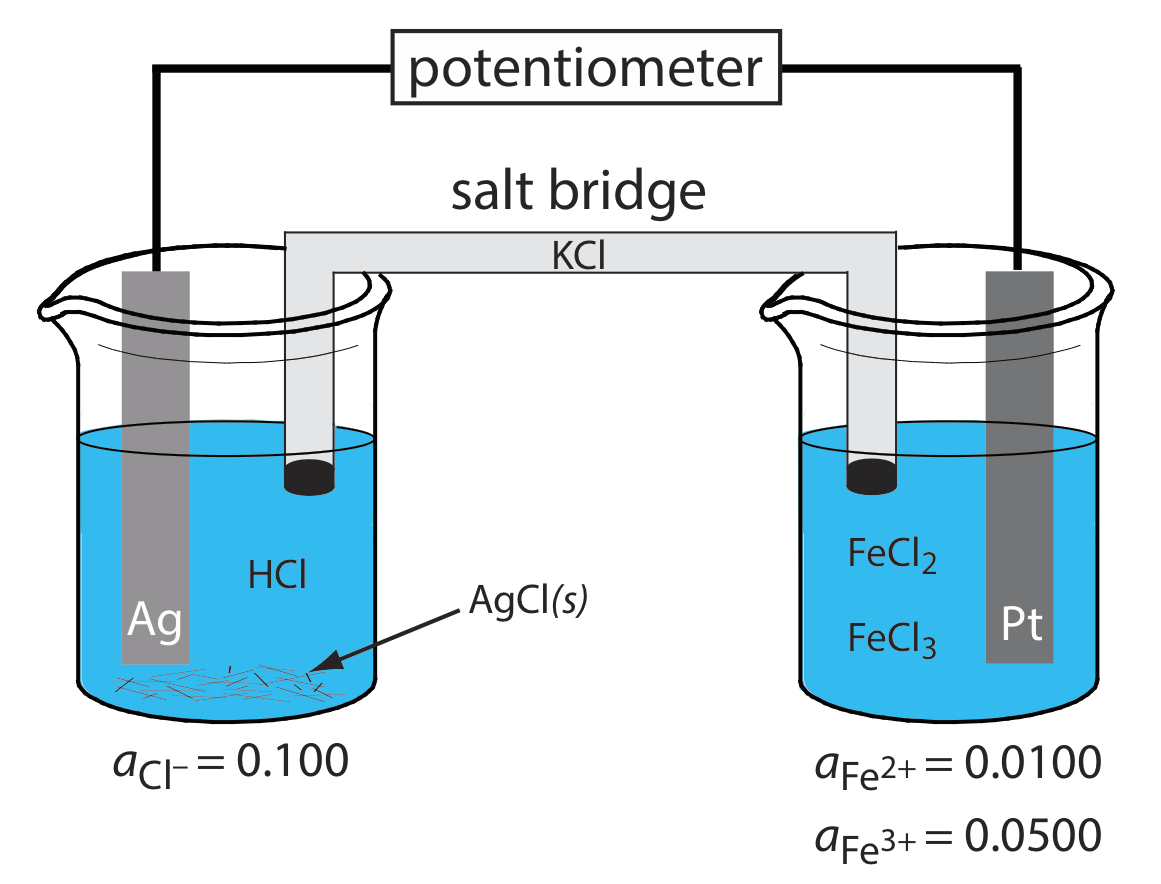
Окислення Ag до Ag + відбувається на аноді, який є лівою половиною клітини. Оскільки розчин містить джерело Cl —, анодна реакція
\[\mathrm{Ag}(s)+\mathrm{Cl}^{-}(aq) \rightleftharpoons\text{ AgCl}(s)+e^{-} \nonumber\]
Катодною реакцією, яка є правою половиною клітини, є зниження Fe 3 + до Fe 2 +.
\[\mathrm{Fe}^{3+}(a q)+e^{-}\rightleftharpoons \text{ Fe}^{2+}(a q) \nonumber\]
Загальна реакція клітин, таким чином,
\[\mathrm{Ag}(s)+\text{ Fe}^{3+}(a q)+\text{ Cl}^{-}(a q) \rightleftharpoons \mathrm{AgCl}(s)+\text{ Fe}^{2+}(a q) \nonumber\]
Стенографічне позначення електрохімічної клітини є
\[\text{Ag}(s) | \text{HCl} (aq, a_{\text{Cl}^{-}} = 0.100), \text{AgCl} (\text{sat’d}) || \text{FeCl}_2(aq, a_{\text{Fe}^{2+}} = 0.0100), \text{ Fe}^{3+}(aq,a_{\text{Fe}^{3+}} = 0.0500) | \text{Pt} (s) \nonumber\]
Зверніть увагу, що катод Pt - це інертний електрод, який переносить електрони до відновної напівреакції. Сам електрод не піддається відновленню.
Запишіть реакції, що відбуваються на аноді і катоді для потенціометричної електрохімічної комірки, наступними скороченими позначеннями.
Пт (и) | Н 2 (г), Н + (ак) || Cu 2 + (aq) | Cu (s)
- Відповідь
-
Окислення Н 2 до Н + відбувається на аноді
\[\mathrm{H}_{2}(g)\rightleftharpoons2 \mathrm{H}^{+}(a q)+2 e^{-} \nonumber\]
а зниження Cu 2 + до Cu відбувається на катоді.
\[\mathrm{Cu}^{2+}(a q)+2 e^{-}\rightleftharpoons\mathrm{Cu}(s) \nonumber\]
Загальна реакція клітин, таким чином,
\[\mathrm{Cu}^{2+}(a q)+\text{ H}_{2}(g)\rightleftharpoons2 \mathrm{H}^{+}(a q)+\mathrm{Cu}(s) \nonumber\]
Потенціал і діяльність—Рівняння Нернста
Потенціал потенціометричної електрохімічної клітини дорівнює
\[E_{\text {cell }}=E_{\text {cathode }}-E_{\text {anode }} \label{11.1}\]
де Е катод і Е анод є відновними потенціалами для окисно-відновних реакцій на катоді і аноді відповідно. Кожен потенціал відновлення задається рівнянням Нернста.
\[E=E^{\circ}-\frac{R T}{n F} \ln Q \nonumber\]
де E o - потенціал відновлення стандартного стану, R - газова константа, T - температура в кельвінів, n - кількість електронів в окисно-відновній реакції, F - константа Фарадея, а Q - коефіцієнт реакції. При температурі 298 К (25 о С) рівняння Нернста дорівнює
\[E=E^{\circ}-\frac{0.05916}{n} \log Q \label{11.2}\]
де Е - в вольтах.
Використовуючи рівняння\ ref {11.2}, потенціал анода та катода на малюнку Template:index
\[E_\text{anode} = E_{\text{Zn}^{2+}/\text{Zn}}^{\circ} - \frac {0.05916} {2} \log \frac{1} {a_{\text{Zn}^{2+}}} \nonumber\]
\[E_\text{anode} = E_{\text{Ag}^{+}/\text{Ag}}^{\circ} - \frac {0.05916} {1} \log \frac{1} {a_{\text{Ag}^{+}}} \nonumber\]
Незважаючи на те, що реакція окислення відбувається на аноді, ми визначаємо потенціал анода з точки зору відповідної реакції відновлення та потенціалу відновлення стандартного стану. Див. Розділ 6.4 для огляду використання рівняння Нернста в розрахунках.
Підставляючи катод Е і анод Е в рівняння\ ref {11.1}, поряд з активністю Zn 2 + і Ag + і відновних потенціалів стандартного стану, дає E комірку як
\[E_\text{cell} = \left( E_{\text{Ag}^{+}/\text{Ag}}^{\circ} - \frac {0.05916} {1} \log \frac{1} {a_{\text{Ag}^{+}}} \right) - \left( E_{\text{Zn}^{2+}/\text{Zn}}^{\circ} - \frac {0.05916} {2} \log \frac{1} {a_{\text{Zn}^{2+}}} \right) \nonumber\]
\[E_\text{cell} = \left( 0.7996 - \frac {0.05916} {1} \log \frac{1} {0.100} \right) - \left( -0.7618 - \frac {0.05916} {2} \log \frac{1} {0.0167} \right) = 1.555 \text{ V} \nonumber\]
Значення потенціалів відновлення стандартного стану ви знайдете в Додатку 13.
Який потенціал електрохімічної клітини показано в прикладі Template:index?
Рішення
Підставляючи катод Е і анод Е в рівняння\ ref {11.1}, разом з концентраціями Fe 3 +, Fe 2+ і Cl — і відновних потенціалів стандартного стану дає
\[E_\text{cell} = \left( E_{\text{Fe}^{3+}/\text{Fe}^{2+}}^{\circ} - \frac {0.05916} {1} \log \frac{a_{\text{Fe}^{2+}}} {a_{\text{Fe}^{3+}}} \right) - \left( E_{\text{AgCl/Ag}}^{\circ} - \frac {0.05916} {1} \log a_{\text{Cl}^-} \right) \nonumber\]
\[E_\text{cell} = \left( 0.771 - \frac {0.05916} {1} \log \frac{0.0100} {0.0500} \right) - \left( 0.2223 - \frac {0.05916} {1} \log (0.100) \right) = 0.531 \text{ V} \nonumber\]
Який потенціал для електрохімічної клітини у вправі Template:index, якщо активність H + в анодній напівклітині дорівнює 0,100, фугатність Н 2 в анодній напівклітині становить 0,500, а активність Cu 2 + в катодній половині- осередок дорівнює 0.0500? Fugacity\(f\),, є еквівалентним терміном для діяльності газу.
- Відповідь
-
Внесення відповідних замін в Equation\ ref {11.1} і розв'язування для E комірки дає його значення як
\[E_\text{cell} = \left( E_{\text{Cu}^{2+}/\text{Cu}}^{\circ} - \frac {0.05916} {2} \log \frac{1} {a_{\text{Cu}^{2+}}} \right) - \left( E_{\text{H}^{+}/\text{H}_2}^{\circ} - \frac {0.05916} {2} \log \frac{f_{\text{H}_2}} {a_{\text{H}^+}^2} \right) \nonumber\]
\[E_\text{cell} = \left( 0.3419 - \frac {0.05916} {2} \log \frac{1} {0.0500} \right) - \left( 0.0000 - \frac {0.05916} {2} \log \frac{0.500} {(0.100)^2} \right) = 0.3537 \text{ V} \nonumber\]
У потенціометрії привласнюємо опорний електрод анодної напівкомірці і призначаємо індикаторний електрод на катодну напівкомірку. Таким чином, якщо потенціал комірки на малюнку Template:index дорівнює +1,50 V, а активність Zn 2 + дорівнює 0,0167, то ми можемо вирішити наступне рівняння для Ag +
\[1.50 \text{ V} = \left( 0.7996 - \frac {0.05916} {1} \log \frac{1} {a_{\text{Ag}^+}} \right) - \left( -0.7618 - \frac {0.05916} {2} \log \frac{1} {0.0167} \right) \nonumber\]
отримання діяльності 0,0118.
Яка активність Fe 3 + в електрохімічній клітині аналогічна тій, яка в прикладі Template:index, якщо активність Cl — в лівій клітині становить 1,0, активність Fe 2 + в правій клітині становить 0,015, а E осередок +0,546 В?
Рішення
Внесення відповідних замін у рівняння\ ref {11.1}
\[0.546 = \left( 0.771 - \frac {0.05916} {1} \log \frac{0.0100} {a_{\text{Fe}^{3+}}} \right) - \left( 0.2223 - \frac {0.05916} {1} \log (1.0) \right) \nonumber\]
і рішення для Fe 3 + дає його активність як 0.0135.
Яка активність Cu 2 + в електрохімічній клітині у вправі Template:index, якщо активність H + в анодній напівклітині становить 1,00 з нечіткістю 1,00 для H 2, а E клітини +0,257 В?
- Відповідь
-
Внесення відповідних замін у рівняння\ ref {11.1}
\[0.257 \text{ V} = \left( 0.3419 - \frac {0.05916} {2} \log \frac{1} {a_{\text{Cu}^{2+}}} \right) - \left( 0.0000 - \frac {0.05916} {2} \log \frac{1.00} {(1.00)^2} \right) \nonumber\]
і рішення для Cu 2 + дає свою активність як\(1.35 \times 10^{-3}\).
Незважаючи на очевидну легкість визначення активності аналіта за допомогою рівняння Нернста, існує кілька проблем з таким підходом. Одна з проблем полягає в тому, що потенціали стандартного стану залежать від температури і значення в довідкових таблицях зазвичай призначені для температури 25 о С. Ми можемо подолати цю проблему, підтримуючи електрохімічну комірку при 25 o С або вимірюючи потенціал стандартного стану при бажаному температура.
Інша проблема полягає в тому, що потенціал скорочення стандартного стану може мати значний матричний ефект. Наприклад, потенціал відновлення стандартного стану для окислювально-відновно-відновної пари Fe 3 + /Fe 2+ становить +0,735 В в 1 М HClO 4, +0,70 В в 1 М HCl і +0,53 В в 10 М HCl. Різниця потенціалів для еквимолярних розчинів HCl і HClO 4 є результатом різниці коефіцієнтів активності для Fe 3 + і Fe 2 + в цих двох середовищах. Зсув в бік більш негативного потенціалу при збільшенні концентрації HCl є результатом здатності хлориду утворювати більш сильний комплекс з Fe 3 +, ніж при Fe 2 +. Ми можемо мінімізувати цю задачу, замінивши потенціал стандартного стану на матрично-залежний формальний потенціал. Більшість таблиць потенціалів стандартного стану, включаючи ті, які наведені в додатку 13, включають вибрані формальні потенціали.
Нарешті, більш серйозною проблемою є наявність додаткових потенціалів в електрохімічній комірці, не включеній в Equation\ ref {11.1}. При написанні скороченого позначення для електрохімічної комірки ми використовуємо подвійну косу риску (||) для позначення соляного моста, припускаючи, що потенціал існує на межі розділу між кожним кінцем соляного моста і розчином, в який він занурений. Походження цього потенціалу розглядається в наступному розділі.
Потенціали переходу
Потенціал переходу розвивається на межі розділу між двома іонними розчинами, якщо є різниця в концентрації та рухливості іонів. Розглянемо, наприклад, пористу мембрану, яка відокремлює розчин 0,1 М HCl від розчину 0,01 М HCl (рис. Template:index a). Оскільки концентрація HCl на лівій стороні мембрани більша, ніж на правій стороні мембрани, H + і Cl - розсіюються у напрямку стрілок. Рухливість H +, однак, більша, ніж для Cl -, про що свідчить різниця в довжині відповідних стрілок. Через цю різницю в рухливості розчин з правого боку мембрани розвиває надлишкову концентрацію Н + і позитивний заряд (рис. Template:index b). Одночасно розчин на лівій стороні мембрани розвиває негативний заряд, оскільки спостерігається надлишкова концентрація Cl —. Ми називаємо цю різницю потенціалів через мембрану потенціалом переходу і представляємо її як E j.
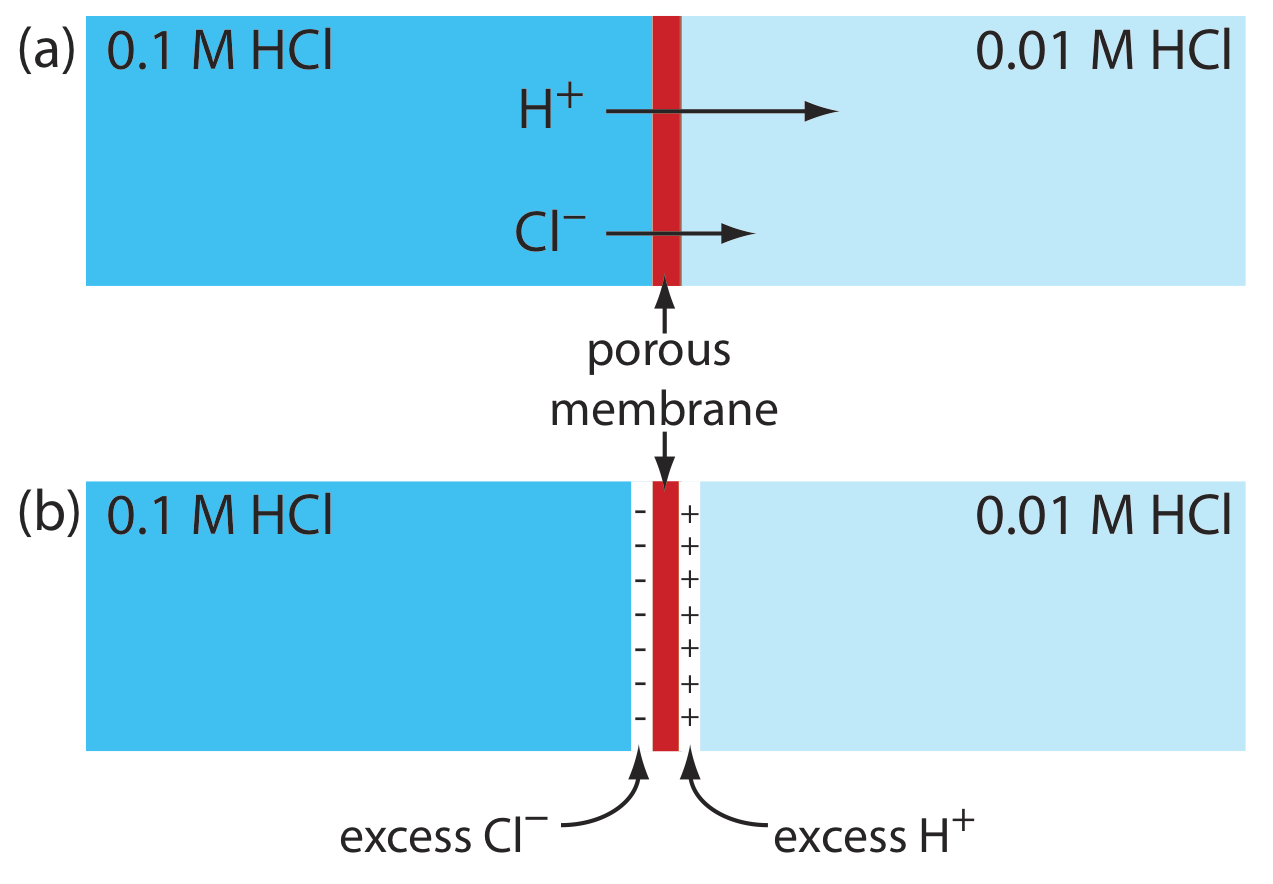
Величина потенціалу переходу залежить від різниці концентрації іонів на двох сторонях розділу і може становити до 30-40 мВ. Наприклад, на межі розділу між розв'язками 0,1 М HCl та 0,1 М NaCl [Sawyer, D.T.; Roberts, J.L., Jr. Експериментальна електрохімія для хіміків, Wiley-Interscience: Нью-Йорк, 1974, стор. 22]. Потенціал з'єднання соляного моста мінімізується за допомогою солі, такої як KCl, для якої рухливість катіону та аніону приблизно рівні. Ми також можемо мінімізувати потенціал з'єднання, включивши високу концентрацію солі в соляний міст. З цієї причини соляні мости часто будуються з використанням розчинів, насичених KCl. Тим не менш, невеликий потенціал переходу, як правило, невідомої величини, завжди присутній.
Коли ми вимірюємо потенціал електрохімічної комірки, потенціал переходу також сприяє E-клітині; таким чином, ми переписуємо рівняння\ ref {11.1} як
\[E_{\text {cell }}=E_{\text {cathode }}-E_{\text {anode }}+E_{j} \nonumber\]
включити свій внесок. Якщо ми не знаємо фактичного значення потенціалу переходу - що є звичайною ситуацією, то ми не можемо безпосередньо обчислити концентрацію аналіта за допомогою рівняння Нернста. Кількісна аналітична робота можлива, однак, якщо ми використовуємо один із методів стандартизації - зовнішні стандарти, метод стандартних доповнень або внутрішні стандарти - розглянуті в розділі 5.3.
Еталонні електроди
У потенціометричній електрохімічній клітині одна з двох напівклітин забезпечує фіксований опорний потенціал, а потенціал іншої напівклітини відповідає концентрації аналіта. За умовністю опорний електрод є анодом; таким чином, коротке позначення руки для потенціометричної електрохімічної комірки є
опорний електрод || індикатор електрода
і потенціал клітини є
\[E_{\mathrm{cell}}=E_{\mathrm{ind}}-E_{\mathrm{ref}}+E_{j} \nonumber\]
Ідеальний опорний електрод забезпечує стабільний, відомий потенціал, так що ми можемо віднести будь-яку зміну E комірки до впливу аналіта на потенціал електрода індикатора. Крім того, його повинно бути легко виготовити і використовувати опорний електрод. У цьому розділі розглядаються три загальних еталонних електрода.
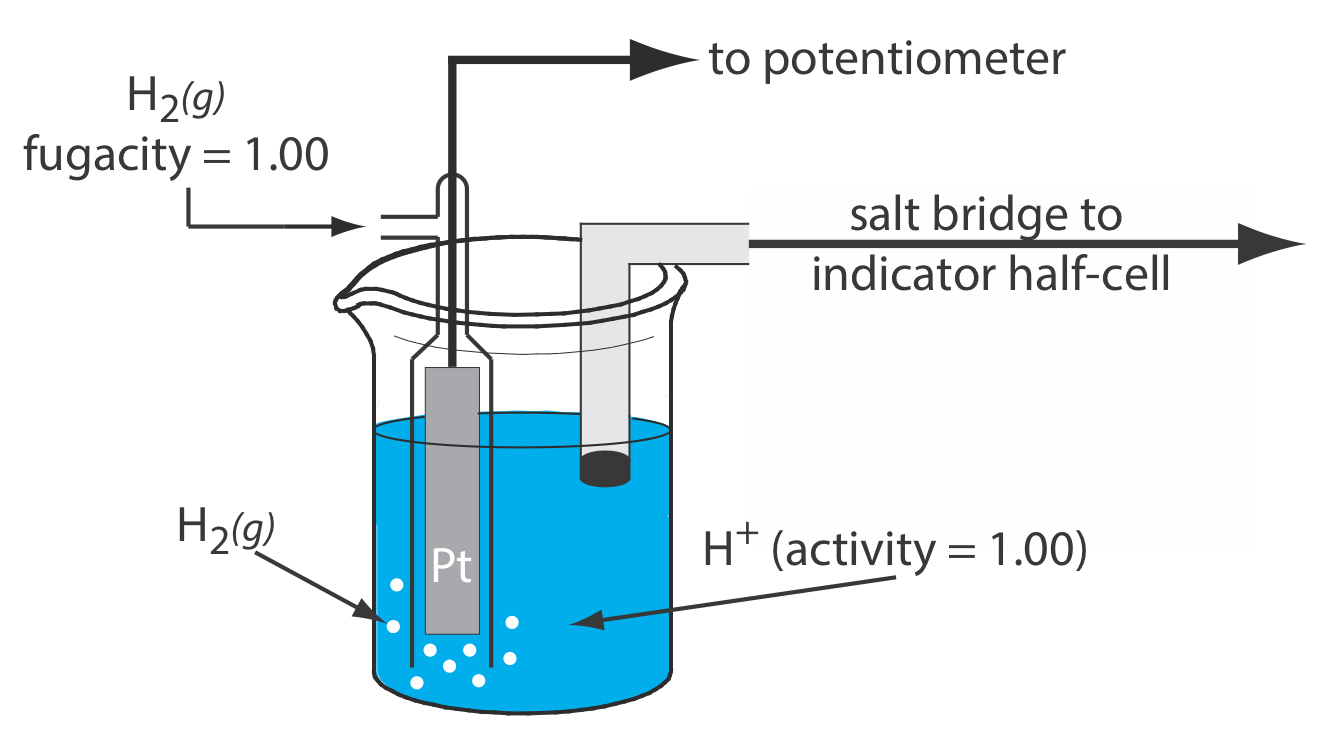
Стандартний водневий електрод
Хоча ми рідко використовуємо стандартний водневий електрод (SHE) для рутинної аналітичної роботи, це еталонний електрод, який використовується для встановлення потенціалів стандартного стану для інших напівреакцій. SHE складається з електрода Pt, зануреного в розчин, в якому активність іона водню становить 1,00 і в якому фугастість H 2 (g) дорівнює 1,00 (рис. Template:index). Звичайний соляний міст з'єднує SHE з індикатором напівосередку. Коротке позначення руки для стандартного водневого електрода
\[\text{Pt}(s), \text{ H}_{2}\left(g, f_{\mathrm{H}_{2}}=1.00\right) | \text{ H}^{+}\left(a q, a_{\mathrm{H}^{+}}=1.00\right) \| \nonumber\]
і стандартний державний потенціал для реакції
\[\mathrm{H}^{+}(a q)+e^{-}=\frac{1}{2} \mathrm{H}_{2}(g) \nonumber\]
становить, за визначенням, 0,00 В при всіх температурах. Незважаючи на свою важливість як основного опорного електрода, проти якого ми вимірюємо всі інші потенціали, SHE рідко використовується, оскільки його важко підготувати і незручно використовувати.
Каломелеві електроди
Еталонний електрод calomel заснований на наступній окислювально-відновній парі між Hg 2 Cl 2 і Hg (каломель - загальна назва Hg 2 Cl 2)
\[\mathrm{Hg}_{2} \mathrm{Cl}_{2}(s)+2 e^{-}\rightleftharpoons2 \mathrm{Hg}(l)+2 \mathrm{Cl}^{-}(a q) \nonumber\]
для яких потенціал є
\[E=E_{\mathrm{Hg}_{2} \mathrm{Cl}_{2} / \mathrm{Hg}}^{\mathrm{o}}-\frac{0.05916}{2} \log \left(a_{\text{Cl}^-}\right)^{2}=+0.2682 \mathrm{V}-\frac{0.05916}{2} \log \left(a_{\text{Cl}^-}\right)^{2} \nonumber\]
Потенціал каломельного електрода, таким чином, залежить від активності Cl — в рівновазі з Hg і Hg 2 Cl 2.
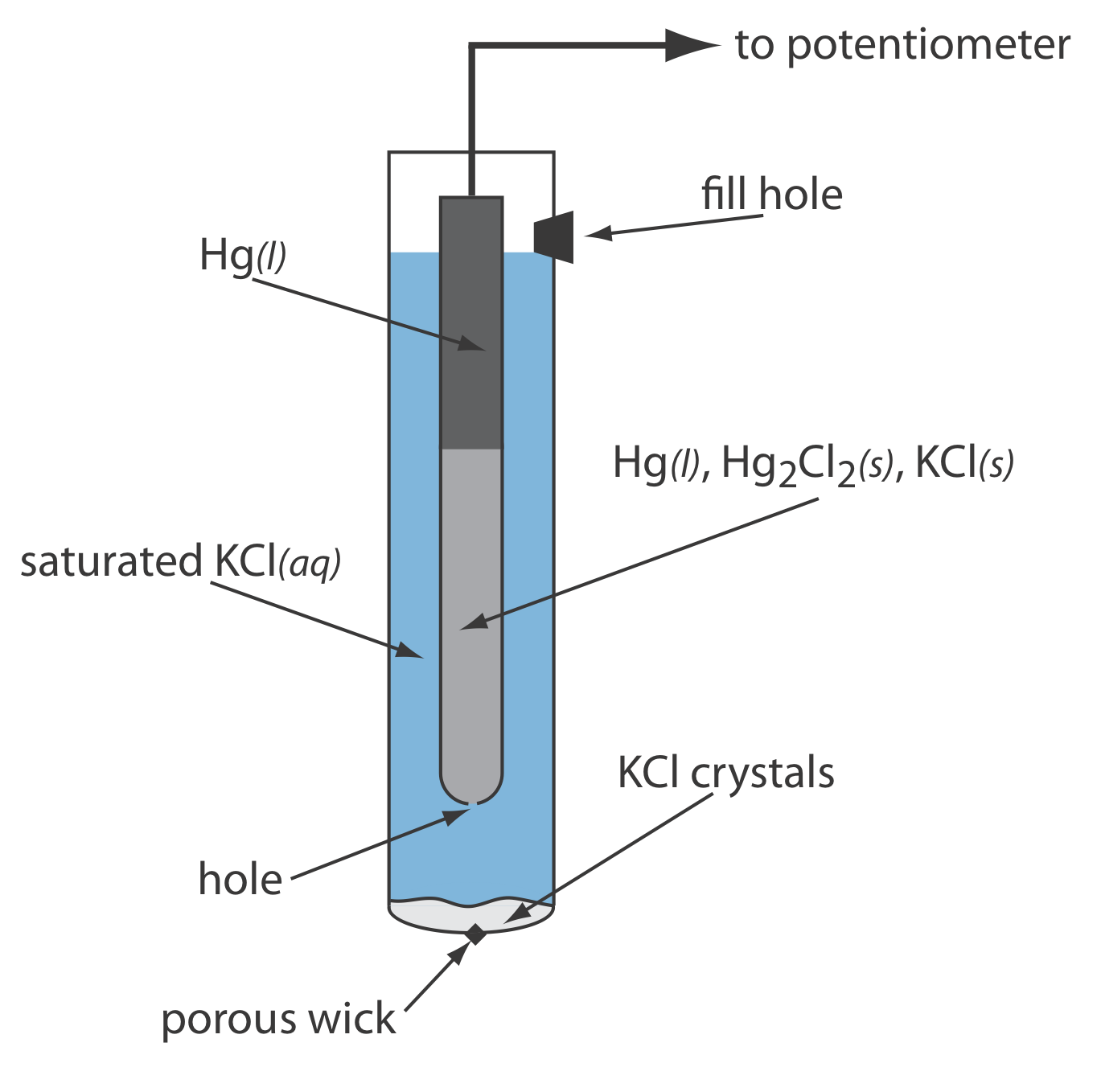
Як показано на малюнку Template:index, в насиченому каломелевому електроді (SCE) концентрація Cl — визначається розчинністю KCl. Електрод складається з внутрішньої трубки, упакованої пастою Hg, Hg 2 Cl 2 та KCl, розташованої всередині другої трубки, яка містить насичений розчин KCl. Невеликий отвір з'єднує дві трубки і пористий гніт служить соляним містком до розчину, в який занурений СКВ. Пробка в зовнішній трубці забезпечує отвір для додавання насиченого KCl. Коротке позначення руки для цієї клітинки
\[\mathrm{Hg}(l) | \mathrm{Hg}_{2} \mathrm{Cl}_{2}(s), \mathrm{KCl}(a q, \text { sat'd }) \| \nonumber\]
Оскільки концентрація Cl — фіксується розчинністю KCl, потенціал SCE залишається постійним, навіть якщо ми втрачаємо частину внутрішнього розчину до випаровування. Істотним недоліком СКВ є те, що розчинність KCl чутлива до зміни температури. При більш високих температурах розчинність KCl збільшується і потенціал електрода зменшується. Наприклад, потенціал СКВ становить +0,2444 В при 25 о С і +0,2376 В при 35 о С. Потенціал каломелевого електрода, який містить ненасичений розчин KCl, менш залежить від температури, але його потенціал змінюється, якщо концентрація, а значить і активність Cl. —, збільшується за рахунок випаровування.
Наприклад, потенціал каломельного електрода становить +0,280 В при концентрації KCl 1,00 М і +0,336 В при концентрації KCl 0,100 М. Якщо активність Cl — 1,00, потенціал становить +0,2682 В.
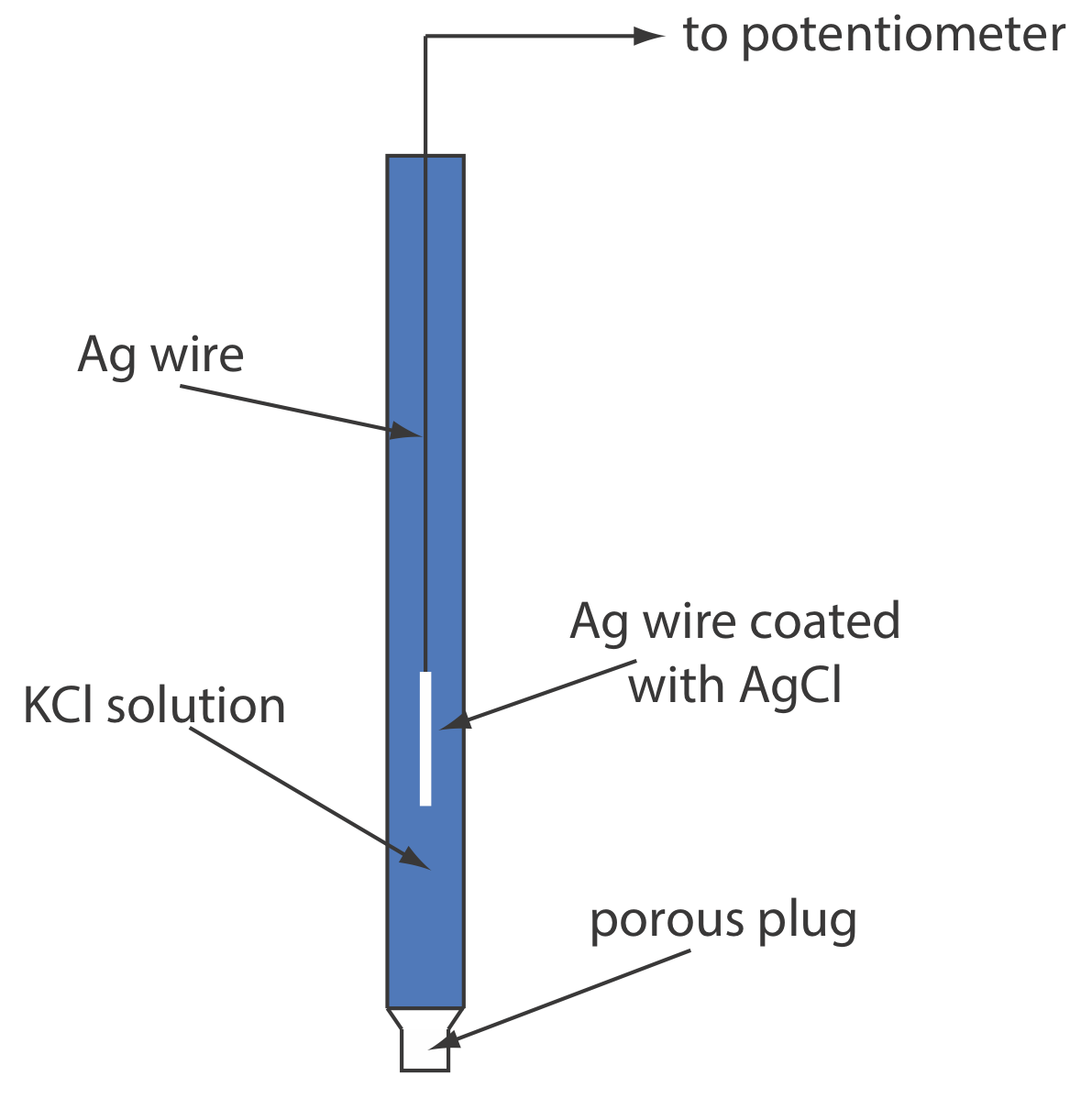
Срібло/хлорид срібла електроди
Іншим поширеним еталонним електродом є електрод срібло/хлорид срібла, який заснований на зниженні AgCl до Ag.
\[\operatorname{AgCl}(s)+e^{-} \rightleftharpoons \mathrm{Ag}(s)+\mathrm{Cl}^{-}(a q) \nonumber\]
Як і у випадку з каломелевим електродом, активність Cl — визначає потенціал електрода Ag/AgCl; таким чином
\[E = E_\text{AgCl/Ag}^{\circ}-0.05916 \log a_{\text{Cl}^-} = 0.2223 \text{ V} - 0.05916 \log a_{\text{Cl}^-} \nonumber\]
При приготуванні з використанням насиченого розчину KCl потенціал електрода становить +0,197 В при 25 о С. Інший поширений електрод Ag/AgCl використовує розчин 3,5 М KCl і має потенціал +0,205 В при 25 о С. Як і слід було очікувати, потенціал електрода Ag/AgCl з використанням насиченого розчину KCl більш чутливий до зміни температури, ніж електрод, який використовує ненасичений розчин KCl.
Типовий електрод Ag/AgCl показаний на малюнку Template:index і складається з срібного дроту, кінець якої покритий тонкою плівкою AgCl, зануреної в розчин, що містить потрібну концентрацію KCl. Пориста пробка служить соляним містком. Короткі позначення руки електрода
\[\operatorname{Ag}(s) | \operatorname{Ag} \mathrm{Cl}(s), \mathrm{KCl}\left(a q, a_{\mathrm{Cl}^{-}}=x\right) \| \nonumber\]
Перетворення потенціалів між опорними електродами
Стандартні потенціали відновлення стану в більшості таблиць повідомляються щодо потенціалу стандартного водневого електрода +0,00 В. Оскільки ми рідко використовуємо SHE як опорний електрод, нам потрібно перетворити потенціал індикаторного електрода в його еквівалентне значення при використанні іншого опорного електрода. Як показано в наступному прикладі, це зробити нескладно.
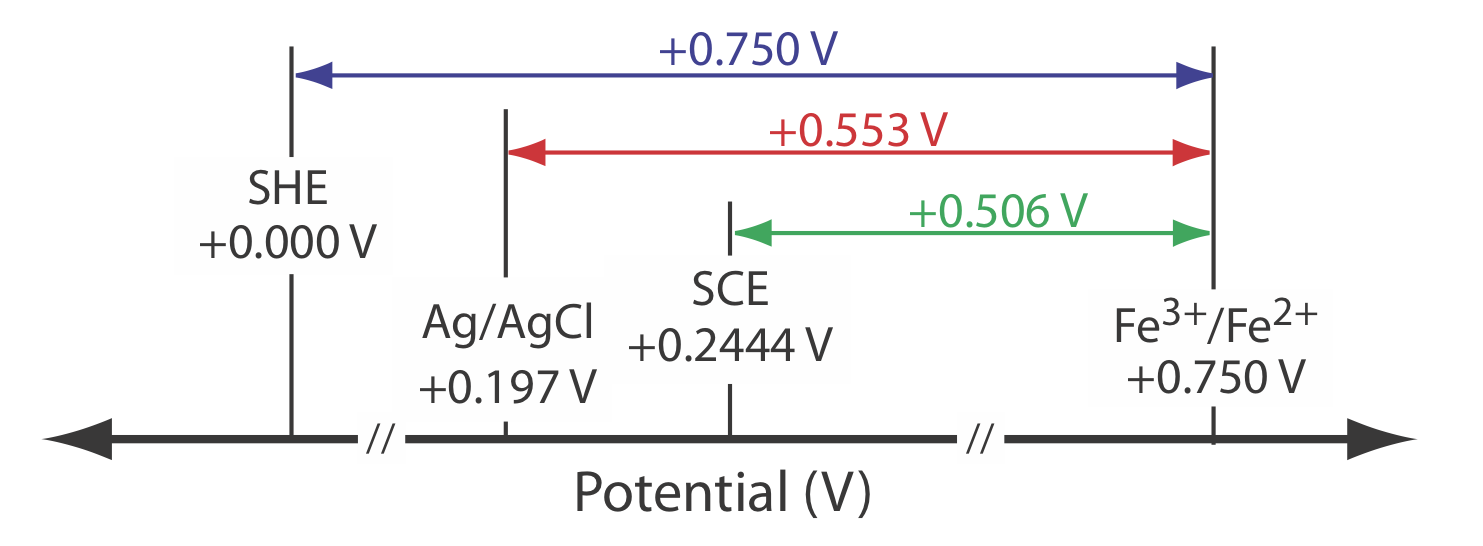
Потенціал для напівкомірки Fe 3 + +/Fe 2+ становить +0,750 В щодо стандартного водневого електрода. Який його потенціал, якщо ми використовуємо насичений каломельний електрод або насичений електрод срібло/хлорид срібла?
Рішення
Коли ми використовуємо стандартний водневий електрод, потенціал електрохімічної комірки дорівнює
\[E_\text{cell} = E_{\text{Fe}^{3+}/\text{Fe}^{2+}} - E_\text{SHE} = 0.750 \text{ V} -0.000 \text{ V} = 0.750 \text{ V} \nonumber\]
Ми можемо використовувати те саме рівняння для обчислення потенціалу, якщо використовувати насичений каломелевий електрод.
\[E_\text{cell} = E_{\text{Fe}^{3+}/\text{Fe}^{2+}} - E_\text{SHE} = 0.750 \text{ V} -0.2444 \text{ V} = 0.506 \text{ V} \nonumber\]
або насичений електрод срібло/хлорид срібла
\[E_\text{cell} = E_{\text{Fe}^{3+}/\text{Fe}^{2+}} - E_\text{SHE} = 0.750 \text{ V} -0.197 \text{ V} = 0.553 \text{ V} \nonumber\]
Figure Template:index надає наочне уявлення про зв'язок між цими різними потенціалами.
Потенціал напівкомірки\(\text{UO}_2^+\) /U 4+ становить —0,0190 В щодо насиченого каломелевого електрода. Який його потенціал при використанні насиченого електрода срібло/хлориду срібла або стандартного водневого електрода?
- Відповідь
-
При використанні насиченого каломелевого електрода потенціал електро-хімічної осередку дорівнює
\[E_\text{cell} = E_{\text{UO}_2^+/\text{U}^{4+}} - E_\text{SCE} \nonumber\]
Підстановка в відомих значеннях
\[-0.0190 \text{ V} = E_{\text{UO}_2^+/\text{U}^{4+}} - 0.2444 \text{ V} \nonumber\]
і рішення для\(E_{\text{UO}_2^+/\text{U}^{4+}}\) дає його значення як +0,2254 В. Потенціал щодо електрода Ag/AgCl дорівнює
\[E_\text{cell} = E_{\text{UO}_2^+/\text{U}^{4+}} - E_\text{Ag/AgCl} = 0.2254 \text{ V} - 0.197 \text{ V} = 0.028 \text{ V} \nonumber\]
а потенціал щодо стандартного водневого електрода дорівнює
\[E_\text{cell} = E_{\text{UO}_2^+/\text{U}^{4+}} - E_\text{SHE} = 0.2254 \text{ V} - 0.000 \text{ V} = 0.2254 \text{ V} \nonumber\]
Металеві електроди індикатора
У потенціометрії потенціал електрода-індикатора пропорційний активності аналіта. Для проведення потенціометричних вимірювань використовуються два класи індикаторних електродів: металеві електроди, які є предметом даного розділу, і іоноселективні електроди, які розглянуті в наступному розділі.
Електроди першого роду
Якщо помістити мідний електрод в розчин, який містить Cu 2 +, потенціал електрода обумовлений реакцією
\[\mathrm{Cu}^{2+}(a q)+2 e^{-} \rightleftharpoons \mathrm{Cu}(s) \nonumber\]
визначається активністю Cu 2 +.
\[E=E_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^{\mathrm{o}}-\frac{0.05916}{2} \log \frac{1}{a_{\mathrm{Cu}^{2+}}}=+0.3419 \mathrm{V}-\frac{0.05916}{2} \log \frac{1}{a_{\mathrm{Cu}^{2+}}} \nonumber\]
Якщо мідь є індикаторним електродом в потенціометричній електрохімічній комірці, яка також включає в себе насичений каломельний опорний електрод.
\[\mathrm{SCE} \| \mathrm{Cu}^{2+}\left(a q, a_{\mathrm{Cu^{2+}}}=x\right) | \text{Cu}(s) \nonumber\]
то ми можемо використовувати потенціал клітини для визначення невідомої активності Cu 2 + в напівклітині індикаторного електрода
\[E_{\text{cell}}= E_{\text { ind }}-E_{\text {SCE }}+E_{j}= +0.3419 \mathrm{V}-\frac{0.05916}{2} \log \frac{1}{a_{\mathrm{Cu}^{2+}}}-0.2224 \mathrm{V}+E_{j} \nonumber\]
Індикаторний електрод, в якому метал контактує з розчином, що містить його іон, називається електродом першого роду. Загалом, якщо метал, M, знаходиться в розчині M n+, потенціал клітини дорівнює
\[E_{\mathrm{call}}=K-\frac{0.05916}{n} \log \frac{1}{a_{M^{n+}}}=K+\frac{0.05916}{n} \log a_{M^{n+}} \nonumber\]
де K - константа, яка включає в себе потенціал стандартного стану для M n +/M окислювально-відновлювальної пари, потенціал опорного електрода та потенціал переходу.
Зауважте, що включення E j до константи K означає, що нам не потрібно знати фактичне значення потенціалу переходу; однак потенціал переходу повинен залишатися постійним, якщо K підтримує постійне значення.
З різних причин, включаючи повільну кінетику перенесення електронів на межі розділу метал-розчин, утворення оксидів металів на поверхні електрода та інтерференційні реакції, електроди першого роду обмежуються наступними металами: Ag, Bi, Cd, Cu, Hg, Pb, Sn, Tl та Zn.
Багато з цих електродів, таких як Zn, не можна використовувати в кислих розчині, оскільки вони легко окислюються H +.
\[\mathrm{Zn}(s)+2 \mathrm{H}^{+}(a q)\rightleftharpoons \text{ H}_{2}(g)+\mathrm{Zn}^{2+}(a q) \nonumber\]
Електроди другого роду
Потенціал електрода першого роду реагує на активність M n +. Ми також можемо використовувати цей електрод для визначення активності іншого виду, якщо він знаходиться в рівновазі з M n +. Наприклад, потенціал електрода Ag в розчині Ag + дорівнює
\[E=0.7996 \mathrm{V}+0.05916 \log a_{\mathrm{Ag}^{+}} \label{11.3}\]
Якщо наситити напівосередок електрода індикатора AgI, реакція розчинності
\[\operatorname{Agl}(s)\rightleftharpoons\operatorname{Ag}^{+}(a q)+\mathrm{I}^{-}(a q) \nonumber\]
визначає концентрацію Ag +; таким чином
\[a_{\mathrm{Ag}^{+}}=\frac{K_{\mathrm{sp}, \mathrm{Agl}}}{a_{\text{I}^-}} \label{11.4}\]
де K sp, AgI - продукт розчинності для AgI. Підставляємо рівняння\ ref {11.4} на рівняння\ ref {11.3}
\[E=0.7996 \text{ V}+0.05916 \log \frac{K_{\text{sp, Agl}}}{a_{\text{I}^-}} \nonumber\]
показує, що потенціал срібного електрода є функцією активності I —. Якщо включити цей електрод в потенціометричну електрохімічну комірку з насиченим каломелевим електродом
\[\mathrm{SCE} \| \mathrm{AgI}(s), \text{ I}^-\left(a q, a_{\text{I}^-}=x\right) | \mathrm{Ag}(\mathrm{s}) \nonumber\]
тоді потенціал клітини
\[E_{\mathrm{cell}}=K-0.05916 \log a_{\text{I}^-} \nonumber\]
де K - константа, яка включає потенціал стандартного стану для окислювально-відновної пари Ag + /Ag, продукт розчинності для AgI, потенціал опорного електрода та потенціал переходу.
Якщо електрод першого роду реагує на активність іона в рівновазі з M n +, ми називаємо його електродом другого роду. Два загальних електроди другого роду - це каломель і еталонні електроди срібло/хлориду срібла.
У електроді другого роду ми пов'язуємо разом окислювально-відновну реакцію та іншу реакцію, таку як реакція розчинності. Ви можете задатися питанням, чи можемо ми зв'язати разом більше двох реакцій. Коротка відповідь - так. Електрод третього роду, наприклад, пов'язує воєдино окислювально-відновну реакцію і дві інші реакції. Такі електроди зустрічаються рідше і розглядати їх в цьому тексті ми не будемо.
Окисно-відновлювальні електроди
Електрод першого роду або другого роду розвиває потенціал в результаті окислювально-відновної реакції, в якій задіяний металевий електрод. Електрод також може служити джерелом електронів або як раковина для електронів в непов'язаній окислювально-відновної реакції, і в цьому випадку ми називаємо його окислювально-відновним електродом. Катод Pt на рисунку Template:index та прикладі Template:index є окисно-відновним електродом, оскільки його потенціал визначається активністю Fe 2 + і Fe 3 + в напівкомірці індикатора. Зверніть увагу, що потенціал окислювально-відновного електрода часто реагує на активність більше одного іона, що обмежує його корисність для прямої потенціометрії.
Мембранні електроди
Якби метали були єдиними корисними матеріалами для побудови індикаторних електродів, то корисних застосувань потенціометрії було б мало. У 1906 році Кремер виявив, що різниця потенціалів на тонкій скляній мембрані є функцією рН, коли протилежні сторони мембрани контактують з розчинами, які мають різну концентрацію H 3 O +. Існування цього мембранного потенціалу призвело до розробки абсолютно нового класу індикаторних електродів, які ми називаємо іоноселективними електродами (ІСЕД). На додаток до скляного pH-електрода доступні іоноселективні електроди для широкого спектру іонів. Також можна сконструювати мембранний електрод для нейтрального аналіту, використовуючи хімічну реакцію для генерації іона, який контролюється іоноселективним електродом. Активним напрямком досліджень продовжує залишатися розробка нових мембранних електродів.
Мембранні потенціали
На малюнку Template:index показана типова потенціометрична електрохімічна комірка, обладнана іоноселективним електродом. Коротке позначення руки для цієї клітинки
\[\text { ref (sample) }\left\|[\mathrm{A}]_{\text { samp }}\left(a q, a_{\mathrm{A}}=x\right) |[\mathrm{A}]_{\text { int }}\left(a q, a_{\mathrm{A}}=y\right)\right\| \text { ref (internal) } \nonumber\]
де іоноселективна мембрана представлена вертикальним слешем, який розділяє два розчини, що містять аналіт: розчин зразка і внутрішній розчин іоноселективного електрода. Потенціал цієї електрохімічної комірки включає потенціал кожного опорного електрода, потенціал переходу та потенціал мембрани
\[E_\text{cell} = E_\text{ref(int)} - E_\text{ref(samp)} + E_\text{mem} + E_j \label{11.5}\]
де E mem - потенціал через мембрану, а позначення ref (зразок) і ref (внутрішній) представляють еталонний електрод, занурений у зразок, і еталонний електрод, занурений у внутрішній розчин ISE. Оскільки потенціал переходу та потенціал двох опорних електродів є постійними, будь-яка зміна елемента Е відображає зміну потенціалу мембрани.
Взаємодія аналіту з мембраною генерує мембранний потенціал, якщо є різниця в його активності з двох сторін мембрани. Струм здійснюється через мембрану рухом або аналіта, або іона, вже присутнього в матриці мембрани. Мембранний потенціал задається наступним рівнянням Нернста
де (A) samp - активність аналіта у зразку, (A) int - активність аналіта у внутрішньому розчині іонселективного електрода, а z - заряд аналіта. В ідеалі, E mem дорівнює нулю, коли (A) int = (A) samp. Термін E asym, який є потенціалом асиметрії, пояснює той факт, що E mem зазвичай не дорівнює нулю за цих умов.
Наразі ми просто відзначимо, що різниця в активності аналіта призводить до мембранного потенціалу. Розглядаючи різні типи іоноселективних електродів, ми розглянемо більш конкретно джерело мембранного потенціалу.
Підставляючи рівняння\ ref {11.6} в рівняння\ ref {11.5}, припускаючи температуру 25 o С, і перестановка дає
\[E_{\mathrm{cell}}=K+\frac{0.05916}{z} \log \left(a_{A}\right)_{\mathrm{samp}} \label{11.7}\]
де K - константа, яка включає потенціали двох опорних електродів, потенціали переходу, потенціал асиметрії та активність аналіта у внутрішньому розчині. Рівняння\ ref {11.7} є загальним рівнянням і застосовується до всіх типів іоноселективних електродів.
селективність мембран
Мембранний потенціал є результатом хімічної взаємодії між аналітом і активними ділянками на поверхні мембрани. Оскільки сигнал залежить від хімічного процесу, більшість мембран не є виборчими до одного аналіту. Натомість мембранний потенціал пропорційний концентрації кожного іона, який взаємодіє з активними ділянками мембрани. Ми можемо переписати Equation\ ref {11.7}, щоб включити внесок у потенціал інтерферента, I
\[E_\text{cell} = K + \frac {0.05916} {z_A} \log \left\{ a_A + K_{A,I}(a_I)^{z_A/z_I} \right\} \nonumber\]
де z A і z I - заряди аналіта і інтерферента, а K A, I - коефіцієнт вибірковості, що становить відносну реакцію інтерферента. Коефіцієнт селективності визначається як
\[K_{A,I} = \frac {(a_A)_e} {(a_I)_e^{z_A/z_I}} \label{11.8}\]
де (a) e і (a I) e - діяльність аналіту та інтерференту, що дають однакові потенціали клітин. Коли коефіцієнт селективності дорівнює 1,00, мембрана однаково реагує на аналіт і інтерферент. Мембрана показує хорошу селективність для аналіта , коли K A, I значно менше 1,00.
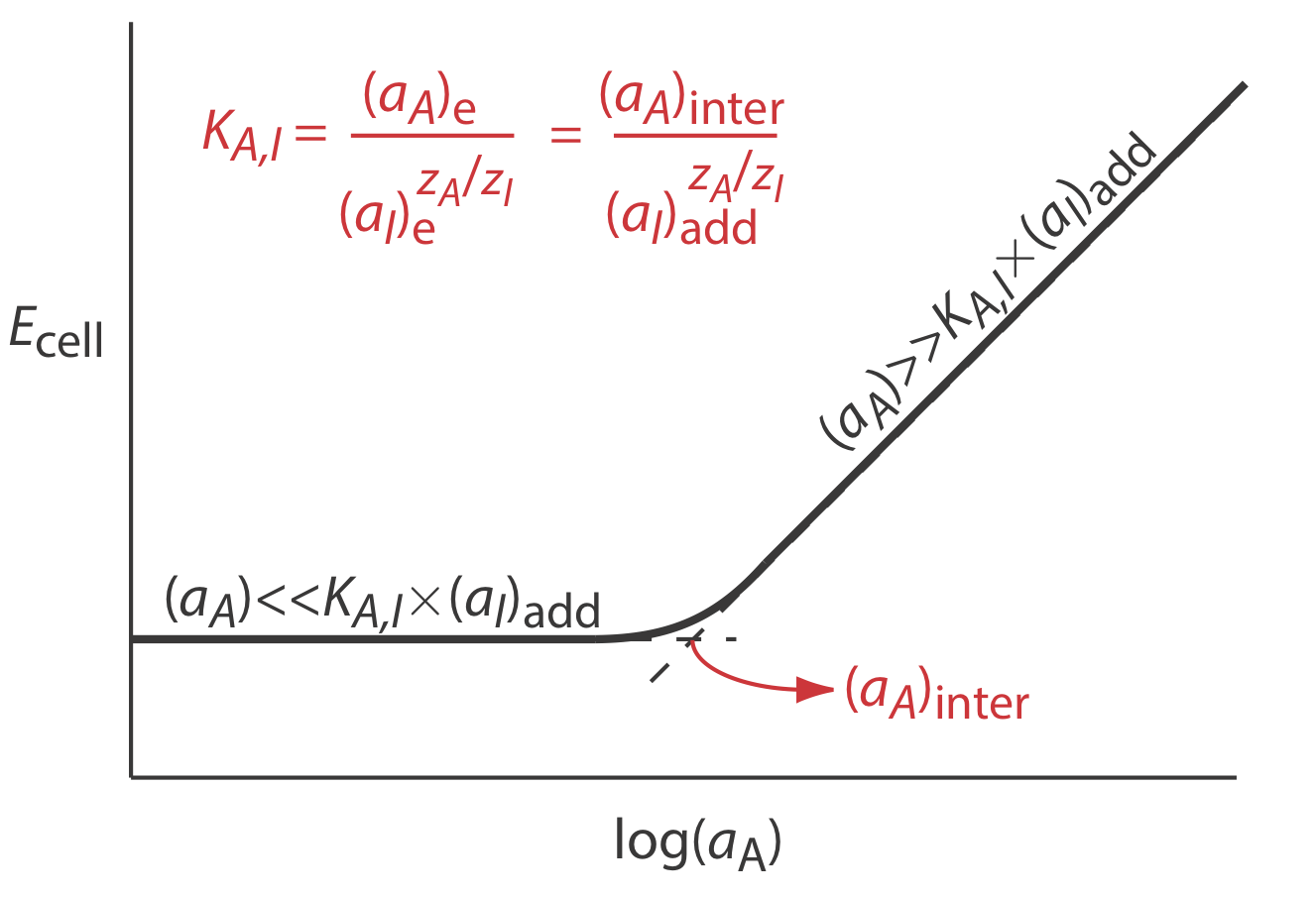
Коефіцієнти селективності для більшості наявних в продажу іоноселективних електродів передбачені виробником. Якщо коефіцієнт селективності невідомий, легко визначити його значення експериментальним шляхом шляхом приготування ряду розчинів, кожен з яких містить однакову активність інтерферентного, (а) додавання, але різну активність аналіта. Як показано на рисунку Template:index, графік потенціалу клітини порівняно з журналом активності аналіта має дві різні лінійні області. Коли активність аналіта значно більша за K A, I\(\times\) (a I) додати, потенціал є лінійною функцією log (a A), заданою Equation\ ref {11.7}. Якщо K A, I\(\times\) (a I) додати значно більше активності аналіта, однак потенціал клітини залишається постійним. Активність аналіта та інтерферента на перетині цих двох лінійних областей використовується для обчислення K A, I.
Сокальський та колеги описали спосіб отримання іонселективних електродів зі значно поліпшеною селективністю [Sokalski, T.; Ceresa, A.; Zwicki, T.; Pretsch, EJ Am. Хім. Соц. 1997, 119, 11347—11348]. Наприклад, звичайний Pb 2 + ISE має\(\log K_{\text{Pb}^{2+}/\text{Mg}^{2+}}\) значення —3.6. Якщо потенціал для розчину, в якому активність Pb 2 +\(4.1 \times 10^{-12}\) ідентичний такому для розчину, в якому активність Mg 2 + становить 0,01025, яке значення\(\log K_{\text{Pb}^{2+}/\text{Mg}^{2+}}\) для їх ISE?
Рішення
Здійснюючи відповідні заміни в Equation\ ref {11.8}, ми виявимо, що
\[K_{\text{Pb}^{2+}/\text{Mg}^{2+}} = \frac {(a_{\text{Pb}^{2+}})_e} {(a_{\text{Mg}^{2+}})_e^{z_{\text{Pb}^{2+}}/z_{\text{Mg}^{2+}}}} = \frac {4.1 \times 10^{-12}} {(0.01025)^{+2/+2}} = 4.0 \times 10^{-10} \nonumber\]
Значення\(\log K_{\text{Pb}^{2+}/\text{Mg}^{2+}}\), отже, становить —9,40.
Іоноселективний електрод для\(\text{NO}_2^-\) має значення журналу K A , I значення —3,1 для F —, —4.1 for\(\text{SO}_4^{2-}\), —1.2 для I — та —3.3 для\(\text{NO}_3^-\). Який іон є найсерйознішим інтерферентом і для якої активності цього інтерферента є потенційним еквівалентом рішення, в якому\(\text{NO}_2^-\) є активність\(2.75 \times 10^{-4}\)?
- Відповідь
-
Чим більше значення K A, I тим серйозніше перешкоди. Більші значення для K A, я відповідаю більш позитивним (менш від'ємним) значенням для журналу K A , I; таким чином, I —, з K A, I of\(6.3 \times 10^{-2}\), є найбільш серйозні ці перешкоди. Щоб знайти діяльність I — що дає потенційний еквівалент\(\text{NO}_2^-\) діяльності, відзначимо\(2.75 \times 10^{-4}\), що
\[a_{\text{NO}_2^-}=K_{A, I} \times a_{\text{I}^-} \nonumber\]
Робимо відповідні заміни
\[2.75 \times 10^{-4}=\left(6.3 \times 10^{-2}\right) \times a_{\mathrm{I}^-} \nonumber\]
і рішення для\(a_{\text{I}^-}\) дає свою діяльність як\(4.4 \times 10^{-3}\).
Скляні іонно-селективні електроди
Перші комерційні скляні електроди були виготовлені з використанням Corning 015, скла зі складом, який становить приблизно 22% Na 2 O, 6% CaO та 72% SiO 2. При зануренні у водний розчин на кілька годин зовнішня приблизно 10 нм поверхні мембрани стає гідратованою, в результаті чого утворюються негативно заряджені ділянки, —SiO —. Іони натрію, Na +, служать протиіонами. Оскільки H + сильніше зв'язується з —SiO - ніж Na +, вони витісняють іони натрію
\[\mathrm{H}^{+}+-\mathrm{SiO}^{-} \mathrm{Na}^{+}\rightleftharpoons-\mathrm{SiO}^{-} \mathrm{H}^{+}+\mathrm{Na}^{+} \nonumber\]
пояснюючи селективність мембрани для Н +. Транспортування заряду через мембрану здійснюється іонами Na +. Потенціал скляного електрода за допомогою Corning 015 підпорядковується рівнянню
\[E_{\mathrm{cell}}=K+0.05916 \log a_{\mathrm{H}^{+}} \label{11.9}\]
в діапазоні рН приблизно від 0,5 до 9. При більш базових значеннях рН скляна мембрана більш чутлива до інших катіонів, таких як Na + і K +.
Для скляної мембрани Corning 015 коефіцієнт селективності K H + /Na + дорівнює\(\approx 10^{-11}\). Яка очікувана похибка, якщо виміряти рН розчину, в якому активність Н +\(2 \times 10^{-13}\) і активність Na + становить 0,05?
Рішення
Розчин, в якому діє фактична активність Н +, (а Н +),\(2 \times 10^{-13}\) має рН 12,7. Оскільки електрод реагує як на H +, так і на Na +, видима активність додатка H +, (A H +), є
\[(a_{\text{H}^+})_\text{app} = (a_{\text{H}^+})_\text{act} + (K_{\text{H}^+ / \text{Na}^+} \times a_{\text{Na}^+}) = 2 \times 10^{-13} + (10^{-11} \times 0.05) = 7 \times 10^{-13} \nonumber\]
Видима активність Н + еквівалентна рН 12,2, похибка -0,5 одиниць рН.
Заміна Na 2 O і CaO на Li 2 O і BaO розширює корисний діапазон pH електродів скляної мембрани до рівнів рН більше 12.
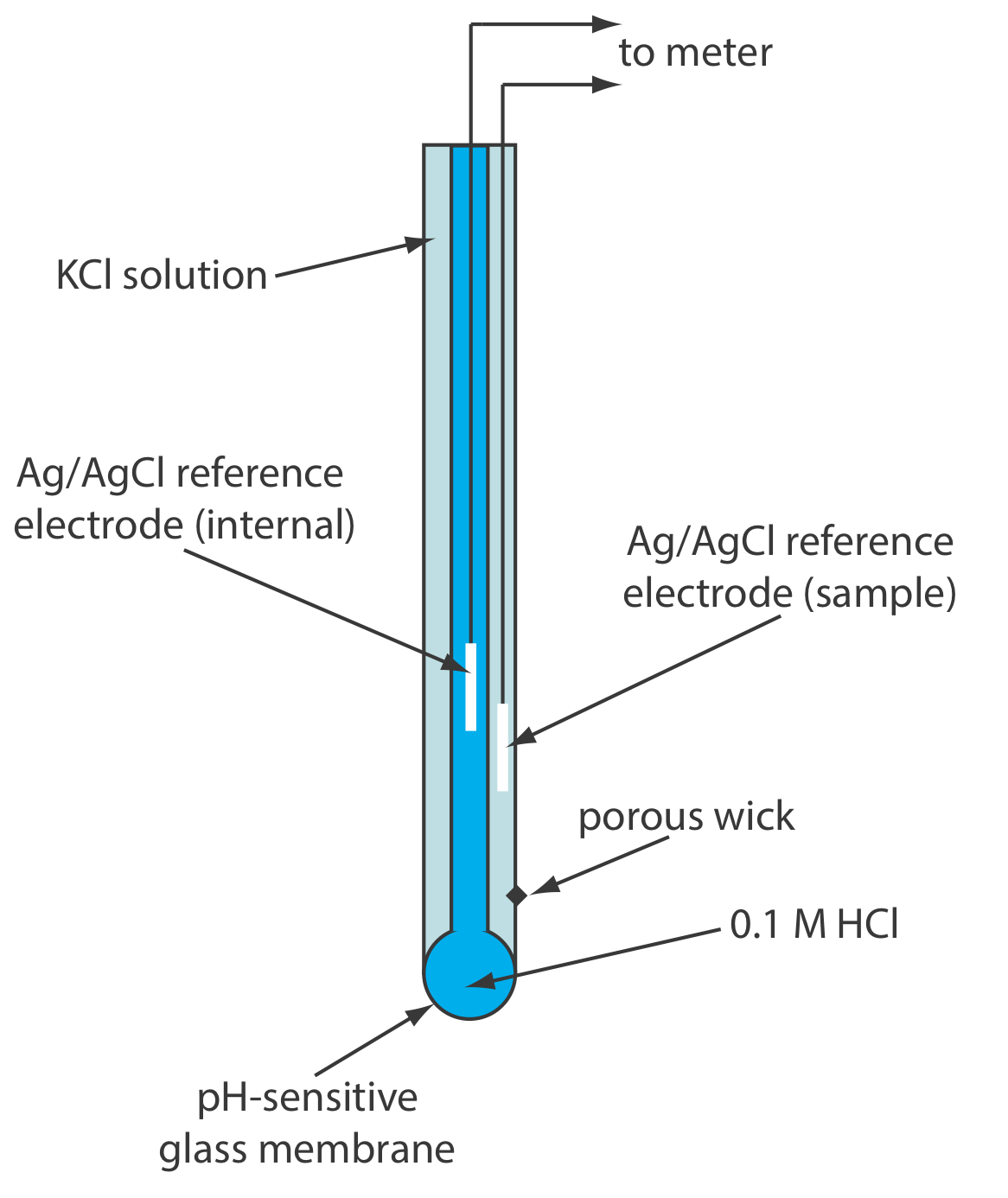
Електроди рН скляної мембрани часто випускаються в комбінованому вигляді, що включає в себе як індикаторний електрод, так і опорний електрод. Використання одного електрода значно спрощує вимірювання рН. Приклад типового комбінованого електрода наведено на малюнку Template:index.
Спостереження, що скляна мембрана Corning 015 реагує на іони, відмінні від H + (див. Приклад Template:index) призвело до розвитку скляних мембран з більшою селективністю для інших катіонів. Наприклад, в якості іоноселективного електрода для Na + використовується скляна мембрана зі складом 11% Na 2 O, 18% Al 2 O 3, а 71% SiO 2. Інші склоіонселективні електроди розроблені для аналізу Li +, K +, Rb +, Cs +\(\text{NH}_4^+\), Ag + та Tl +. У таблиці Template:index наведено кілька прикладів.
| аналіт | мембранний склад | коефіцієнти селективності |
|---|---|---|
| Na + | 11% Na 2 O, 18% Аль 2 О 3, 71% SiO 2 |
\(K_{\mathrm{Na}^{+} / \mathrm{H}^{+}}=1000\) \(K_{\mathrm{Na}^{+} / \mathrm{K}^{+}}=0.001\) \(K_{\mathrm{Na}^{+} / \mathrm{Li}^{+}}=0.001\) |
| Лі + | 15% Лі 2 О, 25% Аль 2 О 3, 60% SiO 2 |
\(K_{\mathrm{Li}^{+} / \mathrm{Na}^{+}}=0.3\) \(K_{\mathrm{Li}^{+} / \mathrm{K}^{+}}=0.001\) |
| К + | 27% Na 2 О, 5% Аль 2 О 3, 68% ІО 2 |
\(K_{\mathrm{K}^{+} / \mathrm{Na}^{+}}=0.05\) |
|
Коефіцієнти селективності є приблизними; значення, знайдені експериментальним шляхом, можуть істотно відрізнятися від перерахованих значень. Див. Камманн, К. Робота з іонно-селективними електродами, Спрінгер-Верлаг: Берлін, 1977. |
||
Оскільки скляна мембрана іоноселективного електрода дуже тонка - вона має товщину лише близько 50 мкм - з ними потрібно звертатися обережно, щоб уникнути тріщин або поломок. Скляні електроди зазвичай зберігаються в буфері для зберігання, рекомендованому виробником, що гарантує, що зовнішня поверхня мембрани залишається гідратованою. Якщо скляний електрод висихає, його відновлюють, замочуючи на кілька годин у розчині, який містить аналіт. Склад скляної мембрани з часом буде змінюватися, що впливає на продуктивність електрода. Середній термін служби типового скляного електрода становить кілька років.
Твердотільні іонно-селективні електроди
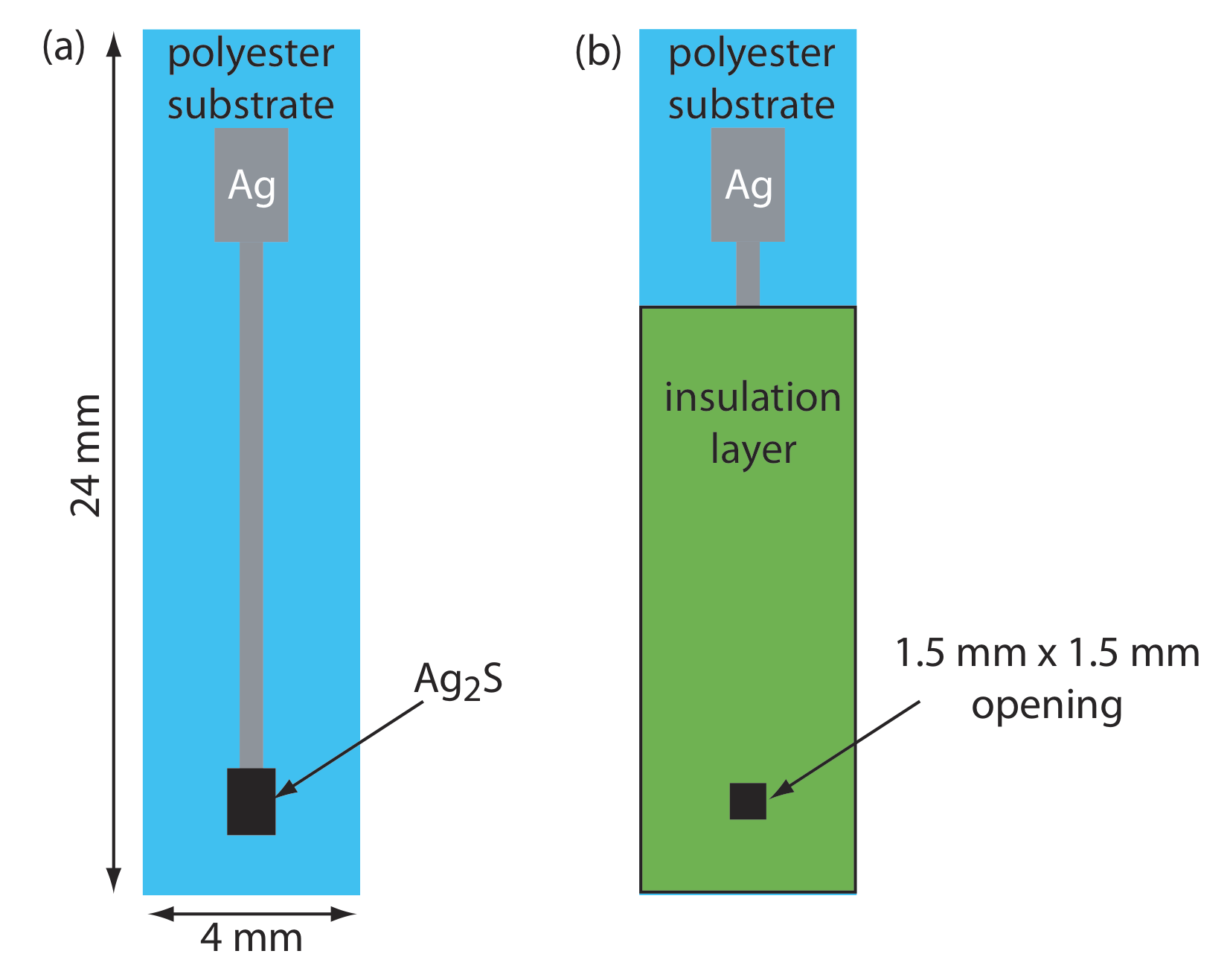
Твердотільний іонселективний електрод має мембрану, яка складається або з полікристалічної неорганічної солі, або з монокристала неорганічної солі. Ми можемо виготовити полікристалічний твердотільний іонселективний електрод, ущільнивши гранулу AGS товщиною 1—2 мм або суміш AgS та другої солі срібла або іншого сульфіду металу - в кінець непровідного пластикового циліндра, заповнивши циліндр внутрішнім розчином, який містить аналіт, і розмістивши еталонний електрод у внутрішній розчин. На малюнку Template:index показано типовий дизайн.
NaCl в сільничці є прикладом полікристалічного матеріалу, оскільки він складається з безлічі дрібних кристалів хлориду натрію. З іншого боку, соляні пластини NaCl, що використовуються в ІЧ-спектроскопії (див. Розділ 10), є прикладом монокристала хлориду натрію.
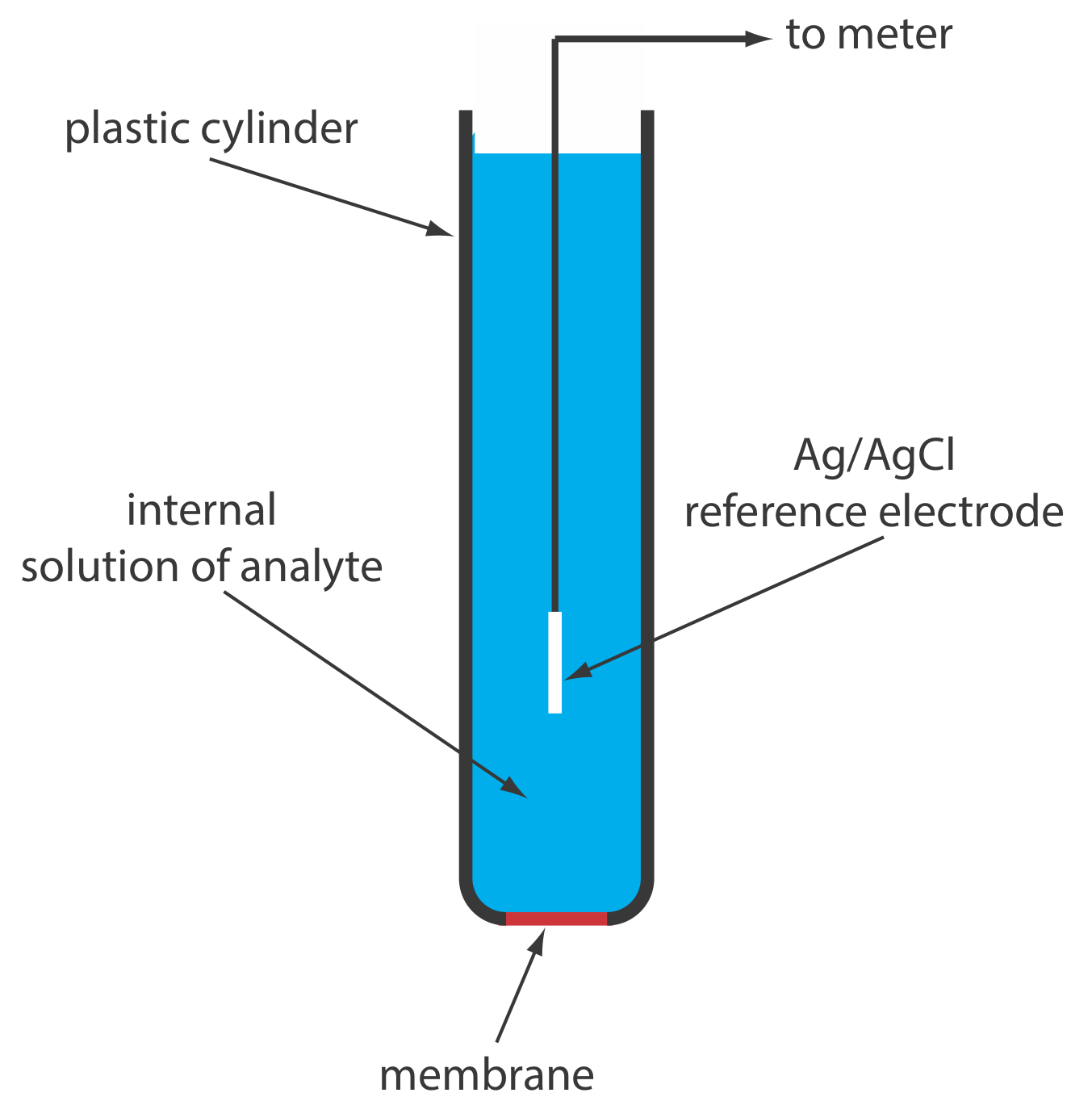
Мембранний потенціал для гранули Ag 2 S розвивається в результаті різниці в ступені реакції розчинності
\[\mathrm{Ag}_{2} \mathrm{S}(s)\rightleftharpoons2 \mathrm{Ag}^{+}(a q)+\mathrm{S}^{2-}(a q) \nonumber\]
з двох сторін мембрани, при цьому заряд переноситься через мембрану іонами Ag +. Коли ми використовуємо електрод для контролю активності Ag +, потенціал клітини дорівнює
\[E_{\text {cell }}=K+0.05916 \log a_{\mathrm{Ag}^{+}} \nonumber\]
Мембрана також реагує на активність\(\text{S}^{2-}\), з потенціалом клітини
\[E_{\mathrm{cell}}=K-\frac{0.05916}{2} \log a_{\text{S}^{2-}} \nonumber\]
Якщо об'єднати нерозчинну сіль срібла, таку як AgCl, з Ag 2 S, то мембранний потенціал також реагує на концентрацію Cl —, з потенціалом клітини
\[E_{\text {cell }}=K-0.05916 \log a_{\mathrm{Cl}^{-}} \nonumber\]
Змішуючи Ag 2 S з CdS, CU або PbS, ми можемо зробити іоноселективний електрод, який реагує на активність Cd 2 +, Cu 2+ або Pb 2 +. У цьому випадку потенціал клітини дорівнює
\[E_{\mathrm{cell}}=K+\frac{0.05916}{2} \ln a_{M^{2+}} \nonumber\]
де М 2 + - активність іона металу.
У таблиці Template:index наведено приклади полікристалічних твердотільних іонселективних електродів на основі Ag 2 S. Селективність цих іоноселективних електродів залежить від відносної розчинності сполук. A Cl - ISE з використанням мембрани Ag 2 S/AgCl є більш селективним для Br - (K Cl - /Br - = 10 2) і для I - (K Cl - /I - = 10 6) тому що AgBr і AgI менш розчинні, ніж AgCl. Якщо активність Br — досить висока, AgCl на межі розділу мембрана/розчин замінюється AgBr і реакція електрода на Cl — істотно знижується. Більшість полікристалічних іонселективних електродів, перелічених у таблиці Template:index працюють у розширеному діапазоні рівнів рН. Рівновага між S 2— і HS — обмежує аналіз для S 2— до діапазону рН 13—14.
| аналіт | мембранний склад | коефіцієнти селективності |
|---|---|---|
| Вік + | Вік 2 С |
\(K_{\text{Ag}^+/\text{Cu}^{2+}} = 10^{-6}\) \(K_{\text{Ag}^+/\text{Pb}^{2+}} = 10^{-10}\) Hg 2 + заважає |
| Кд 2+ | Компакт-диски/Ag 2 S |
\(K_{\text{Cd}^{2+}/\text{Fe}^{2+}} = 200\) \(K_{\text{Cd}^{2+}/\text{Pb}^{2+}} = 6\) Ag +, Hg 2+ та Cu 2+ повинні бути відсутніми |
| Куб 2+ | Куб/мішка 2 S |
\(K_{\text{Cu}^{2+}/\text{Fe}^{3+}} = 10\) \(K_{\text{Cu}^{2+}/\text{Cu}^{+}} = 10^{-6}\) Ag + і Hg 2 + повинні бути відсутніми |
| Пб 2+ | ПБС/Аг 2 S |
\(K_{\text{Pb}^{2+}/\text{Fe}^{3+}} = 1\) \(K_{\text{Pb}^{2+}/\text{Cd}^{2+}} = 1\) Ag +, Hg 2+ та Cu 2+ повинні бути відсутніми |
| Бр — | Агбр/мітка 2 S |
\(K_{\text{Br}^-/\text{I}^{-}} = 5000\) \(K_{\text{Br}^-/\text{Cl}^{-}} = 0.005\) \(K_{\text{Br}^-/\text{OH}^{-}} = 10^{-5}\) S 2— має бути відсутнім |
| Cl — | АГКЛ/Міг 2 S |
\(K_{\text{Cl}^-/\text{I}^{-}} = 10^{6}\) \(K_{\text{Cl}^-/\text{Br}^{-}} = 100\) \(K_{\text{Cl}^-/\text{OH}^{-}} = 0.01\) S 2— має бути відсутнім |
| Я — | Агі/мітка 2 S |
\(K_{\text{I}^-/\text{S}^{2-}} = 30\) \(K_{\text{I}^-/\text{Br}^{-}} = 10^{-4}\) \(K_{\text{I}^-/\text{Cl}^{-}} = 10^{-6}\) \(K_{\text{I}^-/\text{OH}^{-}} = 10^{-7}\) |
| СКН — | AGSCN/мітка 2 S |
\(K_{\text{SCN}^-/\text{I}^{-}} = 10^{3}\) \(K_{\text{SCN}^-/\text{Br}^{-}} = 100\) \(K_{\text{SCN}^-/\text{Cl}^{-}} = 0.1\)\(K_{\text{SCN}^-/\text{OH}^{-}} = 0.01\) S 2— має бути відсутнім |
| S 2— | Вік 2 С | Hg 2 + повинен бути відсутнім |
|
Коефіцієнти селективності є приблизними; значення, знайдені експериментальним шляхом, можуть істотно відрізнятися від перерахованих значень. Див. Камманн, К. Робота з іонно-селективними електродами, Спрінгер-Верлаг: Берлін, 1977. |
||
Мембрана F — іоноселективного електрода виготовлена з монокристалу LaF 3, який зазвичай легують невеликою кількістю eUF 2 для підвищення провідності мембрани. Оскільки EuF 2 забезпечує лише два F - іони - порівняно з трьома F - іонами в LaF 3, кожен eUF 2 створює вакансію в решітці кристала. Іони фтору проходять через мембрану шляхом переміщення в сусідні вакансії. Як показано на малюнку Template:index, мембрана LaF 3 герметична в кінці непровідного пластикового циліндра, який містить стандартний розчин F -, як правило, 0,1 M NaF, і опорний електрод Ag/AgCl.
Мембранний потенціал для F — ISE є результатом різниці розчинності LaF 3 на протилежних сторонам мембрани, причому потенціал задається
\[E_{\mathrm{cell}}=K-0.05916 \log a_{\mathrm{F}^-} \nonumber\]
Однією з переваг F — іоноселективного електрода є його свобода від перешкод. Єдиним істотним винятком є OH — (K F — /OH — = 0.1), що накладає максимальну межу рН для успішного аналізу. Нижче рН 4 переважною формою фтору в розчині є HF, що не сприяє мембранному потенціалу. З цієї причини аналіз на фтор проводять при рН більше 4.
Який максимальний рН ми можемо терпіти, якщо потрібно проаналізувати розчин, в якому активність F —\(1 \times 10^{-5}\) з похибкою менше 1%?
Рішення
При наявності ОН — потенціал клітини
\[E_{\mathrm{cell}}=K-0.05916\left\{a_{\mathrm{F}^-}+K_{\mathrm{F}^- / \mathrm{OH}^{-}} \times a_{\mathrm{OH}^-}\right\} \nonumber\]
Для досягнення похибки менше 1% термін\(K_{\mathrm{F}^- / \mathrm{OH}^{-}} \times a_{\mathrm{OH}^-}\) повинен бути менше 1% від F —; таким чином
\[K_{\mathrm{F}^- / \mathrm{OH}^-} \times a_{\mathrm{OH}^{-}} \leq 0.01 \times a_{\mathrm{F}^-} \nonumber\]
\[0.10 \times a_{\mathrm{OH}^{-}} \leq 0.01 \times\left(1.0 \times 10^{-5}\right) \nonumber\]
Розв'язування для ОН — дає максимально допустиму активність для ОН — як\(1 \times 10^{-6}\), що відповідає рН менше 8.
Припустимо, ви бажаєте використовувати нітрит-селективний електрод у Вправі Template:index для вимірювання активності\(\text{NO}_2^-\). Якщо активність\(\text{NO}_2^-\) є\(2.2 \times 10^{-4}\), який максимальний рН можна терпіти, якщо похибка через ОН — повинна бути менше 10%? Коефіцієнт селективності для OH —,\(K_{\text{NO}_2^-/\text{OH}^-}\), дорівнює 630. Чи очікуєте ви, що електрод матиме нижчу межу рН? Чітко поясніть свою відповідь.
- Відповідь
-
При наявності ОН — потенціал клітини
\[E_{\mathrm{cell}}=K-0.05916 \log \left\{a_{\mathrm{NO}_{2}^-}+K_{\mathrm{NO}_{2}^- / \mathrm{OH}^{-}} \times a_{\mathrm{OH}^{-}}\right\} \nonumber\]
Щоб досягти похибки менше 10%, термін\(K_{\mathrm{NO}_{2}^- / \mathrm{OH}^{-}} \times a_{\mathrm{OH}^{-}}\) повинен бути менше 1%\(a_{\text{NO}_2^-}\); таким чином
\[K_{\mathrm{NO}_{2}^- / \mathrm{OH}^{-}} \times a_{\mathrm{OH}^-} \leq 0.10 \times a_{\mathrm{NO}_{2}^-} \nonumber\]
\[630 \times a_{\mathrm{OH}^{-}} \leq 0.10 \times\left(2.2 \times 10^{-4}\right) \nonumber\]
Розв'язування для ОН — дає його максимально допустиму активність як\(3.5 \times 10^{-8}\), яка відповідає рН менше 6,54.
Електрод дійсно має нижню межу рН. Нітрит є сполученою слабкою основою HNO 2, виду, на який ISE не реагує. Як показано на схемі сходів нижче, при рН 4,15 приблизно 10% нітриту присутній як HNO 2. Мінімальний рН 4,5 - звичайна рекомендація при використанні нітритного ISE. Це відповідає\(\text{NO}_2^- / \text{HNO}_2\) співвідношенню
\[\mathrm{pH}=\mathrm{p} K_{\mathrm{a}}+\log \frac{\left[\mathrm{NO}_{2}^{-}\right]}{\left[\mathrm{HNO}_{2}\right]} \nonumber\]
\[4.5=3.15+\log \frac{\left[\mathrm{NO}_{2}^{-}\right]}{\left[\mathrm{HNO}_{2}\right]} \nonumber\]
\[\frac{\left[\mathrm{NO}_{2}^{-}\right]}{\left[\mathrm{HNO}_{2}\right]} \approx 22 \nonumber\]
Таким чином, при рН 4,5 приблизно 96% нітриту присутній як\(\text{NO}_2^-\).
На відміну від іоноселективного електрода зі скляної мембрани, твердотільний ISE не потребує кондиціонування перед його використанням, і він може зберігатися сухим. Поверхня електрода схильна до отруєння, як описано вище для Cl — ISE при контакті з надмірною концентрацією Br —. Якщо електрод отруївся, його можна повернути в початковий стан шляхом шліфування і полірування кристалічної мембрани.
Отруєння просто означає, що поверхня була хімічно модифікована, наприклад, AgBr, що утворюється на поверхні мембрани AgCl.
Іонно-селективні електроди на рідкій основі
Інший клас іоноселективних електродів використовує гідрофобну мембрану, яка містить рідкий органічний комплексоутворювач, який вибірково реагує з аналітом. Використовували три типи органічних комплексоутворювачів: катіонообмінники, аніонообмінники та нейтральні іонофори. Мембранний потенціал існує, якщо активність аналіту різна з двох сторін мембрани. Струм проводиться через мембрану аналітом.
Іонофор - це ліганд, зовнішній вигляд якого гідрофобний і внутрішній простір якого гідрофільний. Показаний тут коронний ефір - один із прикладів нейтрального іонофора.
Одним із прикладів іоноселективного електрода на рідкій основі є те, що для Ca 2 +, який використовує пористу пластичну мембрану, насичену катіонообмінником ді- (n -децил) фосфатом. Як показано на малюнку Template:index, мембрана розміщена на кінці непровідної циліндричної трубки і контактує з двома резервуарами. Зовнішній резервуар містить ді- (n -децил) фосфат в di- n -октилфенілфосфонаті, який просочується в пористу мембрану. Внутрішній резервуар містить стандартний водний розчин Ca 2 + і еталонний електрод Ag/AgCl. Також випускаються іоноселективні електроди кальцію, в яких ді- (n -децил) фосфат іммобілізується в мембрані з полівінілхлориду (ПВХ), що виключає необхідність у зовнішньому резервуарі.
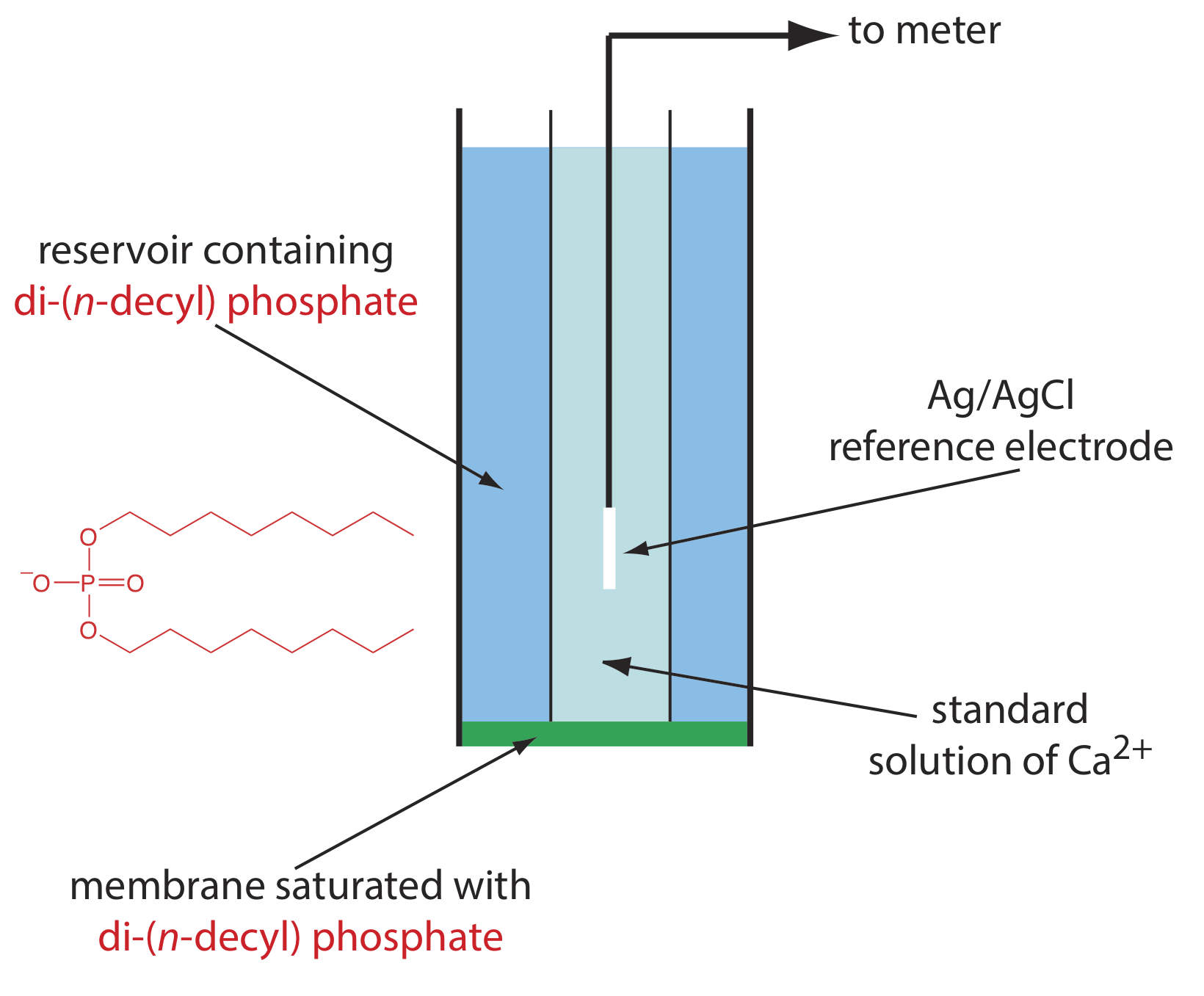
Мембранний потенціал для Ca 2 + ISE розвивається в результаті різниці в ступені реакції комплексоутворення
\[\mathrm{Ca}^{2+}(a q)+2\left(\mathrm{C}_{10} \mathrm{H}_{21} \mathrm{O}\right)_{2} \mathrm{PO}_{2}^{-}(mem) \rightleftharpoons \mathrm{Ca}\left[\left(\mathrm{C}_{10} \mathrm{H}_{21} \mathrm{O}\right)_{2} \mathrm{PO}_{2}\right]_2 (mem) \nonumber\]
з двох сторін мембрани, де (мем) вказує вид, який присутній в мембрані. Потенціал клітини для іоноселективного електрода Ca 2 + дорівнює
\[E_{\mathrm{cell}}=K+\frac{0.05916}{2} \log a_{\mathrm{ca}^{2+}} \nonumber\]
Селективність цього електрода для Ca 2 + дуже хороша, причому тільки Zn 2 + демонструє більшу селективність.
У таблиці Template:index наведено властивості декількох іонселективних електродів на рідкій основі. Електрод, що використовує резервуар для рідини, може зберігатися в розведеному розчині аналіту і не потребує додаткового кондиціонування перед використанням. Термін служби електрода з ПВХ-мембраною, однак, пропорційний його впливу водними розчинами. З цієї причини ці електроди найкраще зберігати, накривши мембрану ковпачком разом з невеликою кількістю змоченої марлі для підтримки вологого середовища. Перед використанням електрода його витримують в розчині аналіту протягом 30-60 хвилин.
| аналіт | мембранний склад | коефіцієнти селективності |
|---|---|---|
| Ка 2+ | ді- (н-децил) фосфат в ПВХ |
\(K_{\text{Ca}^{2+}/\text{Zn}^{2+}} = 1-5\) \(K_{\text{Ca}^{2+}/\text{Al}^{3+}} = 0.90\) \(K_{\text{Ca}^{2+}/\text{Mn}^{2+}} = 0.38\) \(K_{\text{Ca}^{2+}/\text{Cu}^{2+}} = 0.070\) \(K_{\text{Ca}^{2+}/\text{Mg}^{2+}} = 0.032\) |
| К + | валіноміцин в ПВХ |
\(K_{\text{K}^{+}/\text{Rb}^{+}} = 1.9\) \(K_{\text{K}^{+}/\text{Cs}^{+}} = 0.38\) \(K_{\text{K}^{+}/\text{Li}^{+}} = 10^{-4}\) |
| Лі + | ETH 149 у ПВХ |
\(K_{\text{Li}^{+}/\text{H}^{+}} = 1\) \(K_{\text{Li}^{+}/\text{Na}^{+}} = 0.03\) \(K_{\text{Li}^{+}/\text{K}^{+}} = 0.007\) |
| \(\text{NH}_4^+\) | нонактин і монактин в ПВХ |
\(K_{\text{NH}_4^{+}/\text{K}^{+}} = 0.12\) \(K_{\text{NH}_4^{+}/\text{H}^{+}} = 0.016\) \(K_{\text{NH}_4^{+}/\text{Li}^{+}} = 0.0042\) \(K_{\text{NH}_4^{+}/\text{Na}^{+}} = 0.002\) |
| \(\text{ClO}_3^-\) | \(\text{Fe}(o\text{-phen})_3^{3+}\)в р -нітроцимен з пористою мембраною |
\(K_{\text{ClO}_4^{-}/\text{OH}^{-}} = 1\) \(K_{\text{ClO}_4^{-}/\text{I}^{-}} = 0.012\) \(K_{\text{ClO}_4^{-}/\text{NO}_3^{-}} = 0.0015\) \(K_{\text{ClO}_4^{-}/\text{Br}^{-}} = 5.6 \times 10^{-4}\) \(K_{\text{ClO}_4^{-}/\text{Cl}^{-}} = 2.2 \times 10^{-4}\) |
| \(\text{NO}_3^-\) | тетрадодецил аміачна селітра в ПВХ |
\(K_{\text{NO}_3^{-}/\text{Cl}^{-}} = 0.006\) \(K_{\text{NO}_3^{-}/\text{F}^{-}} = 9 \times 10^{-4}\) |
|
Коефіцієнти селективності є приблизними; значення, знайдені експериментальним шляхом, можуть істотно відрізнятися від перерахованих значень. Див. Камманн, К. Робота з іонно-селективними електродами, Спрінгер-Верлаг: Берлін, 1977. |
||
Газочутливі електроди
Ряд мембранних електродів реагує на концентрацію розчиненого газу. Основна конструкція газочутливого електрода, як показано на малюнку Template:Index, складається з тонкої мембрани, яка відокремлює зразок від внутрішнього розчину, який містить іоноселективний електрод. Мембрана проникна для газоподібного аналіту, але непроникна для нелетких компонентів матриці зразка. Газоподібний аналіт проходить через мембрану, де реагує з внутрішнім розчином, утворюючи вид, концентрація якого контролюється іоноселективним електродом. Наприклад, в електроді СО 2 CO 2 дифузує по мембрані, де він реагує у внутрішньому розчині з утворенням H 3 O +.
Зміна активності Н 3 О + у внутрішньому розчині контролюють за допомогою рН-електрода, для якого потенціал клітини задається рівнянням\ ref {11.9}. Щоб знайти зв'язок між активністю H 3 O + у внутрішньому розчині та активністю СО 2 у внутрішньому розчині, ми переставили вираз константи рівноваги для реакції\ ref {11.10}; таким чином
де K a - постійна рівноваги. Якщо активність\(\text{HCO}_3^-\) у внутрішньому розчині досить велика, то на його активність не впливає невелика кількість СО 2, що проходить через мембрану. Підстановка рівняння\ ref {11.11} у рівняння\ ref {11.9} дає
\[E_{\mathrm{cell}}=K^{\prime}+0.05916 \log a_{\mathrm{co}_{2}} \nonumber\]
де K′ - константа, яка включає постійну для pH-електрода, постійну рівноваги для реакції\ ref {11.10} і активність\(\text{HCO}_3^-\) у внутрішньому розчині.
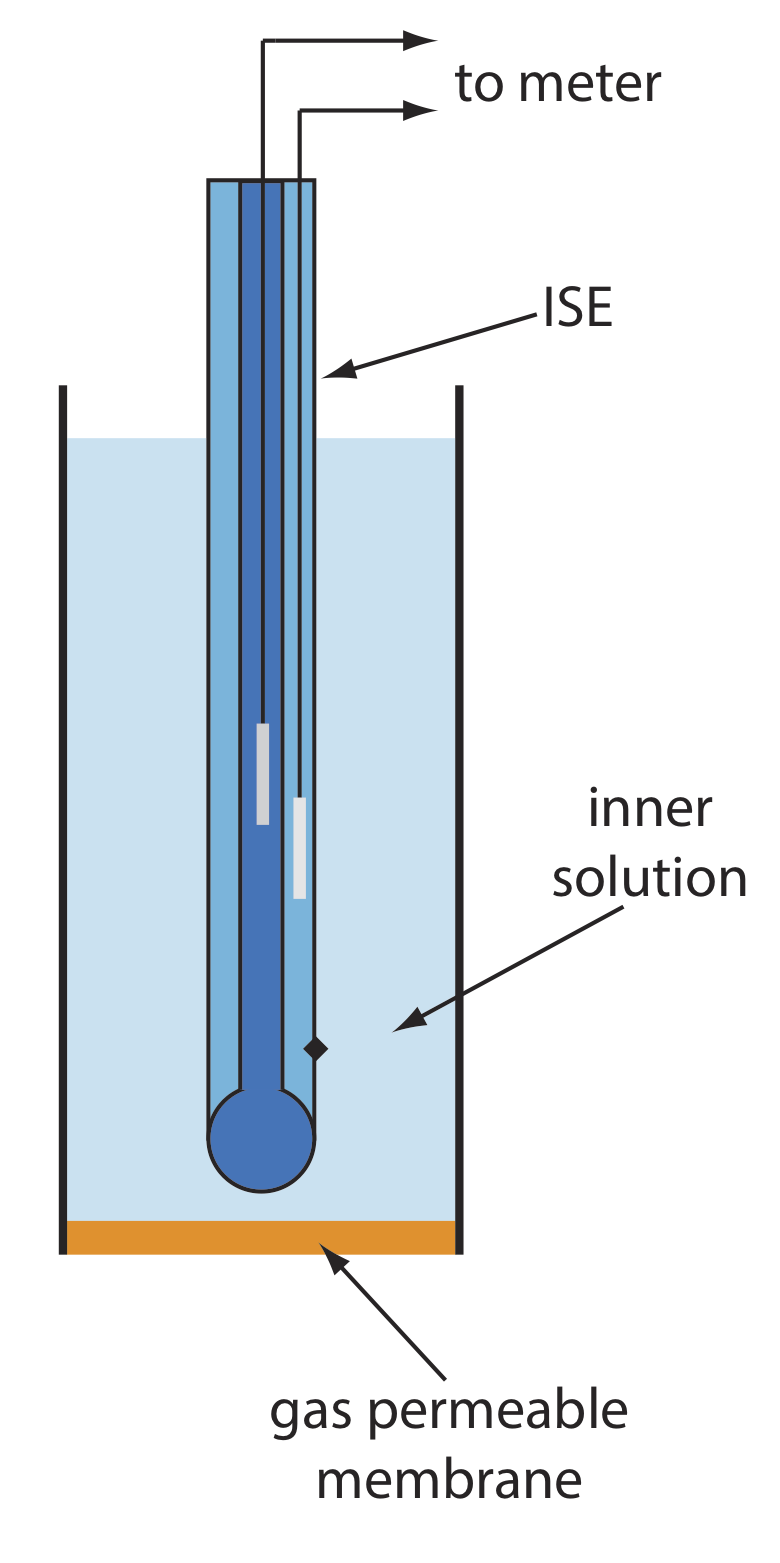
У таблиці Template:index наведено властивості декількох газочутливих електродів. Склад внутрішнього розчину з використанням змінюється, і внутрішній розчин, і мембрану необхідно періодично замінювати. Газочутливі електроди зберігаються в розчині, подібному до внутрішнього розчину, щоб мінімізувати їх вплив атмосферних газів.
| аналіт | внутрішнє рішення | реакція у внутрішньому розчині | іоноселективний електрод |
|---|---|---|---|
| СО 2 |
10 мм Нахо 3 10 мм NaCl |
\ (\ mathrm {CO} _ {2} (a) +2\ mathrm {H} _ {2}\ mathrm {O} (l)\ правий лівий гарпуни \\ текст {HCO} _ {3} ^ {-} (a) +\ текст {H} _ {3}\ mathrm {O} ^ {+} (a q) \) |
РН скла ISE |
| HCN | 10 мМ кАг (CN) 2 | \ (\ mathrm {HCN} (a) +\ mathrm {H} _ {2}\ mathrm {O} (l)\ правий лівий гарпуни\\ \ mathrm {CN} ^ {-} (a) +\ text {H} _ {3}\ mathrm {O} ^ {+} (a q)\) |
Ag 2 S твердотільний ISE |
| HF | 1 М Н 3 О + | \ (\ mathrm {HF} (a) +\ mathrm {H} _ {2}\ mathrm {O} (l)\ правий лівий гарпуни \\\ матрм {F} ^ {-} (a) +\ текст {H} _ {3}\ mathrm {O} ^ {+} (a q)\) |
F — твердотільний ISE |
| Н 2 С | pH 5 цитратний буфер | \ (\ mathrm {H} _ {2}\ mathrm {S} (a) +\ текст {H} _ {2}\ mathrm {O} (l)\ правий лівий гарпуни\ \ mathrm {HS} ^ {-} (a q) +\ текст {H} _ {3}\ mathrm {O} ^ {+} (a q)\) |
Ag 2 S твердотільний ISE |
| NH 3 |
10 мм NH 4 Кл 0.1 ММ КНО 3 |
\ (\ mathrm {NH} _ {3} (a) +\ текст {H} _ {2}\ mathrm {O} (l)\ правий лівий арпуни \\ mathrm {NH} _ {4} ^ {+} (a) +\ текст {OH} ^ {-} (a)\) |
РН скла ISE |
| НІ 2 |
20 мм нано 2 0.1 ММ КНО 3 |
\ (2\ mathrm {NO} _ {2} (a) +3\ mathrm {H} _ {2}\ mathrm {O} (l)\ правий лівий гарпуни\\ {\ mathrm {NO} _ {3} ^ {-} ^ {3} ^ {3} ^ {3} ^ {3} ^ {N} _ {3}\ математика {O} ^ {+} (a q)}\) |
РН скла ISE |
| ТАК 2 |
1 Мм АГСО 3 рН 5 |
\ (\ mathrm {SO} _ {2} (a) +2\ mathrm {H} _ {2}\ mathrm {O} (l)\ правий лівий гарпуни\ \ mathrm {HSO} _ {3} ^ {-} (a) +\ text {H} _ {3}\ mathrm {O} ^ {+} (a q)\) |
РН скла ISE |
|
Джерело: Камманн, К. Робота з іонно-селективними електродами, Springer-Verlag: Берлін, 1977. |
|||
Потенціометричні біосенсори
Підхід до розробки газочутливих електродів може бути модифікований для створення потенціометричних електродів, які реагують на біохімічно важливий вид. Найпоширенішим класом потенціометричних біосенсорів є ферментні електроди, в яких ми затримуємо або знерухомлюємо фермент на поверхні потенціометричного електрода. Реакція аналіта з ферментом виробляє продукт, концентрація якого контролюється потенціометричним електродом. Потенціометричні біосенсори також були розроблені навколо інших біологічно активних видів, включаючи антитіла, бактеріальні частинки, тканини та рецептори гормонів.
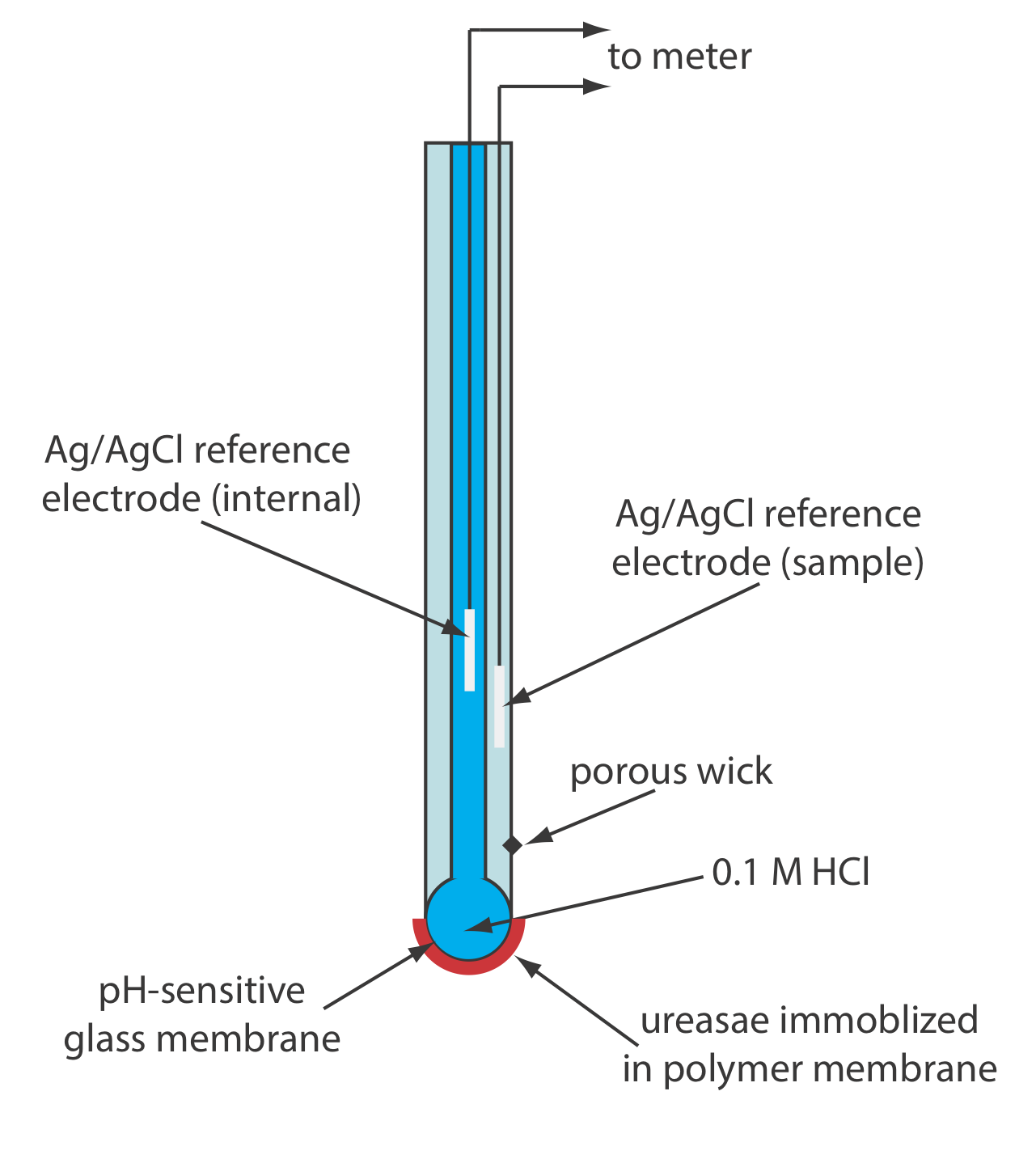
Одним із прикладів ферментного електрода є електрод сечовини, в основі якого лежить каталітичний гідроліз сечовини уреазою.
\[\mathrm{CO}\left(\mathrm{NH}_{2}\right)_{2}(a q)+2 \mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons 2 \mathrm{NH}_{4}^{+}(a q)+\text{ CO}_{3}^{-}(a q) \nonumber\]
Рисунок Template:index показує одну версію електрода сечовини, яка модифікує газочутливий електрод NH 3 шляхом додавання діалізної мембрани, яка затримує pH 7,0 буферний розчин уреази між діалізною мембраною та газопроникною мембраною [(a) Papastathopoulos, D.S.; Rechnitz, G. А. анальний. Чим. Акт 1975, 79, 17—26; (б) Ріхель, Т. Едук. 1984, 61, 640—642]. Електрод NH 3, як показано в таблиці Template:index, використовує газопроникну мембрану та скляний електрод pH. NH 3 розсіюється по мембрані, де він змінює рН внутрішнього розчину.
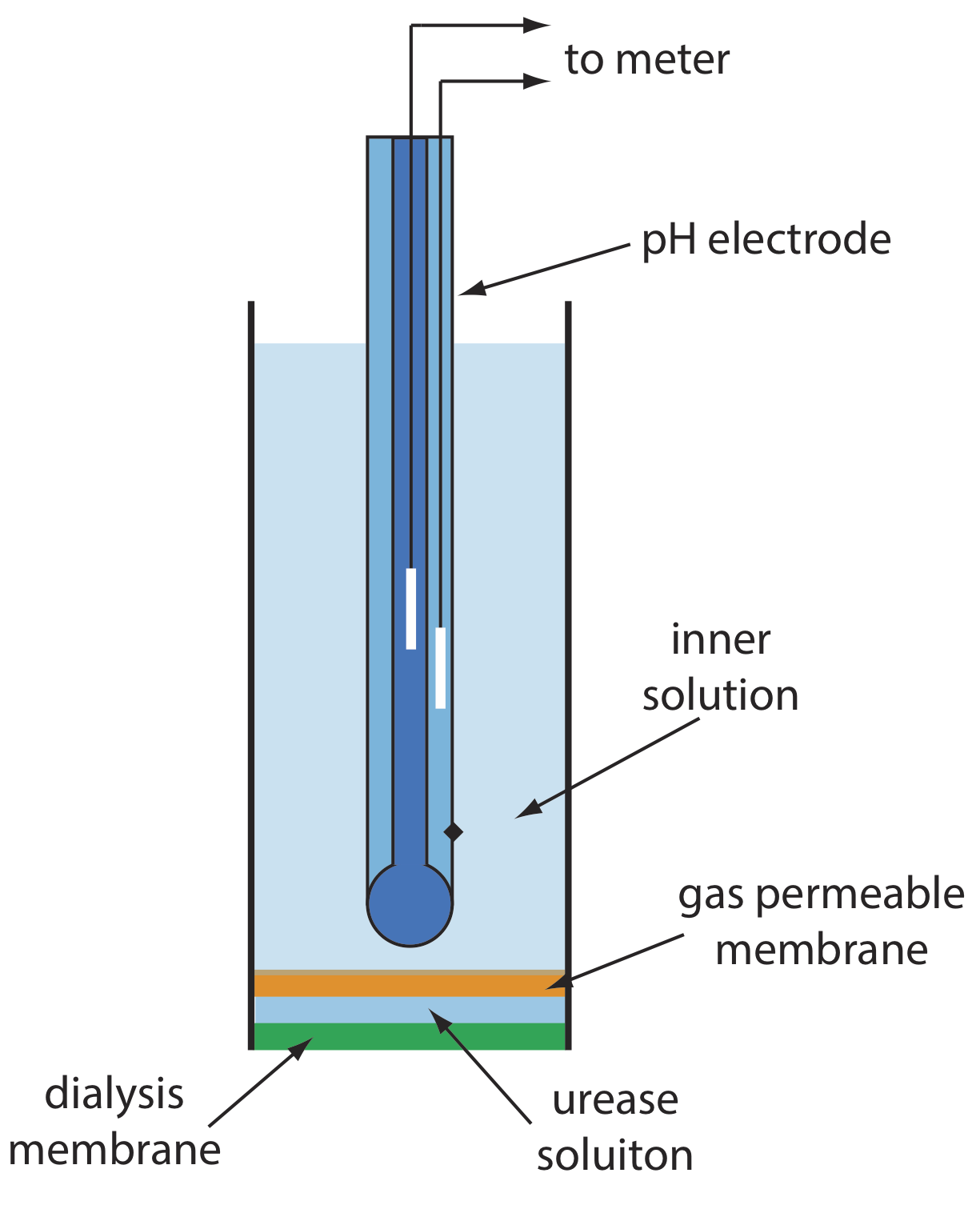
При зануренні в зразок сечовина дифузіруется через діалізну мембрану, де вона реагує з ферментом уреазою з утворенням іона амонію\(\text{NH}_4^+\), який знаходиться в рівновазі з NH 3.
\[\mathrm{NH}_{4}^{+}(a q)+\mathrm{H}_{2} \mathrm{O}(l ) \rightleftharpoons \text{ H}_{3} \mathrm{O}^{+}(a q)+\text{ NH}_{3}(a q) \nonumber\]
NH 3, в свою чергу, дифундує через газопроникну мембрану, де електрод рН вимірює результуючу зміну рН. Реакція електрода на концентрацію сечовини є
\[E_{\text {cell }}=K-0.05916 \log a_{\text {urea }} \label{11.12}\]
Інший варіант електрода сечовини (рис. Template:index) іммобілізує фермент уреазу в полімерній мембрані, утвореної безпосередньо на кінчику скляного pH-електрода [Tor, R.; Freeman, A. Anal. Хім. 1986, 58, 1042—1046]. У цьому випадку реакція електрода дорівнює
\[\mathrm{pH}=K a_{\mathrm{urea}} \label{11.13}\]
Мало потенціометричних біосенсорів доступні у продажу. Як показано на рисунку Template:index} та рисунку Template:index}, однак можна перетворити іоноселективний електрод або газочутливий електрод в біосенсор. Кілька репрезентативних прикладів описано в таблиці Template:index, а додаткові приклади можна знайти в додаткових ресурсах цього розділу.
| аналіт | біологічно активна фаза | речовина визначається |
|---|---|---|
| \(5^{\prime}\)-ПІДСИЛЮВАЧ | AMP-деаміназа (Е) | NH 3 |
| L-аргінін | аргінін і уреаза (Е) | NH 3 |
| аспарагін | аспарагиназа (Е) | \(\text{NH}_4^+\) |
| L-цистеїн | Протей органічний (B) | Н 2 С |
| L-глутамат | жовтий сквош (Т) | СО 2 |
| L-глютамин | Сарцина флава (B) | NH 3 |
| оксалат | оксалатна декарбоксилаза (Е) | СО 2 |
| пеніцилін | пенікліназа (Е) | Н 3 О + |
| L-фенілаланін | L-амінокислотна оксидаза/пероксидаза хрону (Е) | Я — |
| цукри | бактерії з зубного нальоту (B) | Н 3 О + |
| сечовина | уреаза (Е) | NH 3 або Н 3 О + |
|
Джерело: Підписано від Cammann, K. робота з іонно-селективними електродами, Springer-Verlag: Берлін, 1977 і Lunte, C. E.; Heineman, W.R. «Електрохімічні методи в біоаналізі», в Steckham, E. Теми сучасної хімії, Том 143, Спрінгер-Верлаг: Берлін, 1988, с.8. Скорочення біологічно активної фази: Е = фермент; B = бактеріальна частинка; T = тканина. |
||
Кількісні програми
Потенціометричне визначення концентрації аналіту є одним з найбільш поширених кількісних аналітичних методів. Мабуть, найбільш частим аналітичним виміром є визначення рН розчину, вимірювання ми розглянемо докладніше далі в цьому розділі. Інші сфери, де потенціометрія важлива, - це клінічна хімія, хімія навколишнього середовища та потенціометричні титрування. Однак, перш ніж розглядати репрезентативні програми, нам потрібно більш уважно вивчити взаємозв'язок між потенціалом клітини та концентрацією аналіта та методи стандартизації потенціометричних вимірювань.
Активність і концентрація
Рівняння Нернста пов'язує потенціал клітини з активністю аналіта. Наприклад, рівняння Нернста для металевого електрода першого роду
\[E_{\mathrm{cll}}=K+\frac{0.05916}{n} \log a_{M^{n+}} \label{11.14}\]
де M n + - активність іона металу. Однак, коли ми використовуємо потенціометричний електрод, нашою метою є визначення концентрації аналіта. Як ми дізналися в главі 6, активність іона є добутком його концентрації, [M n +] та коефіцієнта активності, залежного від матриці,\(\gamma_{Mn^{n+}}\).
\[a_{M^{n+}}=\left[M^{n+}\right] \gamma_{M^{n+}} \label{11.15}\]
Підставляючи рівняння\ ref {11.15} в рівняння\ ref {11.14} і переставляючи, дає
Ми можемо розв'язати рівняння\ ref {11.16} для концентрації іонів металу, якщо ми знаємо значення його коефіцієнта активності. На жаль, якщо ми не знаємо точного іонного складу матриці зразка - що є звичайною ситуацією, то ми не можемо обчислити значення\(\gamma_{Mn^{n+}}\). Вирішення цієї дилеми є. Якщо ми спроектуємо нашу систему так, щоб стандарти і зразки мали однакову матрицю, то значення\(\gamma_{Mn^{n+}}\) залишається постійним і Equation\ ref {11.16} спрощує
\[E_{\mathrm{cell}}=K^{\prime}+\frac{0.05916}{n} \log \left[M^{n+}\right] \nonumber\]
де\(K^{\prime}\) включає коефіцієнт активності.
Кількісний аналіз з використанням зовнішніх стандартів
Перш ніж ми зможемо визначити концентрацію аналіту в зразку, ми повинні стандартизувати електрод. Якщо реакція електрода підпорядковується рівнянню Нернста, то ми можемо визначити постійну K за допомогою єдиного зовнішнього стандарту. Оскільки невелике відхилення від ідеального нахилу ± RT/nF або ± RT/zF не є несподіваним, ми зазвичай використовуємо два або більше зовнішніх стандартів.
Щоб переглянути використання зовнішніх стандартів, див. Розділ 5.3.
За відсутності перешкод калібрувальна крива комірки E проти журналу A, де A - аналіт, є прямою лінією. Однак графік E клітини проти журналу [A] може показувати кривизну при більш високих концентраціях аналіту в результаті матрично-залежної зміни коефіцієнта активності аналіта. Для підтримки узгодженої матриці ми додаємо високу концентрацію інертного електроліту до всіх зразків і стандартів. Якщо концентрація доданого електроліту достатня, то різниця між матрицею зразка і матрицею стандартів не вплине на іонну міцність і коефіцієнт активності по суті залишається постійним. Інертний електроліт, доданий до зразка і стандартів, називається загальним буфером регулювання іонної сили (TISAB).
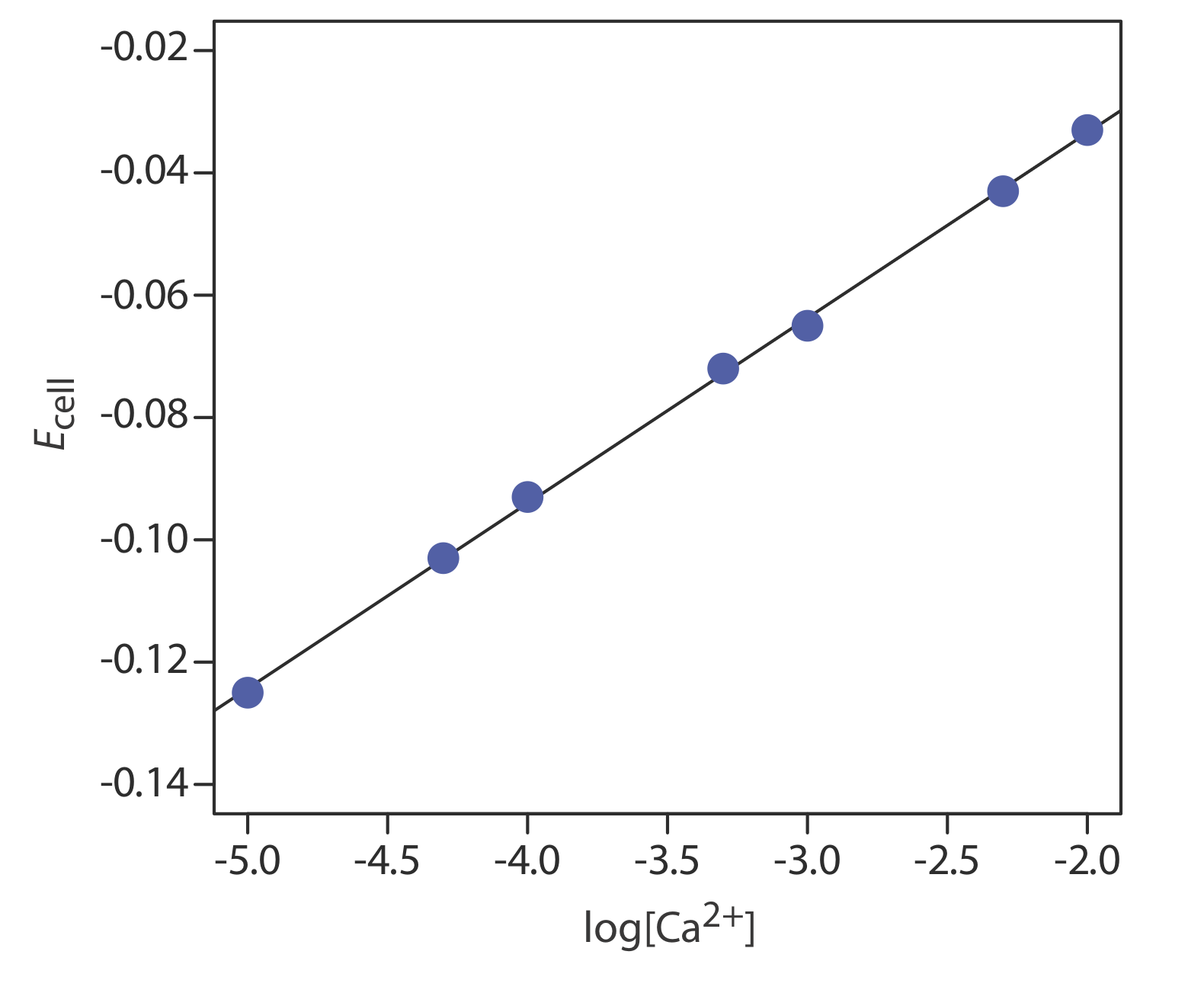
Концентрація Са 2+ в пробі води визначається методом зовнішніх стандартів. Іонна міцність зразків і стандартів підтримується на майже постійному рівні шляхом внесення кожного розчину 0,5 М в КНО 3. Виміряні потенціали клітин для зовнішніх стандартів наведені в наступній таблиці.
| [Са 2+] (М) | E клітина (V) |
|---|---|
|
\(1.00 \times 10^{-5}\) |
—0,125 |
| \(5.00 \times 10^{-5}\) | —0.103 |
| \(1.00 \times 10^{-4}\) | —0,093 |
| \(5.00 \times 10^{-4}\) | —0,072 |
| \(1.00 \times 10^{-3}\) | —0,063 |
| \(5.00 \times 10^{-3}\) | —0.043 |
| \(1.00 \times 10^{-2}\) | -0.033 |
Яка концентрація Са 2+ у зразку води, якщо виявлено, що його клітинний потенціал становить —0,084 В?
Рішення
Лінійна регресія дає калібрувальну криву на рисунку Template:index, з рівнянням
\[E_{\mathrm{cell}}=0.027+0.0303 \log \left[\mathrm{Ca}^{2+}\right] \nonumber\]
Підстановка потенціалу клітини зразка дає концентрацію Са 2 + як\(2.17 \times 10^{-4}\) М. Зверніть увагу, що нахил калібрувальної кривої, який становить 0,0303, трохи більше його ідеального значення 0,05916/2 = 0,02958; це не є незвичайним і є однією з причин використання декількох стандартів.
Однією з причин того, що незвично виявити, що експериментальний схил відхиляється від ідеального значення 0,05916/ п, полягає в тому, що це ідеальне значення передбачає, що температура становить 25° C.
Кількісний аналіз за допомогою методу стандартних доповнень
Ще одним підходом до калібрування потенціометричного електрода є метод стандартних доповнень. Спочатку переносимо пробу з об'ємом V samp і аналітичної концентрацією С samp в склянку і вимірюємо потенціал, (Е осередок) samp. Далі ми робимо стандартне додавання, додавши до зразка невеликий об'єм, V std, стандарту, який містить відому концентрацію аналіту, C std, і вимірюємо потенціал, (E клітина) std. Якщо V std значно менше V samp, то можна сміливо ігнорувати зміну матриці зразка і припустити, що коефіцієнт активності аналіта постійний. Приклад Template:index демонструє, як ми можемо використовувати одноточкове стандартне додавання для визначення концентрації аналіту у зразку.
Щоб переглянути спосіб стандартних доповнень, див. Розділ 5.3.
Концентрацію Са 2+ в пробі морської води визначають за допомогою іоноселективного електрода Са і одноточкового стандартного додавання. Пробу об'ємом 10,00 мл переносять в об'ємну колбу об'ємом 100 мл і розводять до об'єму. Аліквоту зразка об'ємом 50,00 мл поміщають у склянку з Ca ISE і опорним електродом, а потенціал вимірюють як -0,05290 В. Після додавання 1,00-мл аліквота\(5.00 \times 10^{-2}\) M стандартного розчину Ca 2 + потенціал становить —0,04417 В. Яка концентрація Са 2 + в пробі морської води?
Рішення
Для початку запишемо рівняння Нернста до і після додавання стандартного додавання. Потенціал клітини для зразка
\[\left(E_{\mathrm{cell}}\right)_{\mathrm{samp}}=K+\frac{0.05916}{2} \log C_{\mathrm{samp}} \nonumber\]
і що після стандартного доповнення
\[\left(E_{\mathrm{cell}}\right)_{\mathrm{std}}=K+\frac{0.05916}{2} \log \left\{ \frac {V_\text{samp}} {V_\text{tot}}C_\text{samp} + \frac {V_\text{std}} {V_\text{tot}}C_\text{std} \right\} \nonumber\]
де V tot - загальний обсяг (V samp + V std) після стандартного додавання. Віднімання першого рівняння з другого рівняння дає
\[\Delta E = \left(E_{\mathrm{cell}}\right)_{\mathrm{std}} - \left(E_{\mathrm{cell}}\right)_{\mathrm{samp}} = \frac{0.05916}{2} \log \left\{ \frac {V_\text{samp}} {V_\text{tot}}C_\text{samp} + \frac {V_\text{std}} {V_\text{tot}}C_\text{std} \right\} - \frac{0.05916}{2}\log C_\text{samp} \nonumber\]
Перестановка цього рівняння залишає нас
\[\frac{2 \Delta E_{cell}}{0.05916} = \log \left\{ \frac {V_\text{samp}} {V_\text{tot}} + \frac {V_\text{std}C_\text{std}} {V_\text{tot}C_\text{samp}} \right\} \nonumber\]
Підставляючи відомі значення для\(\Delta E\), V samp, V std, V tot і C std,
\[\begin{array}{l}{\frac{2 \times\{-0.04417-(-0.05290)\}}{0.05916}=} \\ {\log \left\{\frac{50.00 \text{ mL}}{51.00 \text{ mL}}+\frac{(1.00 \text{ mL})\left(5.00 \times 10^{-2} \mathrm{M}\right)}{(51.00 \text{ mL}) C_{\mathrm{samp}}}\right\}} \\ {0.2951=\log \left\{0.9804+\frac{9.804 \times 10^{-4}}{C_{\mathrm{samp}}}\right\}}\end{array} \nonumber\]
і взяття зворотного журналу обох сторін дає
\[1.973=0.9804+\frac{9.804 \times 10^{-4}}{C_{\text {samp }}} \nonumber\]
Нарешті, рішення для C samp дає концентрацію Са 2 + як\(9.88 \times 10^{-4}\) М. Оскільки ми розбавили вихідну пробу морської води в 10 разів, концентрація Са 2 + в зразку морської води становить\(9.88 \times 10^{-3}\) M.
Вільні іони проти комплексних іонів
Більшість потенціометричних електродів є селективними до вільної, некомплексної форми аналіту і не реагують ні на одну з складних форм аналіту. Така селективність забезпечує потенціометричним електродам значну перевагу перед іншими кількісними методами аналізу, якщо нам потрібно визначити концентрацію вільних іонів. Наприклад, кальцій присутній в сечі як у вигляді вільних іонів Ca 2+, так і у вигляді зв'язаних з білками іонів Ca 2+. Якщо ми аналізуємо зразок сечі за допомогою атомно-абсорбційної спектроскопії, сигнал є пропорційним загальній концентрації Са 2+, оскільки розпилюються як вільний, так і зв'язаний кальцій. Аналіз сечі за допомогою Ca 2+ ISE, однак, дає сигнал, який є функцією тільки вільних іонів Ca 2+, оскільки зв'язаний білком Ca 2+ не може взаємодіяти з мембраною електрода.
Найкращий спосіб оцінити теоретичні та практичні деталі, розглянуті в цьому розділі, - це уважно вивчити типовий аналітичний метод. Хоча кожен метод унікальний, наступний опис визначення F — в зубній пасті дає повчальний приклад типової процедури. Опис тут базується на Кеннеді, J. H. Аналітична хімія - практика, Харкорт Брейс Яованович: Сан-Дієго, 1984, стор. 117—118.
Представницький метод 11.2.1: Визначення фтору в зубній пасті
Опис методу
Концентрацію фтору в зубних пастах, що містять розчинний F — визначають за допомогою F — іоноселективного електрода за допомогою калібрувальної кривої, підготовленої за зовнішніми стандартами. Хоча F - ISE є дуже селективним (тільки OH - з K F - /OH - 0.1 є значним інтерферентом), Fe 3 + і Al 3 + втручаються в аналіз, оскільки вони утворюють розчинні фторидні комплекси, які не взаємодіють з мембраною іоноселективного електрода. Ця перешкода зводиться до мінімуму, реагуючи на будь-які Fe 3 + та Al 3 + з відповідним комплексоутворюючим агентом.
Порядок дій
Приготуйте 1 л стандартного розчину 1,00% в/в SnF 2 і перекладіть його в пластикову пляшку для зберігання. Використовуючи цей розчин, готують по 100 мл кожного зі стандартів, які містять 0,32%, 0,36%, 0,40%, 0,44% і 0,48% в/в SnF 2, додаючи в кожен розчин 400 мг яблучної кислоти в якості стабілізатора. Перенесіть стандарти на пластикові пляшки для зберігання. Приготуйте загальний буфер для регулювання іонної сили (TISAB), змішавши 500 мл води, 57 мл льодовикової оцтової кислоти, 58 г NaCl і 4 г динатрію DCTA (транс-1,2-циклогексантетраоцтової кислоти) в склянці 1 л, перемішуючи до розчинення. Охолодіть склянку на водяній бані і додайте 5 М NaOH, поки рН не буде між 5-5,5. Перекладіть вміст мензурки в об'ємну колбу об'ємом 1 л і розбавте до обсягу. Підготуйте кожен зовнішній стандарт, помістивши приблизно 1 г зубної пасти без фтору, 30 мл дистильованої води та 1,00 мл стандартної в пластикову склянку 50 мл і енергійно перемішайте протягом двох хвилин з розмішуванням. Кількісно перекладіть отриману суспензію в об'ємну колбу об'ємом об'ємом 100 мл разом з 50 мл TISAB і розбавте до обсягу дистильованою водою. Зберігайте весь зовнішній стандарт у пластиковій склянці об'ємом 250 мл, поки не будете готові виміряти потенціал. Приготуйте зразки зубної пасти, отримавши приблизно 1-г порцію і обробляючи так само, як і стандарти. Виміряйте потенціал осередку для зовнішніх стандартів та зразків за допомогою F - іоноселективного електрода та відповідного опорного електрода. Вимірюючи потенціал, перемішайте розчин і дайте дві-три хвилини досягти стабільного потенціалу. Повідомити про концентрацію F — в зубній пасті %w/w SnF 2.
Питання
1. Загальний буфер регулювання іонної сили служить декільком цілям цієї процедури. Визначте ці цілі.
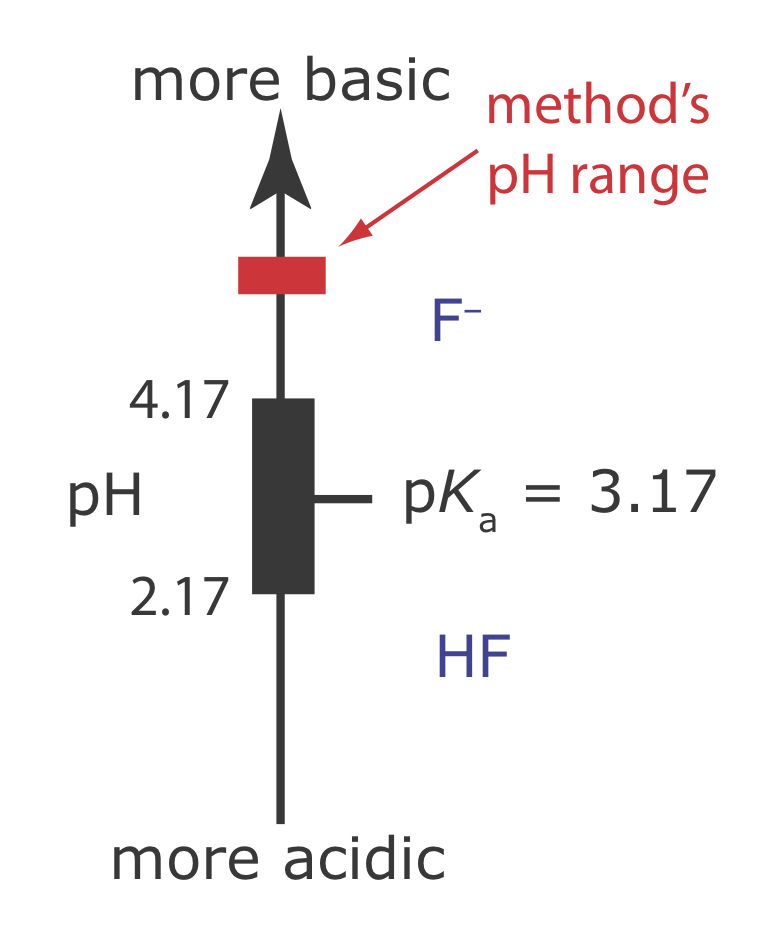
Склад TISAB має три призначення:
(а) Висока концентрація NaCl (кінцеві розчини приблизно 1 М NaCl) гарантує, що іонна сила кожного зовнішнього стандарту і кожного зразка по суті ідентична. Оскільки коефіцієнт активності для фтору однаковий у всіх розчинях, ми можемо записати рівняння Нернста через концентрацію фтору замість його активності.
(б) Поєднання льодовикової оцтової кислоти та NaOH створює буфер оцтової кислоти/ацетату рН 5-5,5. Як показано на малюнку Template:index, рН цього буфера досить високий, щоб гарантувати, що переважною формою фториду є F - замість HF. Цей рН також є досить кислим, щоб уникнути перешкод від OH - (див. Приклад\(\PageIndex{8)}\)).
(c) DCTA додається як комплексоутворювач для Fe 3 + або Al 3 +, запобігаючи утворенню\(\text{FeF}_6^{3-}\) або\(\text{AlF}_6^{3-}\).
2. Чому до стандартних розчинів додають зубну пасту без фтору?
Додавання зубної пасти без фтору захищає від будь-яких неврахованих матричних ефектів, які можуть вплинути на реакцію іонселективного електрода. Це передбачає, звичайно, що матриці двох зубних паст інакше схожі.
3. У процедурі вказано, що нормативи і зразок повинні зберігатися в пластиковій тарі. Чому погана ідея зберігати розчини в скляній тарі?
Іон фтору здатний вступати в реакцію зі склом з утворенням SiF 4.
4. Припустимо, ваша калібрувальна крива має нахил —57,98 мВ для кожної 10-кратної зміни концентрації F —. Ідеальний нахил з рівняння Нернста - 59,16 мВ за 10-кратну зміну концентрації. Який вплив це робить на кількісний аналіз фтору в зубній пасті?
Ніякого ефекту взагалі! Ось чому ми готуємо калібрувальну криву, використовуючи кілька стандартів.
Вимірювання рН
При наявності недорогих скляних рН-електродів і рН-метрів визначення рН є одним з найбільш поширених кількісних аналітичних вимірювань. Потенціометричне визначення рН, однак, не позбавлене ускладнень, деякі з яких ми обговоримо в цьому розділі.
Одним з ускладнень є плутанина щодо значення рН [Крістенсен, Х.Б.; Саломан, А.; Kokholm, Г. Anal. Хім. 1991, 63, 885—891А]. Умовне визначення рН у більшості загальних підручників з хімії
\[\mathrm{pH}=-\log \left[\mathrm{H}^{+}\right] \label{11.17}\]
Як ми тепер знаємо, рН насправді є мірою активності Н +.
\[\mathrm{pH}=-\log a_{\mathrm{H}^{+}} \label{11.18}\]
Спробуйте цей експеримент - знайдіть кілька загальних підручників з хімії та знайдіть рН в індексі кожного підручника. Зверніться до відповідних сторінок і подивіться, як це визначено. Далі перегляньте коефіцієнт активності або активності в індексі кожного підручника та перевірте, чи індексуються ці терміни.
Рівняння\ ref {11.17} лише наближає істинний рН. Якщо обчислити рН 0,1 М HCl за допомогою рівняння\ ref {11.17}, то отримаємо значення 1,00; фактичний рН розчину, як визначено рівнянням\ ref {11.18}, дорівнює 1,1 [Hawkes, SJ J. Chem. Едук. 1994, 71, 747—749]. Активність і концентрація Н + не однакові в 0,1 М HCl, оскільки коефіцієнт активності для Н + не дорівнює 1,00 в цій матриці. Рисунок Template:index показує більш барвисту демонстрацію різниці між активністю та концентрацією.

Другим ускладненням при вимірюванні рН є невизначеність у взаємозв'язку між потенціалом і активністю. Для електрода скляної мембрани потенціал клітини, (E клітина) samp, для зразка невідомого рН становить
де К включає потенціал опорного електрода, потенціал асиметрії скляної мембрани і будь-які потенціали переходу в електрохімічній комірці. Всі внески до К схильні до невизначеності, і можуть змінюватися з кожним днем, а також від електрода до електрода. З цієї причини перед використанням pH-електрода ми калібруємо його за допомогою стандартного буфера відомого рН. Потенціал клітини для стандартної, (E клітини) std, є
де pH std є стандартним рН. Віднімання рівняння\ ref {11.20} з рівняння\ ref {11.19} і розв'язування для pH samp дає
яке є оперативним визначенням рН, прийнятим Міжнародним союзом чистої та прикладної хімії [Ковінгтон, А.К.; Бейтс, Р.Б.; Durst, R.A. Pure & Appl. Хім. 1985, 57, 531—542].
Калібрування електрода pH представляє третє ускладнення, оскільки нам потрібен стандарт з точно відомою активністю для H +. Таблиця Template:index містить значення рН для декількох первинних стандартних буферних розчинів, прийнятих Національним інститутом стандартів і технологій.
| температура (o C) |
насичений (при 25 о С) КХК 4 Н4О 7 (тартрат) |
0,05 мм КН 2 С 6 Н 5 О 7 (цитрат) |
0,05 мм КХК 8 Н 4 О 4 (фталат) | 0,025 м КХ 2 ПО 4, 0,025 м НаХПО 4 | 0.008695 м КН 2 ПО 4, 0.03043 м На 2 ГПО 4 | 0,01 м На 4 Б 4 О 7 | 0,025 м НаГСО 3, 0.025 м Na 2 СО 3 |
|---|---|---|---|---|---|---|---|
| 0 | — | 3.863 | 4.003 | 6.984 | 7.534 | 9.464 | 10.317 |
| 5 |
— |
3.840 | 3.999 | 6.951 | 7.500 | 9.395 | 10.245 |
| 10 | — | 3.820 | 3.998 | 6.923 | 7.472 | 9.332 | 10.179 |
| 15 | — | 3.802 | 3.999 | 6.900 | 7.448 | 9.276 | 10.118 |
| 20 | — | 3.788 | 4.002 | 6.881 | 7.429 | 9.225 | 10.062 |
| 25 | 3.57 | 3.776 | 4.008 | 6.865 | 7.413 | 9.180 | 10.012 |
| 30 | 3.552 | 3.766 | 4.015 | 6.854 | 7.400 | 9.139 | 9.966 |
| 35 | 3.549 | 3.759 | 4.024 | 6.844 | 7.389 | 9.012 | 9.925 |
| 40 | 3.547 | 3.753 | 4.035 | 6.838 | 7.380 | 9.068 | 9.889 |
| 45 | 3.547 | 3.750 | 4.047 | 6.834 | 7.373 | 9.038 | 9.856 |
| 50 | 3.549 | 3.749 | 4.060 | 6.833 | 7.367 | 9.011 | 9.828 |
|
Джерело: Значення взяті з Бейтса, Р.Г. Визначення рН: теорія і практика, 2-е изд. Уайлі: Нью-Йорк, 1973. Див. також Бак, Р.П., та ін. «Вимірювання рН. Визначення, стандарти та процедури» Чистий. Застосовувати. Хім. 2002, 74, 2169—200. Всі концентрації моляль (м). |
|||||||
Щоб стандартизувати електрод pH за допомогою двох буферів, виберіть один поблизу рН 7 і один, який є більш кислим або основним, залежно від очікуваного рН вашого зразка. Промийте електрод pH в деіонізованій воді, промокніть його насухо лабораторною серветкою і помістіть його в буфер з рН, найближчим до 7. Закрутіть pH-електрод і дайте йому врівноважитися, поки не отримаєте стабільне показання. Відрегулюйте ручку «Стандартизувати» або «Калібрувати», поки лічильник не відобразить правильний рН. Промийте і висушіть електрод, а також помістіть його в другий буфер. Після того, як електрод вирівняється, відрегулюйте регулятор «Нахил» або «Температура», поки лічильник не покаже правильний рН.
Деякі рН-метри можуть компенсувати зміну температури. Щоб скористатися цією функцією, помістіть в зразок температурний зонд і підключіть його до рН-метра. Налаштуйте регулятор «Температура» відповідно до температури розчину та відкалібруйте рН-метр за допомогою елементів керування «Калібрувати» та «Нахил». Коли ви використовуєте електрод рН, рН-метр компенсує будь-яку зміну температури зразка, регулюючи нахил калібрувальної кривої за допомогою реакції Нернстіана 2,303 RT/F.
Клінічні програми
Через свою селективність для аналітів у складних матрицях іоноселективні електроди є важливими датчиками для клінічних зразків. Найпоширенішими аналітами є електроліти, такі як Na +, K +, Ca 2+, H + та Cl - та розчинені гази, такі як CO 2. Для позаклітинних рідин, таких як кров і сеча, аналіз може бути зроблений in vitro. Однак аналіз in situ вимагає набагато меншого електрода, який ми можемо вставити безпосередньо в комірку. Мембранні мікроелектроди на рідкій основі з діаметром наконечників менше 1 мкм побудовані шляхом нагрівання і витягування жорсткої скляної капілярної трубки початковим діаметром приблизно 1-2 мм (рис. Template:index). Наконечник мікроелектрода виготовляється гідрофобним зануренням у розчин дихлордиметилсилану, а внутрішній розчин, відповідний для аналіту та опорний електрод дроту Ag/AgCl, розміщені всередині мікроелектрода. Мікроелектрод занурюють в розчин рідкого комплексообразователя, який за допомогою капілярної дії втягує в наконечник невеликий обсяг рідкого комплексообразователя. Потенціометричні мікроелектроди розроблені для ряду клінічно важливих аналітів, включаючи H +, K +, Na +, Ca 2+, Cl — та I — [Bakker, E.; Pretsch, E. Trends Anal. Хім. 2008, 27, 612—618].
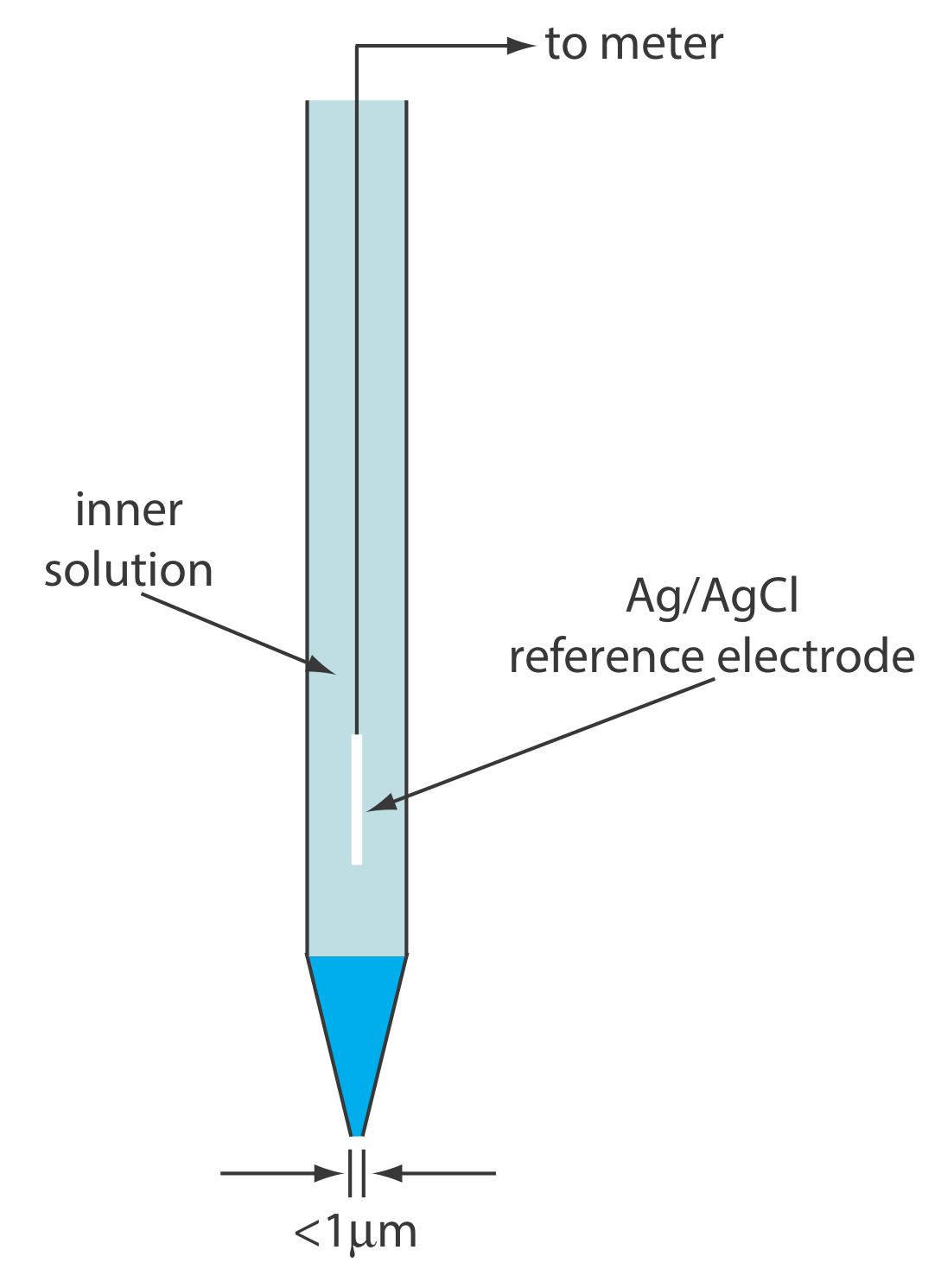
Екологічні програми
Хоча іоноселективні електроди використовуються в екологічному аналізі, їх застосування не так широко, як при клінічному аналізі. Хоча стандартні потенціометричні методи доступні для аналізу CN -, F -, NH 3, а також\(\text{NO}_3^-\) у воді та стічних водах, інші аналітичні методи, як правило, забезпечують кращі межі виявлення. Однією з потенційних переваг іонселективного електрода є можливість включення його в проточну комірку для постійного моніторингу потоків стічних вод.
Потенціометричні титрування
Одним із методів визначення точки еквівалентності кислотно-основного титрування є використання pH-електрода для контролю зміни рН під час титрування. Потенціометричне визначення точки еквівалентності можливе для кислотно-основного, комплексоутворення, окислювально-відновного та осаджувального титрування, а також для титрування у водних і неводних розчинниках. Потенціометричні титрування кислотно-основи, комплексоутворення та осадження зазвичай контролюються іоноселективним електродом, який реагує на аналіт, хоча також може бути використаний електрод, який реагує на титрант або продукт реакції. Окислювально-відновний електрод, такий як дріт Pt, і опорний електрод використовуються для потенціометричних окислювально-відновних титрувань. Детальніше про потенціометричні титрування наведено в Главі 9.
Оцінка
Масштаб операції
Робочий діапазон для більшості іоноселективних електродів становить від максимальної концентрації 0,1—1 М до мінімальної концентрації\(10^{-5}-10^{-11}\) M [(a) Bakker, E.; Pretsch, E. Хім. 2002, 74, 420A-426A; (б) Баккер, Е.; Преч, Е. Тренди Анальний. Хім. 2005, 24, 199—207]. Цей широкий робочий діапазон поширюється від основних аналітів до ультратрасових аналітів і значно більший, ніж багато інших аналітичних методів. Для використання звичайного іоноселективного електрода нам потрібен мінімальний обсяг проби в кілька мл (макропроба). Мікроелектроди, такі як показано на малюнку Template:index, використовуються з ультрамікро зразком, хоча необхідна обережність, щоб переконатися, що зразок є репрезентативним для вихідного зразка.
Точність
Точність потенціометричного аналізу обмежена похибкою вимірювання E комірки. Кілька факторів сприяють цій похибці вимірювання, включаючи внесок у потенціал від інтерференційних іонів, скінченний струм, який проходить через комірку, поки ми вимірюємо потенціал, відмінності між коефіцієнтом активності аналіта у зразках та стандартних розчинами, і перехід потенціали. Ми можемо обмежити ефект інтерференційного іона, включивши крок поділу перед потенціометричним аналізом. Сучасні потенціометри високого імпедансу мінімізують кількість струму, який проходить через електрохімічну комірку. Нарешті, ми можемо мінімізувати похибки через коефіцієнти активності та потенціали переходу шляхом зіставлення матриці стандартів до матриці зразка. Однак навіть за найкращих обставин різниця приблизно ± 1 мВ для зразків з однаковою концентрацією аналіту не є незвичайною.
Оцінити вплив невизначеності на точність потенціометричного вимірювання можна за допомогою поширення невизначеності. Для мембранного іоноселективного електрода загальне вираження потенціалу
\[E_{\mathrm{cell}}=K+\frac{R T}{z F} \ln \left[ A\right] \nonumber\]
де z - аналітик, А, заряд. З таблиці 4.3.1 в главі 4 невизначеність потенціалу клітини\(\Delta E_\text{cell}\) становить
\[\triangle E_{\text {cell}}=\frac{R T}{z F} \times \frac{\Delta [A]}{[A]} \nonumber\]
Перестановка і множення через 100 дає відсоток відносної похибки концентрації як
Відносна похибка концентрації, отже, є функцією похибки вимірювання потенціалу\(\Delta E_\text{cell}\) електрода та заряду аналіта. У таблиці Template:index наведено репрезентативні значення для іонів із зарядами ±1 і ±2 при температурі 25 o С. Типові точності 1-5% для одновалентних іонів і 2-10% для двовалентних іонів. Хоча Equation\ ref {11.22} застосовується до мембранних електродів, ми можемо використовувати if для металевого електрода шляхом заміни z на n.
| \(\Delta E_\text{cell} (\pm \text{ mV})\) | % відносної похибки при\(z = \pm 1\) | % відносної похибки при\(z = \pm 2\) |
|---|---|---|
| \ (\ Дельта Е_\ текст {комірка} (\ pm\ text {mV})\) ">0.1 | \ (z =\ пм 1\) ">\(\pm 0.4\) | \ (z =\ пм 2\) ">\(\pm 0.8\) |
| \ (\ Дельта Е_\ текст {комірка} (\ pm\ text {mV})\) ">0.5 | \ (z =\ пм 1\) ">\(\pm 1.9\) | \ (z =\ пм 2\) ">\(\pm 3.9\) |
| \ (\ Дельта Е_\ текст {комірка} (\ pm\ text {mV})\) ">1.0 | \ (z =\ пм 1\) ">\(\pm 3.0\) | \ (z =\ пм 2\) ">\(\pm 7.8\) |
| \ (\ Дельта Е_\ текст {комірка} (\ pm\ text {mV})\) ">1.5 | \ (z =\ пм 1\) ">\(\pm 5.8\) | \ (z =\ пм 2\) ">\(\pm 11.1\) |
| \ (\ Дельта Е_\ текст {комірка} (\ pm\ text {mV})\) ">2.0 | \ (z =\ пм 1\) ">\(\pm 7.8\) | \ (z =\ пм 2\) ">\(\pm 15.6\) |
Точність
Точність в потенціометрії обмежена коливаннями температури і чутливості потенціометра. За більшості умов - і при використанні простого потенціометра загального призначення - ми можемо виміряти потенціал з повторюваністю ± 0,1 мВ. Використовуючи таблицю Template:index, це відповідає невизначеності ± 0,4% для одновалентних аналітів і ± 0,8% для двовалентних аналітів. Відтворюваність потенціометричних вимірювань приблизно в десять разів бідніша.
Чутливість
Чутливість потенціометричного аналізу визначається терміном RT/nF або RT/zF в рівнянні Нернста. Чутливість найкраще підходить для менших значень n або z.
Вибірковість
Як описано раніше, більшість іоноселективних електродів реагують на більш ніж один аналіт; селективність для аналіту, однак, часто значно більша, ніж чутливість до інтерференційних іонів. Виробник іон-селективності зазвичай надає коефіцієнти селективності ISE, що дозволяє визначити, чи можливий потенціометричний аналіз для даного зразка.
Час, вартість та обладнання
У порівнянні з іншими методиками потенціометрія забезпечує швидкий, відносно недорогий засіб для аналізу зразків. Обмежуючим фактором при аналізі великої кількості зразків є необхідність промивання електрода між зразками. Використання недорогих одноразових іоноселективних електродів може збільшити пропускну здатність лабораторного зразка. На малюнку Template:index показано один із прикладів одноразового ISE для Ag + [Tymecki, L.; Zwierkowska, E.; Głab, S.; Koncki, R. Sens. приводи B 2003, 96, 482—488]. Комерційні прилади для вимірювання рН або потенціалу доступні в різних цінових діапазонах, і включають портативні моделі для використання в польових умовах.