11.1: Огляд електрохімії
- Page ID
- 24948
Основна увага цієї глави приділяється аналітичним методам, які використовують вимірювання потенціалу, струму або заряду для визначення концентрації аналіта або для характеристики хімічної реакційної здатності аналіта. У сукупності ми називаємо цю область аналітичної хімії електрохімією, оскільки вона виникла в результаті вивчення руху електронів в реакції окислення-відновлення.
Незважаючи на різницю в приладобудуванні, всі електрохімічні техніки мають кілька спільних рис. Перш ніж розглядати окремі приклади більш детально, давайте розглянемо деякі з цих подібностей. Під час роботи над главою цей огляд допоможе вам зосередитися на подібності між різними електрохімічними методами аналізу. Вам буде легше зрозуміти новий аналітичний метод, коли ви зможете побачити його зв'язок з іншими подібними методами.
П'ять важливих концепцій
Щоб зрозуміти електрохімію, нам потрібно оцінити п'ять важливих і взаємопов'язаних понять: (1) потенціал електрода визначає форму аналіту на поверхні електрода; (2) концентрація аналіту на поверхні електрода може бути не такою ж, як його концентрація в об'ємному розчині; (3) в крім реакції окислення - відновлення, аналіт може брати участь в інших хімічних реакціях; (4) струм є мірою швидкості окислення або відновлення аналіту; і (5) ми не можемо контролювати одночасно струм і потенціал.
Матеріал в цьому розділі - особливо п'ять важливих концепцій - спирається на бачення розуміння електрохімії, викладеного Ларрі Фолкнером у статті «Розуміння електрохімії: деякі відмінні поняття,» J. Chem. Едук. 1983, 60, 262—264. Див. Також, Кіссінджер, П.Т.; Ботт, А.В. «Електрохімія для неелектрохіміка», поділ струму, 2002, 20:2, 51—53.
Потенціал електрода визначає форму аналіта
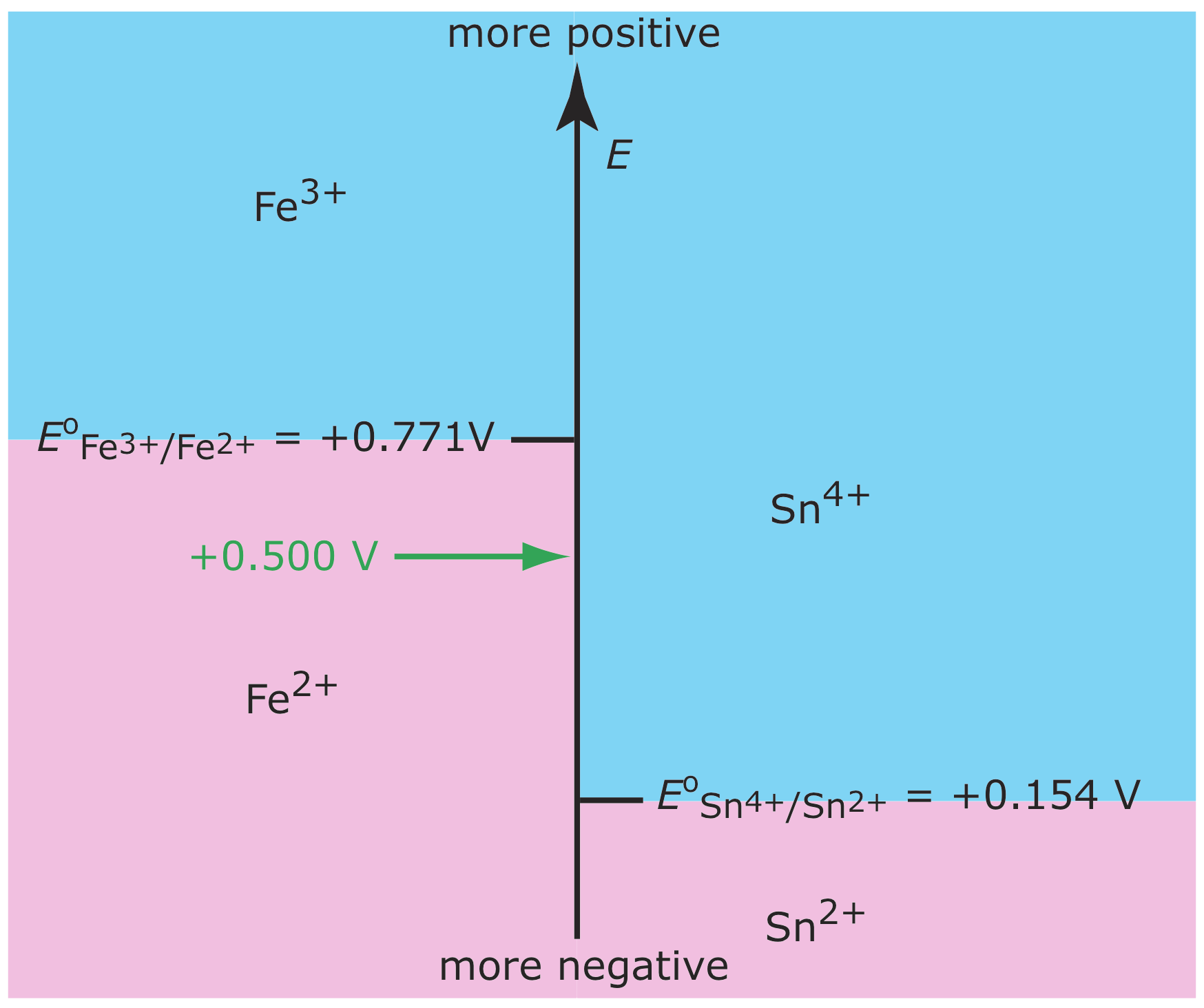
У главі 6 ми ввели діаграму сходів як інструмент для прогнозування того, як зміна умов рішення впливає на положення реакції рівноваги. Наприклад, на малюнку Template:index} показано діаграму сходів для рівноваг Fe 3 +/Fe 2+ та Sn 4+/Sn 2+. Якщо помістити електрод в розчин Fe 3 + і Sn 4 + і відрегулювати його потенціал до +0,500 В, Fe 3 + знижується до Fe 2 +, але Sn 4 + не знижується до Sn 2 +.
Міжфазні концентрації можуть не дорівнювати об'ємним концентраціям
У главі 6 ми ввели рівняння Нернста, яке забезпечує математичну залежність між потенціалом електрода і концентраціями окислених і відновлених форм аналіта в розчині. Наприклад, рівняння Нернста для Fe 3 + і Fe 2 + дорівнює
де Е - потенціал електрода і\(E_{\text{Fe}^{3+}/\text{Fe}^{2+}}^{\circ}\) є потенціалом відновлення в стандартному стані для реакції\(\text{Fe}^{3+}(aq) \rightleftharpoons \text{ Fe}^{2+}(aq) + e^-\). Оскільки саме потенціал електрода визначає форму аналіту на поверхні електрода, термінами концентрації в Рівнянні\ ref {11.1} є термінами концентрації Fe 2 + і Fe 3 + на поверхні електрода, а не їх концентрації в об'ємному розчині.
Ця відмінність між поверхневою концентрацією виду та його основною концентрацією є важливою. Припустимо, ми поміщаємо електрод у розчині Fe 3 + і фіксуємо його потенціал на рівні 1.00 В. з діаграми сходів на рисунку Template:index, ми знаємо, що Fe 3 + стабільний при цьому потенціалі і, як показано на малюнку Template:index a, концентрація Fe 3 + однакова на всіх відстанях від поверхні електрода. Якщо змінити потенціал електрода на +0,500 В, концентрація Fe 3 + на поверхні електрода зменшується приблизно до нуля. Як показано на малюнку Template:index b, концентрація Fe 3 + збільшується, коли ми віддаляємося від поверхні електрода, поки вона не дорівнюватиме концентрації Fe 3 + в насипному розчині. Отриманий градієнт концентрації призводить до дифузії додаткового Fe 3 + з сипучого розчину на поверхню електрода.
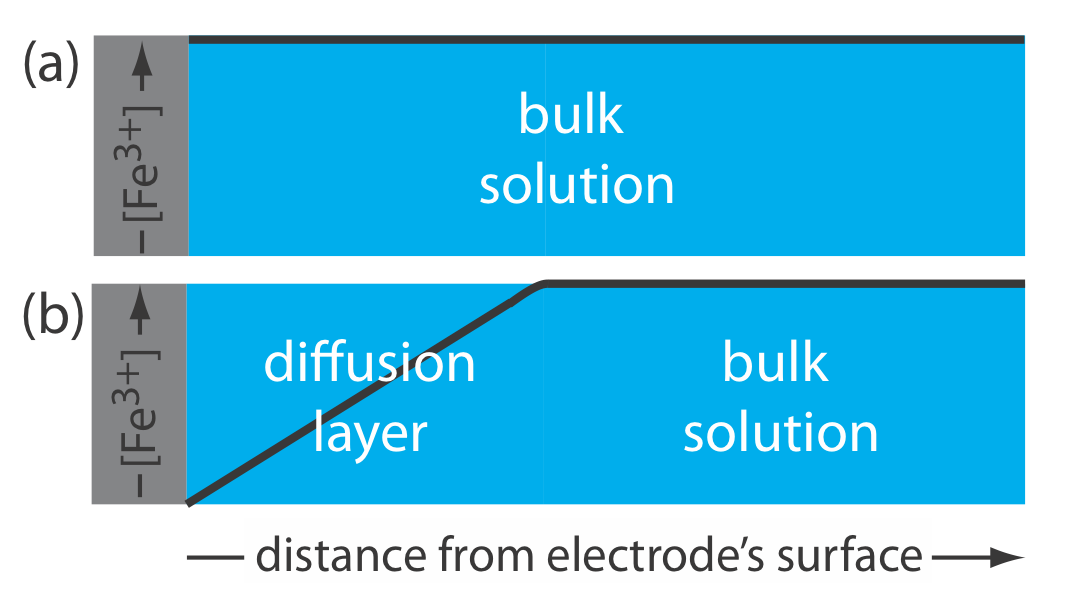
Ділянку розчину, що містить цей градієнт концентрації в Fe 3 +, ми називаємо дифузійним шаром. Про це нам доведеться більше сказати в розділі 11.4.
Аналіт може брати участь в інших реакціях
Рисунок Template:index та Рисунок Template:index показує, як потенціал електрода впливає на концентрацію Fe 3 + і як змінюється концентрація Fe 3 + залежно від відстані від поверхні електрода. Зниження Fe 3 + до Fe 2 +, яке регулюється рівнянням\ ref {11.1}, може бути не єдиною реакцією, яка впливає на концентрацію Fe 3 + в насипному розчині або на поверхні електрода. Адсорбція Fe 3+ на поверхні електрода або утворення комплексу метал—ліганд в об'ємному розчині, такому як Fe (OH) 2+, також впливає на концентрацію Fe 3 +.
Струм - міра ставки
Зниження Fe 3 + до Fe 2 + споживає електрон, який витягується з електрода. Окислення іншого виду, можливо, розчинника, на другому електроді є джерелом цього електрона. Оскільки зменшення Fe 3 + до Fe 2 + споживає один електрон, потік електронів між електродами - іншими словами, струм - є мірою швидкості, з якою Fe 3 + зменшується. Одним з важливих наслідків цього спостереження є те, що струм дорівнює нулю, коли реакція\(\text{Fe}^{3+}(aq) \rightleftharpoons \text{ Fe}^{2+}(aq) + e^-\) знаходиться в рівновазі.
Швидкість реакції\(\text{Fe}^{3+}(aq) \rightleftharpoons \text{ Fe}^{2+}(aq) + e^-\) - зміна концентрації Fe 3 + в залежності від часу.
Ми не можемо контролювати одночасно струм і потенціал
Якщо розв'язок Fe 3 + і Fe 2 + знаходиться в рівновазі, струм дорівнює нулю, а потенціал задається рівнянням\ ref {11.1}. Якщо ми змінимо потенціал від його положення рівноваги, струм тече, коли система рухається до свого нового положення рівноваги. Хоча початковий струм досить великий, з часом він зменшується, досягаючи нуля, коли реакція досягає рівноваги. Отже, струм змінюється у відповідь на застосований потенціал. Як варіант, ми можемо пропускати фіксований струм через електрохімічну комірку, змушуючи зниження Fe 3 + до Fe 2 +. Оскільки концентрації Fe 3 + зменшуються, а концентрація Fe 2 + збільшується, потенціал, заданий Equation\ ref {11.1}, також змінюється з часом. Коротше кажучи, якщо ми вирішимо контролювати потенціал, то ми повинні прийняти отриманий струм, і ми повинні прийняти отриманий потенціал, якщо вирішимо контролювати струм.
Контроль і вимірювання струму і потенціалу
Електрохімічні вимірювання проводяться в електрохімічній комірці, яка складається з двох або більше електродів та електронної схеми, необхідної для контролю та вимірювання струму та потенціалу. У цьому розділі ми представимо основні компоненти електрохімічного приладобудування.
Найпростіша електрохімічна комірка використовує два електроди. Потенціал одного електрода чутливий до концентрації аналіта, і називається робочим електродом або індикаторним електродом. Другий електрод, який ми називаємо зустрічним електродом, завершує електричний ланцюг і забезпечує опорний потенціал, проти якого ми вимірюємо потенціал робочого електрода. В ідеалі потенціал лічильника електрода залишається постійним, щоб ми могли призначити робочому електроду будь-яку зміну загального потенціалу клітини. Якщо потенціал зустрічного електрода не постійний, то замінюємо його двома електродами: опорним електродом, потенціал якого залишається постійним і допоміжний електрод, який завершує електричний ланцюг.
Оскільки ми не можемо одночасно контролювати струм і потенціал, існує лише три основні експериментальні конструкції: (1) ми можемо виміряти потенціал, коли струм дорівнює нулю, (2) ми можемо вимірювати потенціал, контролюючи струм, і (3) ми можемо вимірювати струм, контролюючи потенціал. Кожна з цих експериментальних конструкцій спирається на закон Ома, який стверджує, що струм, i, проходячи через електричний ланцюг опору, R, генерує потенціал, Е.
\[E = i R\nonumber\]
Кожна з цих експериментальних конструкцій використовує інший тип інструменту. Щоб допомогти нам зрозуміти, як ми можемо контролювати і вимірювати струм і потенціал, ми опишемо ці інструменти так, ніби аналітик оперує ними вручну. Для цього аналітик спостерігає за зміною струму або потенціалу і вручну коригує налаштування інструменту для підтримки бажаних експериментальних умов. Важливо розуміти, що сучасні електрохімічні прилади забезпечують автоматизовані електронні засоби контролю та вимірювання струму та потенціалу, і що вони роблять це, використовуючи зовсім інші електронні схеми, ніж описані тут.
Цей момент повторюється: Важливо розуміти, що експериментальні конструкції на рисунках Template:index, Figure Template:index та Figure Template:index не представляють електрохімічні інструменти, які ви знайдете в сучасних аналітичних лабораторіях. Для отримання додаткової інформації про сучасні електрохімічні прилади див. додаткові ресурси цього розділу.
Потенціометри
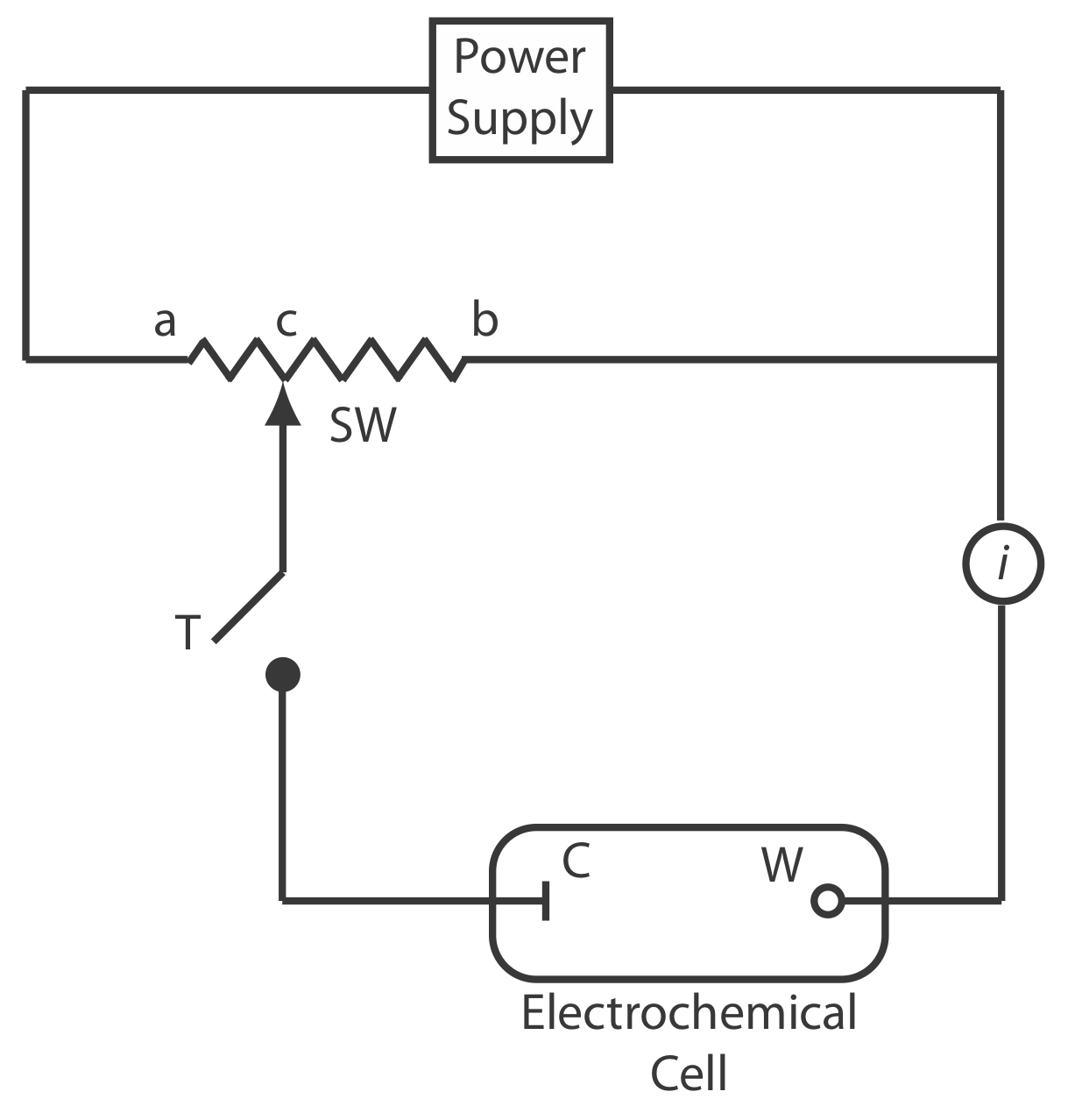
Для вимірювання потенціалу електрохімічного елемента за умови нульового струму використовуємо потенціометр. На малюнку Template:index показана принципова схема ручного потенціометра, що складається з джерела живлення, електрохімічного елемента з робочим електродом і зустрічним електродом, амперметра для вимірювання струму, який проходить через електрохімічну комірку, регульованого резистора з ковзаючим проводом і відвідний ключ для замикання ланцюга через електрохімічну комірку. Використовуючи закон Ома, струм у верхній половині ланцюга дорівнює
\[i_{\text {upper}}=\frac{E_{\mathrm{PS}}}{R_{a b}} \nonumber\]
де E PS - потенціал джерела живлення, а R ab - опір між точками a і b резистора слайд-дроти. Аналогічним чином струм в нижній половині ланцюга дорівнює
\[i_{\text {lower}}=\frac{E_{\text {cell}}}{R_{c b}} \nonumber\]
де Е осередок - різниця потенціалів між робочим електродом і зустрічним електродом, а R cb - опір між точками c і b резистора ковзного дроту. Коли i верхній = i нижній = 0, через амперметр не протікає струм і потенціал електрохімічної осередку дорівнює
\[E_{\mathrm{coll}}=\frac{R_{c b}}{R_{a b}} \times E_{\mathrm{PS}} \label{11.2}\]
Для визначення комірки E коротко натискаємо клавішу крана і спостерігаємо за струмом на амперметрі. Якщо струм не дорівнює нулю, то налаштовуємо резистор проводу ковзання і повторно заміряємо струм, продовжуючи цей процес до тих пір, поки струм не стане нульовим. Коли струм дорівнює нулю, ми використовуємо Equation\ ref {11.2} для обчислення клітинки E.
Використання клавіші крана для короткочасного замикання ланцюга через електрохімічну комірку мінімізує струм, який проходить через комірку, і обмежує зміну складу електрохімічного елемента. Наприклад, проходження струму 10 -9 А через електрохімічну комірку протягом 1 с змінює концентрації видів в клітці приблизно на 10-14 моль. Сучасні потенціометри використовують операційні підсилювачі для створення високоімпедансного вольтметра, який вимірює потенціал при проведенні струму менше 10 -9 А.
Гальваностати
Гальваностат, принципова схема якого показана на малюнку Template:index, дозволяє управляти струмом, який протікає через електрохімічну комірку. Струм від джерела живлення через робочий електрод становить
\[i=\frac{E_{\mathrm{PS}}}{R+R_{\mathrm{cell}}} \nonumber\]
де Е ПС - потенціал джерела живлення, R - опір резистора, а R осередок - опір електрохімічної осередку. Якщо R >> R осередок, то струм між допоміжним і робочим електродами
\[i=\frac{E_{\mathrm{PS}}}{R} \approx \text{constant} \nonumber\]
підтримує постійне значення. Для контролю потенціалу робочого електрода, який змінюється в міру зміни складу електрохімічної комірки, ми можемо включити додатковий опорний електрод і потенціометр з високим імпедансом.

Потенціостати
Потенціостат, принципова схема якого показана на малюнку Template:index, дозволяє управляти потенціалом робочого електрода. Потенціал робочого електрода вимірюється щодо опорного електрода з постійним потенціалом, який з'єднаний з робочим електродом через потенціометр з високим імпедансом. Для установки потенціалу робочого електрода регулюємо резистор ковзання дроту, який підключений до допоміжного електрода. Якщо потенціал робочого електрода починає дрейфувати, налаштовуємо резистор з проводом ковзання, щоб повернути потенціал до початкового значення. Струм, що протікає між допоміжним електродом і робочим електродом, вимірюється амперметром. Сучасні потенціостати включають генератори сигналів, які дозволяють застосовувати до робочого електрода залежний від часу потенційний профіль, такий як ряд потенційних імпульсів.

Міжфазні електрохімічні методи
Оскільки міжфазна електрохімія є таким широким полем, давайте використаємо Figure Template:index для організації методів за експериментальними умовами, які ми вирішили використовувати (Чи контролюємо ми потенціал чи струм? Як ми змінюємо прикладений потенціал або застосований струм? Чи розмішуємо розчин?) і аналітичний сигнал, який ми вирішили виміряти (Струм? Потенціал?).
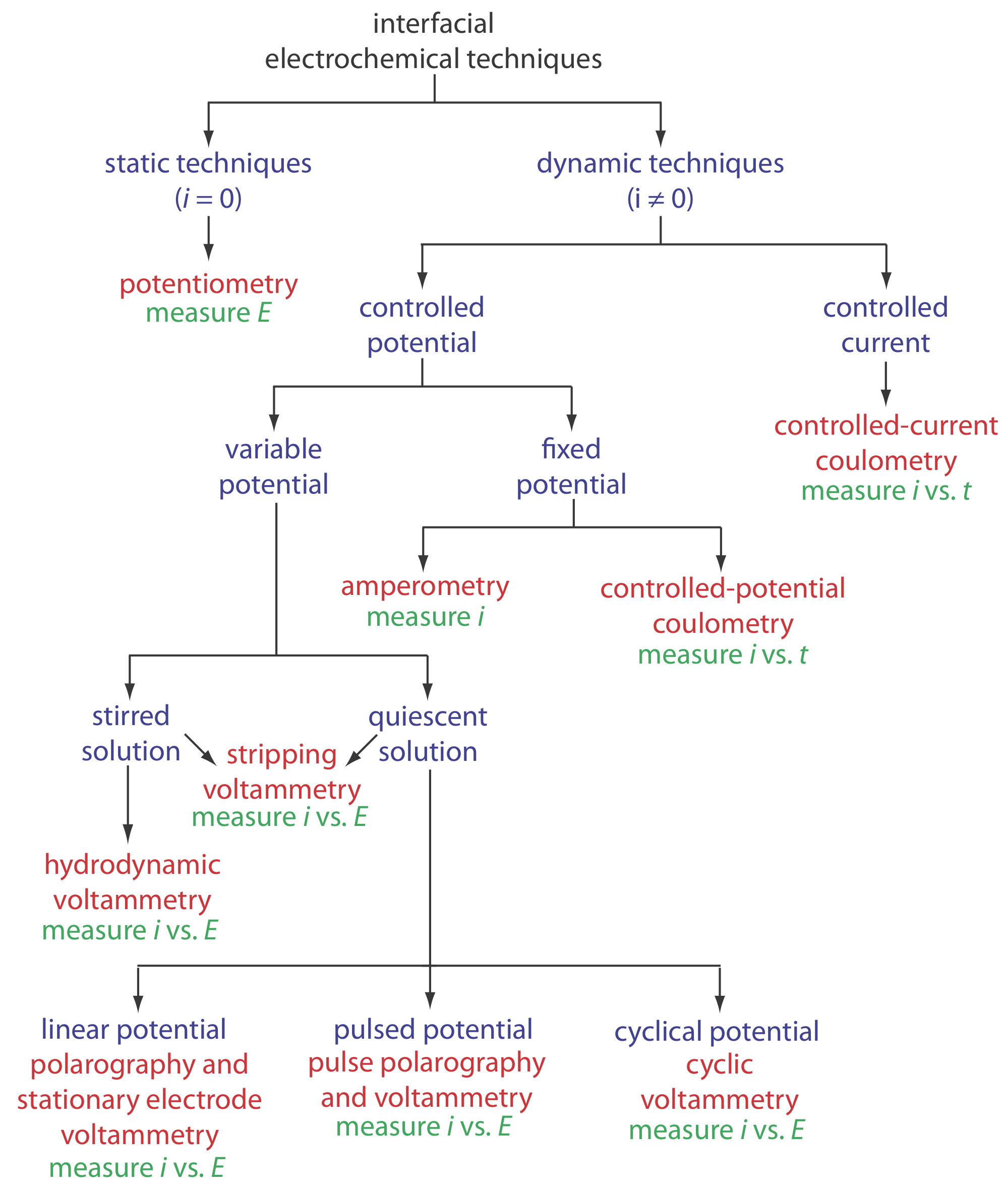
На першому рівні ми ділимо міжфазні електрохімічні методи на статичні та динамічні методи. У статичній техніці ми не пропускаємо струм через електрохімічну комірку і, як наслідок, концентрації всіх видів залишаються постійними. Потенціометрія, в якій ми вимірюємо потенціал електрохімічної клітини в статичних умовах, є одним з найважливіших кількісних електрохімічних методів і детально розглядається в розділі 11.2.
Динамічні методи, в яких ми дозволяємо струму протікати і змушувати змінювати концентрацію видів в електрохімічній комірці, складають найбільшу групу міжфазних електрохімічних методів. Кулометрія, в якій ми вимірюємо струм як функцію часу, розглядається в розділі 11.3. Амперометрія і вольтамметрія, в яких ми вимірюємо струм як функцію фіксованого або змінного потенціалу, є предметом глави 11.4.
