22.1: Електрохімічні клітини
- Page ID
- 26955
Принципова схема типового електрохімічного осередку показана на малюнку\(\PageIndex{1}\). Електрохімічна комірка складається з двох напівосередків, кожна з яких містить електрод, занурений в розчин іонів, діяльність яких визначає потенціал електрода. Сольовий міст, який містить інертний електроліт, такий як KCl, з'єднує дві половинки осередків. Кінці соляного містка закріплені пористими фритами, які дозволяють іонам електроліту вільно переміщатися між напівосередками і соляним містком. Цей рух іонів в соляному мосту завершує електричний ланцюг, дозволяючи виміряти потенціал за допомогою потенціометра.
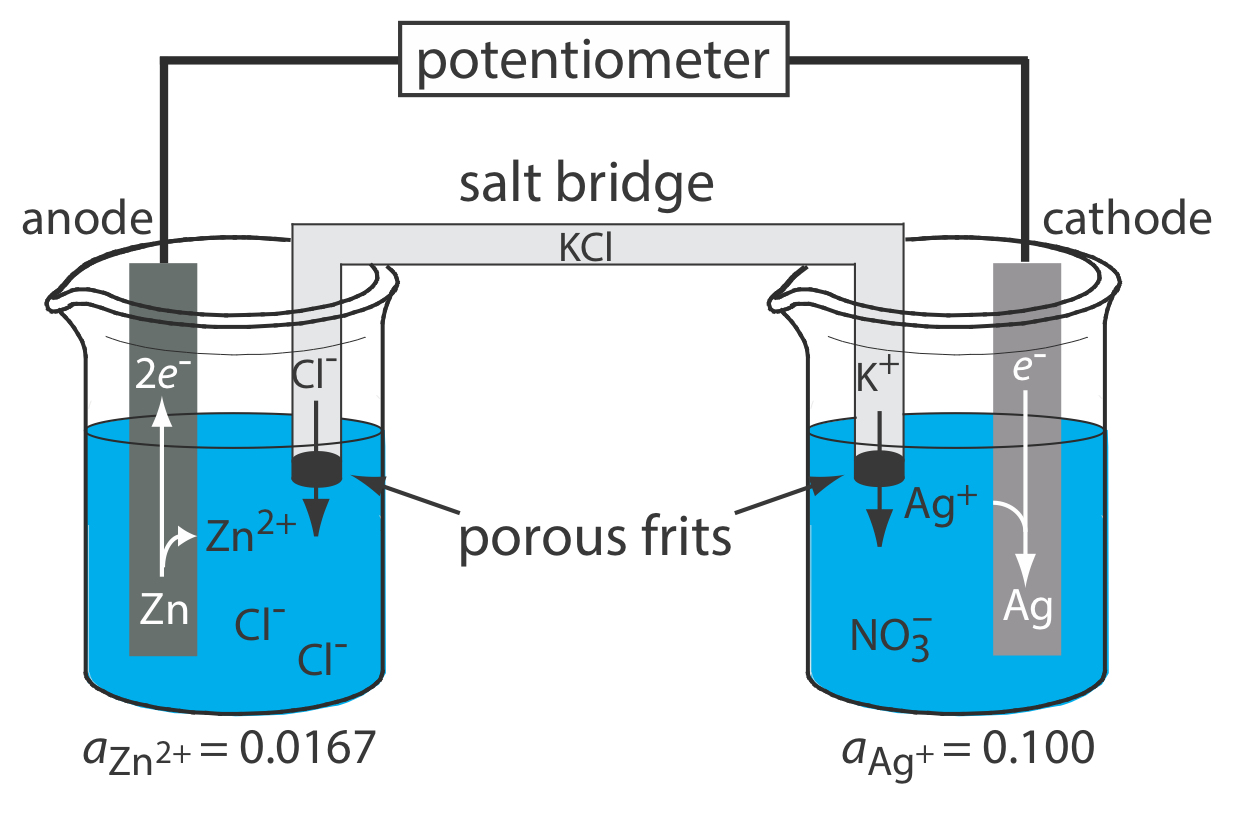
Причина поділу електродів полягає в тому, щоб запобігти реакції окислення та реакції відновлення на одному і тому ж електроді. Наприклад, якщо помістити смужку металу Zn в розчин AgNO 3, відновлення Ag + до Ag відбувається на поверхні Zn одночасно з тим, як частина металу Zn окислюється до Zn 2 +. Оскільки перенесення електронів від Zn до Ag + відбувається на поверхні електрода, ми не можемо пропустити їх через потенціометр.
Провідність в клітині
Струм рухається по осередку на малюнку в\(\PageIndex{1}\) результаті руху двох типів заряджених частинок: електронів і іонів. По-перше, коли цинк, Zn (s) зазнає реакції окислення
\[\mathrm{Zn}(s) \rightleftharpoons \text{ Zn}^{2+}(a q)+2 e^{-} \label{ox_rxn} \]
він вивільняє два електрони. Ці електрони рухаються по ланцюгу, який з'єднує металевий електрод Zn в лівій половині клітини з металевим електродом Ag в правій половині клітини, де це впливає на зменшення Ag + (aq).
\[\mathrm{Ag}^{+}(a q)+e^{-} \rightleftharpoons \mathrm{Ag}(s) \label{red_rxn} \]
Якщо це все, що трапиться, то в напівклітині зліва буде розвиватися надлишок позитивного заряду в міру накопичення іонів Zn 2 + (aq) і у півклітини праворуч буде вироблятися надлишок негативного заряду через втрату Ag + (aq). Соляний міст забезпечує спосіб продовжити рух заряду, і, таким чином, струму, при цьому іони K + рухаються до правої половинної клітини, а Cl — іони рухаються до лівої половинної клітини.
Гальванічні та електролітичні елементи
Чиста реакція для електрохімічної клітини на\(\PageIndex{1}\) малюнку
\[\mathrm{Zn}(s)+2 \mathrm{Ag}^{+}(a q) \rightleftharpoons 2 \mathrm{Ag}(s)+\mathrm{Zn}^{2+}(\mathrm{aq}) \label{net_rxn} \]
який просто є результатом додавання разом реакцій у двох половині клітин після регулювання різниці електронів. Як показують стрілки на малюнку, коли ми підключаємо електроди до потенціометра, струм мимовільно тече з лівої півкомірки в праву півкомірку. Ми називаємо це гальванічним елементом. Якщо застосувати потенціал, достатній для зворотного напрямку потоку струму, що призводить до чистої реакції
\[2 \mathrm{Ag}(s)+\mathrm{Zn}^{2+}(\mathrm{aq}) \rightleftharpoons \mathrm{Zn}(s)+2 \mathrm{Ag}^{+}(a q) \nonumber \]
то ми називаємо систему електролітичною коміркою. Гальванічний елемент виробляє електричну енергію, а електролітичний елемент споживає електричну енергію.
Аноди та катоди
Напівелемент, де відбувається окислення, називається анодом і, за умовністю, він показаний зліва для гальванічного елемента. Напівелемент, де відбувається зменшення, називається катодом і, за умовністю, він показаний праворуч для гальванічного елемента.
Фарадаїчні та нефарадаїчні течії
Коли ми окислюємо або зменшуємо аналіт на електроді в одній половині клітини, електрони проходять через потенціометр до електрода в іншій половині клітини, де відбувається відповідна реакція відновлення або окислення. У будь-якому випадку струм від окислювально-відновних реакцій на двох електродах називається фарадаїчним струмом. Фарадаїчний струм внаслідок зменшення аналіта називається катодним струмом і несе позитивний знак. Анодний струм виникає в результаті окислення аналіта і несе негативний знак.
Крім фарадаического струму від окислювально-відновної реакції, струм в електрохімічній клітці включає нефарадаїчні джерела. Припустимо, заряд на електроді дорівнює нулю і ми раптово змінюємо його потенціал так, щоб поверхня електрода набула позитивний заряд. Катіони біля поверхні електрода реагуватимуть на цей позитивний заряд, мігруючи від електрода; аніони, з іншого боку, будуть мігрувати до електрода. Ця міграція іонів відбувається до тих пір, поки позитивний поверхневий заряд електрода і надлишковий негативний заряд розчину біля поверхні електрода не будуть рівні. Оскільки рух іонів і рух електронів не відрізняються, результатом є невеликий короткочасний нефарадаїчний струм, який ми називаємо зарядним струмом. Кожен раз, коли ми змінюємо потенціал електрода, протікає короткочасний зарядний струм.
Навіть при відсутності аналіта через електрохімічну комірку протікає невеликий вимірюваний струм. Цей залишковий струм має дві складові: фарадаїчний струм за рахунок окислення або зменшення слідових домішок і нефарадаїчний зарядний струм. Методи розрізнення між фарадаїчним струмом аналіта та залишковим струмом розглядаються далі в цьому розділі.
Електричний подвійний шар
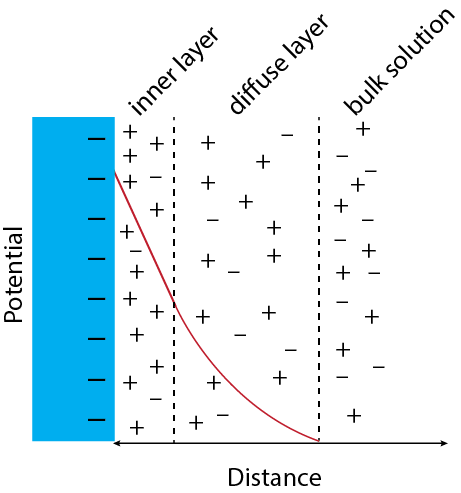
Як зазначалося в попередньому розділі, коли ми застосовуємо потенціал до електрода, він розвиває позитивний або негативний поверхневий заряд, величина якого є функцією металу і прикладеного потенціалу. Оскільки поверхня несе заряд, склад шару розчину, безпосередньо прилеглого до електрода, змінюється, наприклад, при збільшенні концентрації катіонів і зменшенні концентрації аніонів, якщо поверхня електрода несе негативний заряд. Коли ми віддаляємося від поверхні електрода, чистий потенціал спочатку зменшується лінійно, через дисбаланс катіонів та аніонів, а потім експоненціально, поки не досягне нуля. Ця структурована поверхня називається електричним подвійним шаром і складається з внутрішнього шару і дифузного шару. Щоразу, коли ми змінюємо потенціал, застосований до електрода, змінюється структура подвійного електричного шару і протікає невеликий зарядний струм.
Масоперенесення в клітині з проходженням струму
Величина фарадаического струму визначається швидкістю, з якою аналіт окислюється на аноді або зменшується на катоді. Швидкість електрохімічної реакції сприяє два фактори: швидкість, з якою реагенти та продукти транспортуються до електрода та від електрода - те, що ми називаємо масовим транспортом, - і швидкість, з якою електрони проходять між електродом та реагентами та продуктами в розчині.
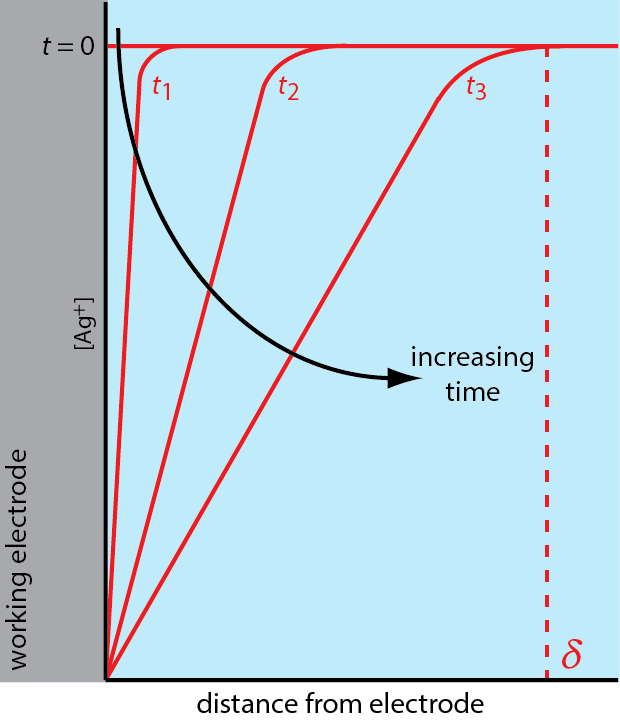
Існує три способи транспортування маси, які впливають на швидкість переміщення реагентів та продуктів у напрямку або від поверхні електрода: дифузія, міграція та конвекція. Дифузія відбувається всякий раз, коли концентрація іона або молекули на поверхні електрода відрізняється від концентрації в об'ємному розчині. Наприклад, якщо застосувати потенціал, достатній для повного зменшення\(\text{Ag}^+\) на поверхні електрода, результатом буде градієнт концентрації, подібний до показаного на малюнку\(\PageIndex{3}\). Область розчину, над якою відбувається дифузія, є дифузійний шар. За відсутності інших видів масового транспорту ширина дифузійного шару збільшується з часом\(\delta\), оскільки\(\text{Ag}^+\) повинен розсіюватися зі все більшої відстані.
Конвекція виникає при перемішуванні розчину, який переносить реагенти в сторону електрода і видаляє продукти з електрода. Найбільш поширеною формою конвекції є перемішування розчину з мішалкою; інші методи включають обертання електрода і включення електрода в проточну комірку.
Кінцевим способом транспортування маси є міграція, яка відбувається, коли заряджена частинка в розчині притягується або відштовхується від електрода, який несе поверхневий заряд. Якщо електрод несе позитивний заряд, наприклад, аніон буде рухатися до електрода і катіон буде рухатися в бік об'ємного розчину. На відміну від дифузії і конвекції, міграція впливає тільки на масовий транспорт заряджених частинок.
Схематичні зображення осередків
Хоча на малюнку\(\PageIndex{1}\) представлена корисна картина електрохімічної осередку, це не зручний спосіб її представляти. Уявіть, що потрібно намалювати картину кожної електрохімічної клітини, яку ви використовуєте! Більш корисним способом опису електрохімічної клітини є стенографічне позначення, яке використовує символи для ідентифікації різних фаз і перераховує склад кожної фази. Ми використовуємо вертикальну косу риску (|), щоб визначити межу між двома фазами, де розвивається потенціал, і комою (,) для відокремлення видів у тій самій фазі або для виявлення кордону між двома фазами, де потенціал не розвивається. Стенографічні позначення осередків починаються з анода і продовжуються до катода. Наприклад, ми опишемо електрохімічну комірку на малюнку за\(\PageIndex{1}\) допомогою наступних скорочених позначень.
\[\text{Zn}(s) | \text{ZnCl}_2(aq, a_{\text{Zn}^{2+}} = 0.0167) || \text{AgNO}_3(aq, a_{\text{Ag}^+} = 0.100) | \text{Ag} (s) \nonumber \]
Подвійний вертикальний слеш (||) являє собою соляний міст, вміст якого ми зазвичай не перераховуємо. Зверніть увагу, що подвійний вертикальний слеш означає, що існує різниця потенціалів між соляним містком і кожною половиною осередку.
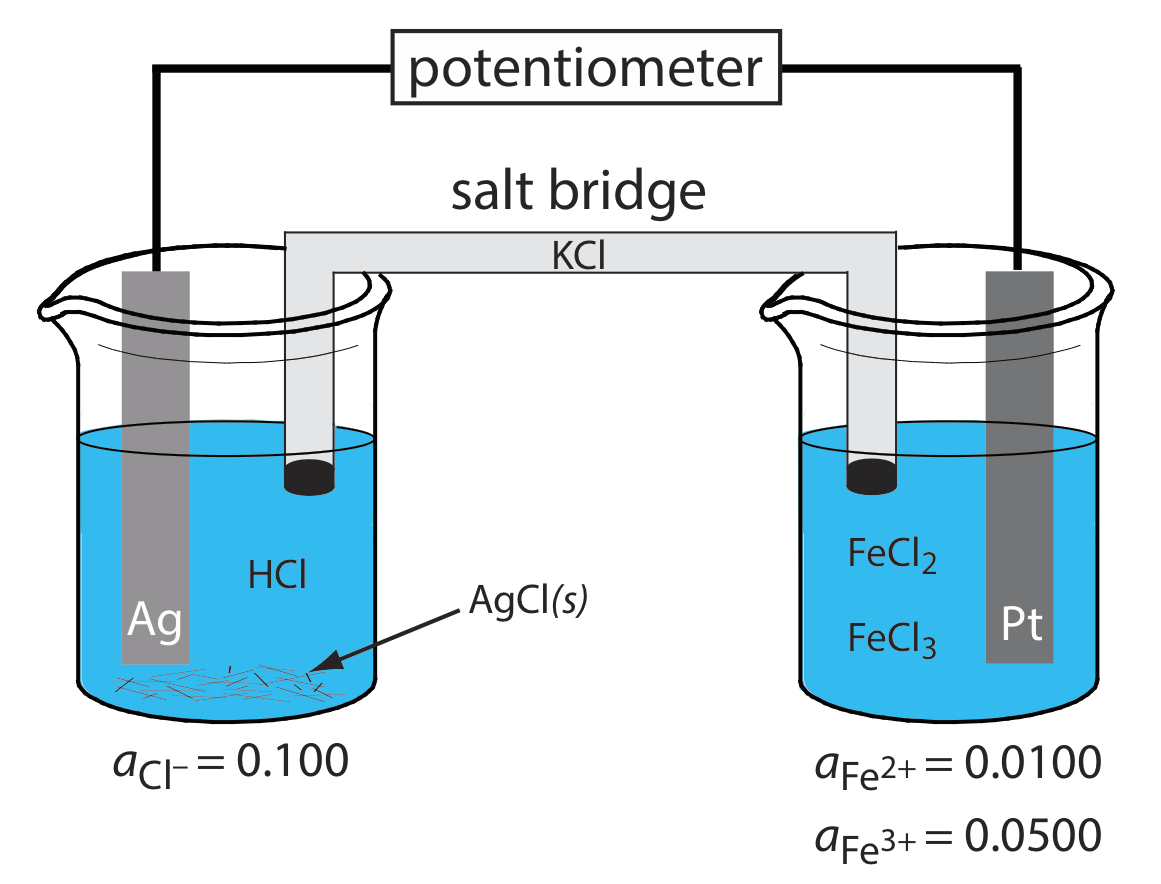
Які анодні, катодні та загальні реакції відповідають за потенціал електрохімічної клітини на малюнку\(\PageIndex{4}\)? Напишіть стенографічні позначення для електрохімічної осередку.
Рішення
Окислення Ag до Ag + відбувається на аноді, який є лівою половиною клітини. Оскільки розчин містить джерело Cl —, анодна реакція
\[\mathrm{Ag}(s)+\mathrm{Cl}^{-}(aq) \rightleftharpoons\text{ AgCl}(s)+e^{-} \nonumber \]
Катодною реакцією, яка є правою половиною клітини, є зниження Fe 3 + до Fe 2 +.
\[\mathrm{Fe}^{3+}(a q)+e^{-}\rightleftharpoons \text{ Fe}^{2+}(a q) \nonumber \]
Загальна реакція клітин, таким чином,
\[\mathrm{Ag}(s)+\text{ Fe}^{3+}(a q)+\text{ Cl}^{-}(a q) \rightleftharpoons \mathrm{AgCl}(s)+\text{ Fe}^{2+}(a q) \nonumber \]
Стенографічне позначення електрохімічної клітини
\[\text{Ag}(s) | \text{HCl} (aq, a_{\text{Cl}^{-}} = 0.100), \text{AgCl} (\text{sat’d}) || \text{FeCl}_2(aq, a_{\text{Fe}^{2+}} = 0.0100), \text{ Fe}^{3+}(aq,a_{\text{Fe}^{3+}} = 0.0500) | \text{Pt} (s) \nonumber \]
Зверніть увагу, що катод Pt - це інертний електрод, який переносить електрони до відновної напівреакції. Сам електрод не піддається відновленню.