3.2: Електрофізіологія патч-затискач
- Page ID
- 72967
Оскільки ми дізналися, що нейрони містять канали, рецептори і транспортери в блоці 1, один з найбільш корисних параметрів, який досліджують неврологи, передбачає визначення руху іонів і результуючої модуляції мембранного потенціалу нейронів. Зокрема, електрофізіологічні методи, що використовуються в збудливих тканині, покладаються на іонну провідність іонних каналів та те, як ці впливають на мембранний потенціал досліджуваної клітини. Різні методи електрофізіології були розроблені для виявлення та маніпулювання функцією іонного каналу та/або генерацією потенціалу дії. Визначення того, коли використовувати кожну електрофізіологічну техніку, залежить від багатьох різних факторів, включаючи біофізичні властивості записаної клітини, тип тканини, що досліджується, використання струму- та/або напруги-затискача, чи будуть модульовані внутрішньо-і/або позаклітинні середовища в експерименти, а головне, чи буде записаний один канал або кілька іонних каналів.
Електрофізіологія патч-затискач
Найбільш поширений метод, який використовується для оцінки іонно-канальної функції, відомий як електрофізіологічна техніка патч-затиску, яка була розроблена в 1970-х роках лауреатами Нобелівської премії Ервіном Нехером і Бертом Сакманном. Метод патч-затиску дозволяє досліднику вимірювати біофізичні властивості іонних каналів за мілісекундними часовими шкалами. Патч-затискач вимагає початкового формування ущільнення Giga-Om (GΩ) між плазмовою мембраною і тупим наконечником (діаметром 0,5-2 мкм) термополірованого скла або кварцової мікропіпетки (електрода). Після створення ущільнення Giga-Ома ця «клітинна конфігурація» (рис\(\PageIndex{1}\).) підтримує цілісність плазматичної мембрани (тобто мембранне ущільнення не розривається), запобігаючи діалізації внутрішньоклітинного розчину всередині мікропіпетки в клітину. Однак це також обмежує електричний доступ до внутрішньоклітинного простору клітини, що призводить до неможливості контролювати мембранний потенціал клітини. У цій конфігурації можна безпосередньо контролювати лише потенціал мембрани патча відносно потенціалу спокою клітини. Змінюючи або величину опору ущільнення (вільне ущільнення проти щільного ущільнення) та/або чи є записуючий електрод струмом проти напруги, конфігурація, прикріплена до комірки, може бути використана для вимірювання одноканальних струмів, спонтанного вогню нейрональних клітин і синаптичні потенціали, а також викликані потенціали дії всередині клітини. Інша головна перевага цієї конфігурації полягає в тому, що, хоча вона обмежена з причин, викладених вище, ця конфігурація є відправною точкою для більшості типів записів патч-затискачів.
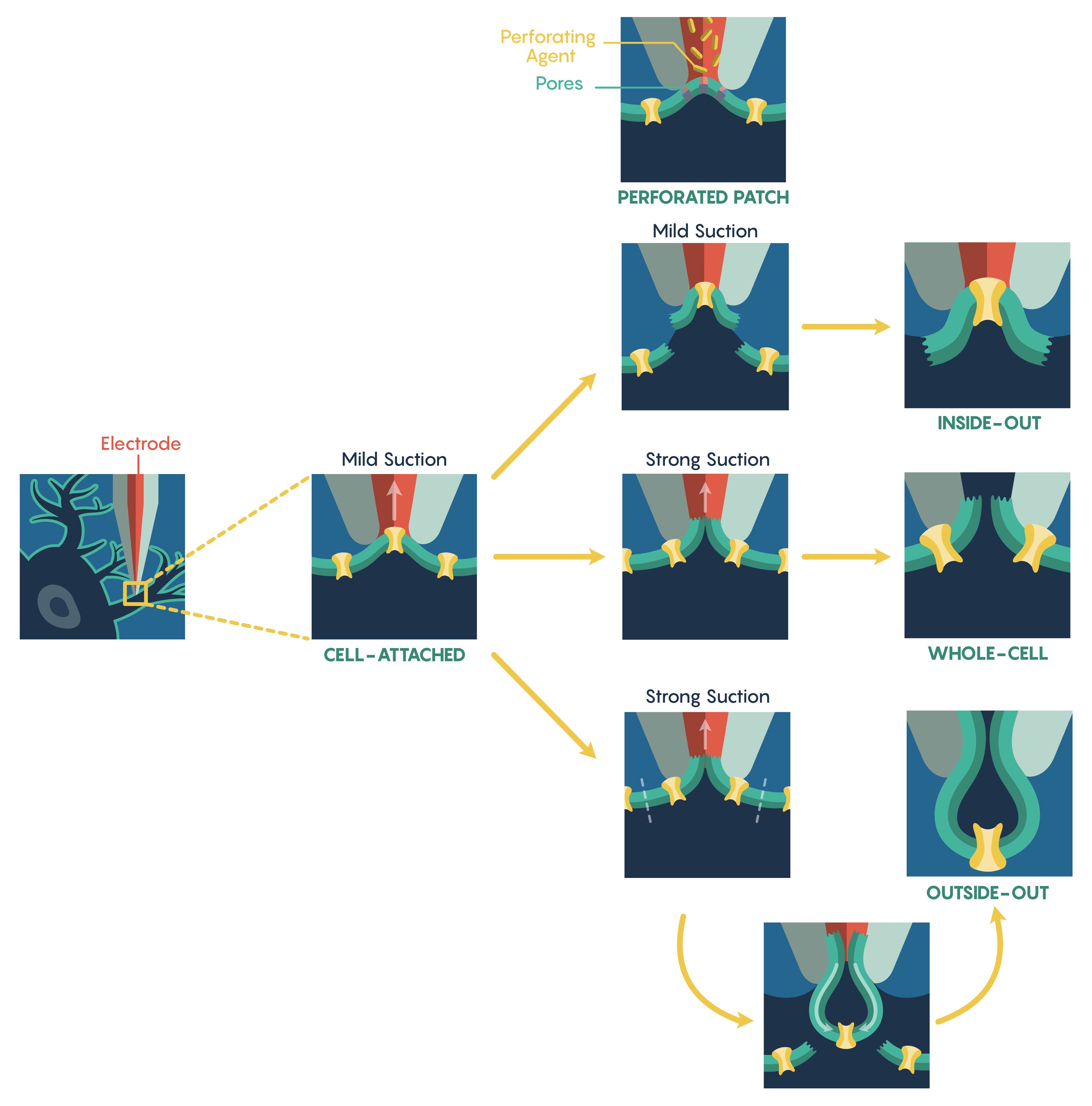
Малюнок\(\PageIndex{1}\). Електрофізіологічні методи. Метод патч-затиску, прикріплений до комірки. Перфорований патч, зовнішні та навиворітні конфігурації. Щоб показати потенційний діаліз, просвіт піпетки і цитоплазма представлені відповідно червоним і темно-синім кольором.
Для збільшення електричного доступу до осередку осередку використовують два різних способи. По-перше, внутрішній розчин піпетки містить антибіотики або протигрибкові засоби (наприклад, ністатин, граміцидин, амфотерицин-В), ці агенти утворюють невеликі одновалентні іонно-проникні пори, які «перфорують» (рис\(\PageIndex{1}\).) мембрану, що забезпечує доступ до всієї клітини. Важливо, що ці пори не пропускають білки, тим самим гарантуючи, що внутрішньоклітинний вміст залишається неушкодженим, зберігаючи внутрішньоклітинні сигнальні шляхи. Однак ця перфорована техніка патча має кілька обмежень, включаючи більш високий електричний шум, втрату одноканальної роздільної здатності та нестабільність патча. Крім того, створення перфорованого пластиру вимагає значно тривалого періоду часу.
Альтернативним підходом до техніки перфорованого пластиру є застосування сильного всмоктування або короткого перехідного напруги після формування ущільнення Giga-Ohm з метою розриву неушкодженої плазматичної мембрани. Після розриву між піпеткою та внутрішньою частиною клітини встановлюється електрична та фізична безперервність низького опору, і ця нова конфігурація відома як конфігурація цілої клітини (рис\(\PageIndex{1}\).). Відповідно, така конфігурація дозволяє проводити прямі вимірювання мембранного потенціалу клітини (через струм-затискач) та маніпулювання ним (через напругу-затискач). Завдяки фізичній безперервності між внутрішньою частиною клітини та розчином піпетки вміст цитозолу можна розумно контролювати. Крім того, на відміну від перфорованого пластиру, фармакологічні або іонні маніпуляції як внутрішньоклітинного, так і позаклітинного середовища можуть призвести до еліцидації окремих іонних струмів. Однак ця фізична безперервність між просвітом піпетки та цитозолом також може діалізувати та/або змінювати активність ендогенних систем другого месенджера. Таким чином, цілі клітинні записи вразливі до цього обмеження, і дуже важливо оцінити поточний «збіг» системи та клітин у цих типах систем запису цілих клітин.
Також можна створити «Безклітинні» варіації методів патч-затиску. Наприклад, при утворенні гіга-ущільнення електрод може бути обережно втягнутий, потягнувши мембранний пластир у розчин ванни. Ця схема, відома як конфігурація навиворіт (рис\(\PageIndex{1}\).), дозволяє повністю маніпулювати цитоплазматичною поверхнею плазматичної мембрани за допомогою перфузії ванни - особливість, неможлива в конфігурації, прикріпленої до клітин. В результаті назовні патчі дозволяють проводити маніпуляції безпосереднім оточенням внутрішньої мембрани обличчя. На жаль, ця схема страждає від втрати внутрішньоклітинних сигнальних шляхів, що діють на іонні канали після висічення патча; особливо важливий фактор при дослідженні зміненої активності каналу.
Аналогічно, зовнішній патч (рис\(\PageIndex{1}\).) також вимагає м'якого відведення патч-електрода з цілої конфігурації осередків. Однак у цій ситуації втягування піпетки змушує плазмову мембрану, що оточує кінчик електрода, від'єднуватися від клітини та ущільнювати, утворюючи незалежний від клітин пластир, позаклітинна мембрана якого звернена до розчину для купання. Це дозволяє експериментатору мати повний контроль над внутрішньоклітинним середовищем і може швидко обмінюватися різними зовнішніми фізіологічними або фармакологічними препаратами через один і той же пластир.
