18.5: Вакцини
- Page ID
- 3932
Цілі навчання
- Порівняйте різні види штучного імунітету
- Диференціювати варіоляцію та вакцинацію
- Опишіть різні типи вакцин та поясніть їх відповідні переваги та недоліки
Для багатьох захворювань профілактика є найкращою формою лікування, і мало стратегій профілактики захворювань настільки ж ефективні, як вакцинація. Вакцинація - це форма штучного імунітету. Штучно стимулюючи адаптивний імунний захист, вакцина запускає виробництво клітин пам'яті, подібне до того, що відбуватиметься під час первинної відповіді. При цьому пацієнт може мати сильну вторинну реакцію при впливі на збудника, але без необхідності спочатку страждати від початкової інфекції. У цьому розділі ми розглянемо кілька різних видів штучного імунітету, а також різні типи вакцин та механізми, за допомогою яких вони індукують штучний імунітет.
Класифікації адаптивного імунітету
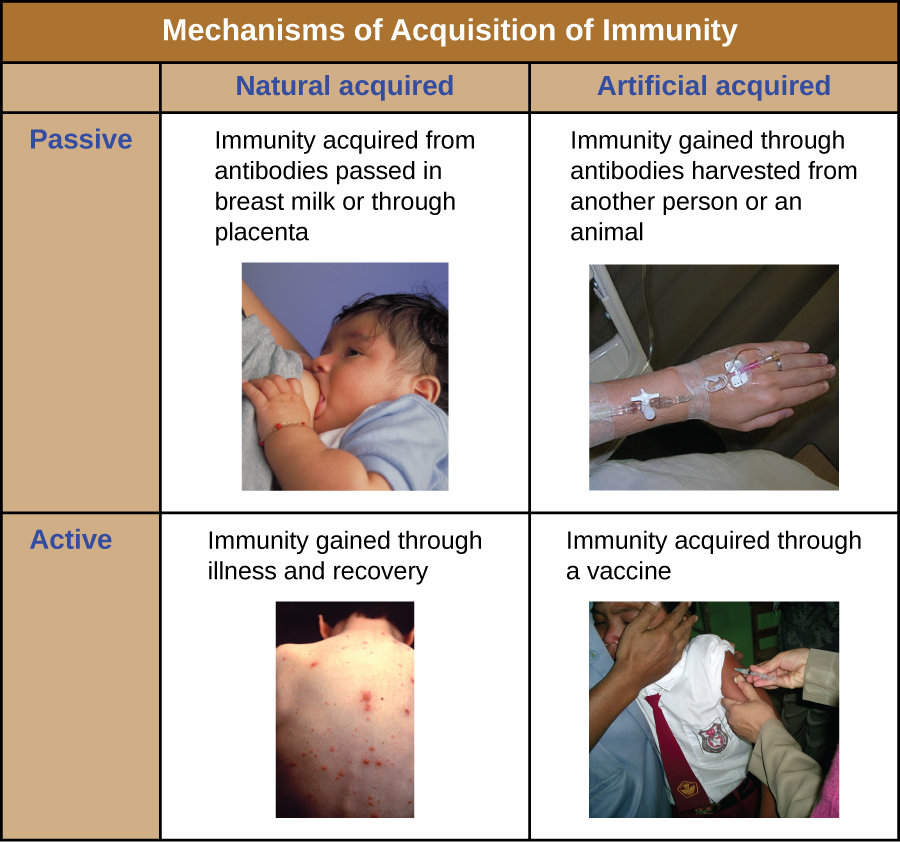
Всі форми адаптаційного імунітету можна охарактеризувати як активні, так і пасивні. Активний імунітет відноситься до активації власних адаптивних імунних захисних сил індивіда, тоді як пасивний імунітет відноситься до передачі адаптаційних імунних захисних сил від іншої людини або тварини. Активний і пасивний імунітет можна додатково поділити виходячи з того, набута захист природним шляхом або штучно.
Природний активний імунітет - це адаптивний імунітет, який розвивається після природного впливу збудника (рис.\(\PageIndex{1}\)). Прикладами може служити довічний імунітет, який розвивається після одужання від вітрянки або кору (хоча гостра інфекція не завжди необхідна для активації адаптивного імунітету). Тривалість часу, коли людина захищена, може істотно варіюватися залежно від збудника та антигенів. Наприклад, активація адаптивного імунітету білковими спайковими структурами під час внутрішньоклітинної вірусної інфекції може активувати довічний імунітет, тоді як активація антигенами вуглеводних капсул під час позаклітинної бактеріальної інфекції може активувати короткочасний імунітет.
Природний пасивний імунітет передбачає природне проходження антитіл від матері до її дитини до і після народження. IgG - єдиний клас антитіл, який може перетнути плаценту з крові матері до кровопостачання плода. Плацентарний перенесення IgG є важливою пасивним імунним захистом для немовляти, що триває до півроку після народження. Секреторні IgA також можуть передаватися від матері до немовляти через грудне молоко.
Штучним пасивним імунітетом розуміється передача антитіл, що виробляються донором (людиною або твариною) іншій особі. Ця передача антитіл може проводитися як профілактичний захід (тобто для запобігання захворюванню після впливу збудника) або як стратегія лікування активної інфекції. Наприклад, штучний пасивний імунітет зазвичай використовується для постконтактної профілактики сказу, гепатиту А, гепатиту В та вітрянки (у осіб з високим ризиком). Активні інфекції, які лікуються штучним пасивним імунітетом, включають цитомегаловірусні інфекції у пацієнтів з ослабленим імунітетом та вірусні інфекції Ебола. У 1995 році вісім пацієнтів в Демократичній Республіці Конго з активними інфекціями Ебола лікувалися переливанням крові від пацієнтів, які одужували від Еболи. Помер лише один з восьми пацієнтів (рівень смертності 12,5%), що було набагато нижчим за очікуваний рівень смертності від Еболи у пацієнтів, які не лікуються, у 80%. 1 Штучний пасивний імунітет також використовується для лікування захворювань, викликаних бактеріальними токсинами, включаючи правець, ботулізм, дифтерію.
Штучний активний імунітет є основою для вакцинації. Він передбачає активацію адаптаційного імунітету за допомогою навмисного впливу на індивіда ослаблених або інактивованих патогенів, або препаратів, що складаються з ключових антигенів-збудників.
Вправа\(\PageIndex{1}\)
- У чому різниця між активним і пасивним імунітетом?
- Який імунітет надає вакцина?
Імунітет стада
Чотири види імунітету щойно описані є результатом адаптивної імунної системи людини. Для будь-якого даного захворювання людина може вважатися імунною або сприйнятливою залежно від його здатності встановлювати ефективну імунну відповідь при впливі. Таким чином, будь-яка дана популяція, ймовірно, матиме деяких людей, які мають імунітет, та інші особи, які сприйнятливі. Якщо в популяції дуже мало сприйнятливих осіб, навіть ті сприйнятливі особи будуть захищені явищем, званим імунітетом стада. Імунітет стада не має нічого спільного зі здатністю індивіда монтувати ефективну імунну відповідь; скоріше, це відбувається тому, що в популяції занадто мало сприйнятливих осіб для ефективного поширення захворювання.
Програми вакцинації створюють стадний імунітет за рахунок значного зменшення кількості сприйнятливих особин у популяції. Навіть якщо деякі особи в популяції не вакциновані, якщо певний відсоток має імунітет (природно або штучно), мало сприйнятливих особин навряд чи будуть схильні до впливу збудника. Однак, оскільки нові особини постійно потрапляють в популяції (наприклад, через народження або переселення), програми вакцинації необхідні для підтримки імунітету стада.
Вакцинація: обов'язок або вибір
Все більша кількість батьків вирішують не вакцинувати своїх дітей. Їх називають «антивакксерами», і більшість з них вважають, що вакцини є причиною аутизму (або інших захворювань), ланкою, яка зараз була повністю спростована. Інші заперечують проти вакцин на релігійних або моральних підставах (наприклад, аргумент про те, що вакцинація Гардасил проти ВПЛ може сприяти сексуальній розбещеності), на особистих етичних підставах (наприклад, відмова від добросовісності проти будь-якого медичного втручання) або з політичних мотивів (наприклад, уявлення про те, що обов'язкові вакцинації є порушення індивідуальних свобод). 2
Вважається, що це зростаюче число нещеплених осіб призвело до нових спалахів коклюшу та кору. Ми очікуємо, що імунітет стада захистить тих, хто не вакцинований у нашому населенні, але імунітет стада можна підтримувати лише в тому випадку, якщо вакцинується достатня кількість людей.
Вакцинація явно корисна для здоров'я населення. Але з точки зору окремих батьків погляд може бути більш похмурим. Вакцини, як і всі медичні втручання, мають пов'язані ризики, і хоча ризики вакцинації можуть бути надзвичайно низькими порівняно з ризиками зараження, батьки не завжди можуть зрозуміти або прийняти консенсус медичної спільноти. Чи мають такі батьки право відмовитися від щеплення від своїх дітей? Чи слід їм дозволити піддавати ризику своїх дітей - і суспільство в цілому?
Багато урядів наполягають на дитячих щепленнях як на умові вступу до державної школи, але в більшості штатів стало легко відмовитися від цієї вимоги або утримувати дітей поза державною системою. Починаючи з 1970-х років, Західна Вірджинія та Міссісіпі мали жорстку вимогу щодо вакцинації дітей без винятків, і ні в одному штаті не було випадків кору з початку 1990-х років. Каліфорнійські законодавці нещодавно прийняли подібний закон у відповідь на спалах кору в 2015 році, що значно ускладнило батькам відмову від вакцин, якщо їхні діти відвідують державні школи. Враховуючи цей послужний список та поновлені законодавчі зусилля, чи повинні інші держави приймати подібні суворі вимоги?
Яку роль повинні відігравати медичні працівники у просуванні або впровадженні універсальної вакцинації? Дослідження показали, що розум багатьох батьків може бути змінений у відповідь на інформацію, яку надають медичні працівники, але чи є місцем медичних працівників намагатися переконати батьків зробити щеплення своїх дітей? Деякі медичні працівники, зрозуміло, неохоче лікують невакцинованих пацієнтів. Чи мають вони право відмовити в обслуговуванні пацієнтам, які відмовляються від вакцин? Чи мають право страхові компанії відмовити в покритті антиваксерам? Це всі етичні питання, які політики можуть бути змушені вирішити, оскільки більше батьків скорочують норми вакцинації.
Варіоляція та вакцинація
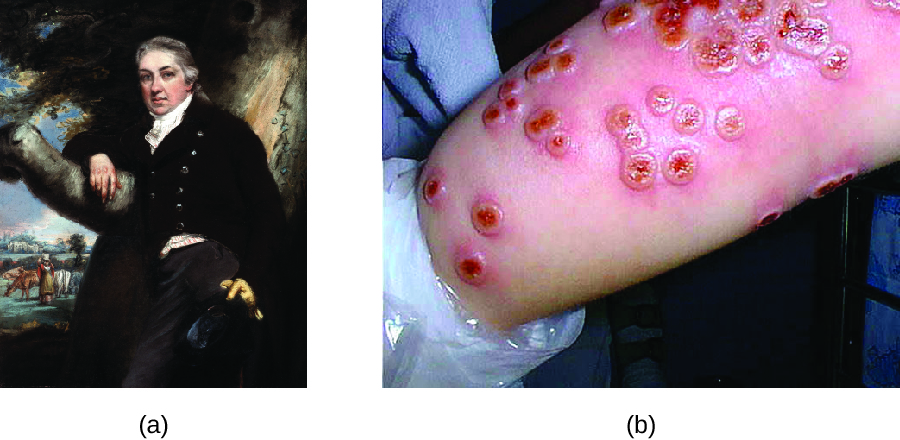
Тисячі років тому вперше було визнано, що особи, які пережили інфекцію віспи, були несприйнятливі до наступних інфекцій. Практика щеплення особин для активного захисту їх від віспи, схоже, зародилася в 10 столітті в Китаї, коли була описана практика варіоляції (рис.\(\PageIndex{2}\)). Варіоляцією називають навмисне щеплення осіб з інфекційним матеріалом від струпів або гнійників постраждалих від віспи. Інфекційні матеріали або вводяться в шкіру, або вводяться через носовий шлях. Інфекція, яка розвивалася, зазвичай була м'якшою, ніж природним шляхом придбана віспа, і відновлення після більш м'якої інфекції забезпечувало захист від більш серйозного захворювання.
Хоча більшість осіб, які лікувалися варіоляцією, розвивалися лише легкі інфекції, практика не була без ризиків. Більш серйозні, а іноді і смертельні інфекції траплялися, і оскільки віспа була заразною, інфекції, що виникають внаслідок варіоляції, могли призвести до епідемій. Незважаючи на це, практика варіоляції для профілактики віспи поширилася в інших регіонах, включаючи Індію, Африку та Європу.

Хоча варіоляція практикувалася століттями, англійському лікарю Едварду Дженнеру (1749—1823), як правило, приписують розвиток сучасного процесу вакцинації. Дженнер зауважив, що доярки, які розвинули коров'ячу віспу, захворювання, схоже на віспу, але більш м'яке, були несприйнятливі до більш серйозної віспи. Це призвело Дженнера до гіпотези, що вплив менш вірулентного збудника може забезпечити імунний захист від більш вірулентного збудника, забезпечуючи більш безпечну альтернативу варіоляції. У 1796 році Дженнер перевірив свою гіпотезу, отримавши інфекційні зразки від активного ураження корови доярки та вводячи матеріали молодому хлопчику (рис.\(\PageIndex{3}\)). У хлопчика розвинулася легка інфекція, яка включала субфебрильну лихоманку, дискомфорт у пахвовій западині (пахви) і втрату апетиту. Коли хлопчик пізніше був заражений інфекційними зразками від ураження віспи, він не заразився віспою. 3 Цей новий підхід був названий вакцинацією, назва походить від використання віспи (латинське vacca означає «корова») для захисту від віспи. Сьогодні ми знаємо, що вакцина Дженнера спрацювала, оскільки вірус коров'ячої віспи генетично пов'язаний з вірусами Variola, які викликали віспу. Вплив антигенів коров'ячої віспи призвів до первинної відповіді та вироблення клітин пам'яті, які ідентичні або пов'язані епітопи вірусу Variola при більш пізньому впливі на віспу.
Успіх вакцинації Дженнера від віспи змусив інших вчених розробити вакцини від інших захворювань. Мабуть, найбільш помітним був Луї Пастер, який розробив вакцини від сказу, холери та сибірської виразки. Протягом 20-го та 21-го століть були розроблені ефективні вакцини для профілактики широкого спектру захворювань, спричинених вірусами (наприклад, вітрянка та оперізуючий лишай, гепатит, кір, свинка, поліомієліт та жовта лихоманка) та бактеріями (наприклад, дифтерія, пневмококова пневмонія, правець та коклюш) кашель,).
Вправа\(\PageIndex{2}\)
- Чим відрізняється варіоляція від вакцинації від віспи?
- Поясніть, чому вакцинація менш ризикована, ніж варіоляція.
Класи вакцин
Щоб вакцина забезпечувала захист від захворювання, вона повинна піддавати індивіда патоген-специфічним антигенам, які стимулюватимуть захисну адаптивну імунну відповідь. За своєю природою це тягне за собою певний ризик. Як і будь-який фармацевтичний препарат, вакцини можуть викликати несприятливі наслідки. Однак ідеальна вакцина не викликає серйозних несприятливих наслідків і не представляє ризику зараження хворобою, яку вона призначена для запобігання. З урахуванням цих цілей були розроблені різні типи вакцин. Ці різні класи вакцин описані в наступному розділі і зведені в табл\(\PageIndex{1}\).
Живі атенуйовані вакцини
Живі ослаблені вакцини піддають індивіда ослабленому штаму збудника з метою встановлення субклінічної інфекції, яка активізує адаптивний імунний захист. Патогени ослаблені для зменшення їх вірулентності за допомогою таких методів, як генетична маніпуляція (для усунення ключових факторів вірулентності) або тривале культивування в неприродному господареві або навколишньому середовищі (для сприяння мутаціям та зменшення вірулентності).
Встановлюючи активну інфекцію, живі ослаблені вакцини стимулюють більш комплексну імунну відповідь, ніж деякі інші типи вакцин. Живі ослаблені вакцини активізують як клітинний, так і гуморальний імунітет і стимулюють розвиток пам'яті для тривалого імунітету. У деяких випадках вакцинація однієї особини живим ослабленим збудником може навіть призвести до природної передачі ослабленого збудника іншим особам. Це може призвести до того, що інші люди також розвинуть активну субклінічну інфекцію, яка активізує їх адаптивний імунний захист.
Недоліки, пов'язані з живими ослабленими вакцинами, включають проблеми, пов'язані з тривалим зберіганням та транспортуванням, а також потенціал розвитку у пацієнта ознак та симптомів захворювання під час активної інфекції (особливо у пацієнтів з ослабленим імунітетом). Існує також ризик повернення ослабленого збудника до повної вірулентності. У таблиці\(\PageIndex{1}\) наведено приклади живих ослаблених вакцин.
інактивовані вакцини
Інактивовані вакцини містять цілі патогени, які були вбиті або інактивовані теплом, хімічними речовинами або радіацією. Щоб інактивовані вакцини були ефективними, процес інактивації не повинен впливати на структуру ключових антигенів збудника.
Оскільки збудник убитий або неактивний, інактивовані вакцини не виробляють активної інфекції, а результуюча імунна відповідь слабкіша і менш комплексна, ніж та, що спровокована живою ослабленою вакциною. Зазвичай реакція передбачає тільки гуморальний імунітет, і збудник не може передаватися іншим особам. Крім того, інактивовані вакцини зазвичай вимагають більш високих доз і декількох прискорювачів, можливо, викликаючи запальні реакції в місці ін'єкції.
Незважаючи на ці недоліки, інактивовані вакцини мають переваги тривалого зберігання, стабільності та простоти транспортування. Також немає ризику викликати важкі активні інфекції. Однак інактивовані вакцини не позбавлені своїх побічних ефектів. У таблиці\(\PageIndex{1}\) наведено приклади інактивованих вакцин.
Субодиничні вакцини
У той час як живі ослаблені та неактивні вакцини піддають людину ослабленому або мертвому збуднику, субодиничні вакцини піддають пацієнта лише ключовим антигенам патогену, а не цілим клітинам або вірусам. Субодиничні вакцини можуть бути отримані або шляхом хімічного руйнування збудника та виділення його ключових антигенів, або шляхом вироблення антигенів за допомогою генної інженерії. Оскільки ці вакцини містять лише есенціальні антигени збудника, ризик побічних ефектів відносно низький. У таблиці\(\PageIndex{1}\) наведені приклади субодиничних вакцин.
Вакцини проти анатоксинів
Як і субодиничні вакцини, анатоксинові вакцини не вводять хворому цілого збудника; вони містять інактивовані бактеріальні токсини, звані анатоксинами. Анаксоїдні вакцини використовуються для профілактики захворювань, при яких бактеріальні токсини відіграють важливу роль в патогенезі. Ці вакцини активізують гуморальний імунітет, який нейтралізує токсини. У таблиці\(\PageIndex{1}\) наведені приклади вакцин проти анатоксину.
кон'югатні вакцини
Кон'югатна вакцина - це тип субодиничної вакцини, яка складається з білка, кон'югованого з капсульним полісахаридом. Кон'югатні вакцини були розроблені для підвищення ефективності субодиничних вакцин проти патогенів, які мають захисні полісахаридні капсули, які допомагають їм уникнути фагоцитозу, викликаючи інвазивні інфекції, які можуть призвести до менінгіту та інших серйозних станів. Субодиничні вакцини проти цих патогенів вводять Т-незалежні капсульні полісахаридні антигени, які призводять до вироблення антитіл, які можуть опсонізувати капсулу і тим самим боротися з інфекцією; однак діти у віці до двох років не реагують ефективно на ці вакцини. Діти дійсно ефективно реагують при щепленні кон'югатної вакциною, в якій білок з Т-залежними антигенами кон'югується з капсульним полісахаридом. Кон'югований білково-полісахаридний антиген стимулює вироблення антитіл як проти білка, так і до капсульного полісахариду. У таблиці\(\PageIndex{1}\) наведені приклади кон'югатних вакцин.
| Клас | Опис | переваги | недоліки | Приклади |
|---|---|---|---|---|
| Жива ослаблена | Ослаблений штам цілого збудника | Клітинний і гуморальний імунітет | Складно зберігати і транспортувати | Вітрянка, німецька кір, кір, свинка, туберкульоз, черевний тиф, жовта лихоманка |
| Тривалий імунітет | Ризик зараження у пацієнтів з ослабленим імунітетом | |||
| Передача на контакти | Ризик реверсії | |||
| Інактивований | Цілий збудник, убитий або інактивований теплом, хімічними речовинами або радіацією | Зручність зберігання і транспортування | Слабший імунітет (тільки гуморальний) | Холера, гепатит А, грип, чума, сказ |
| Відсутність ризику важкої активної інфекції | Вищі дози і більше прискорювачі необхідні | |||
| Субодиниця | імуногенні антигени | Зниження ризику розвитку побічних ефектів | Обмежена довговічність | Сибірська виразка, гепатит В, грип, менінгіт, папіломавірус, пневмококова пневмонія, коклюш |
| Необхідні кілька доз | ||||
| Відсутність захисту від антигенних змін | ||||
| анатоксин | Інактивований бактеріальний токсин | Гуморальний імунітет для нейтралізації токсину | Не запобігає зараженню | Ботулізм, дифтерія, коклюш, правець |
| Сполучений | Капсула полісахарид, кон'югований з білком | Т-залежна реакція на капсулу | Витратні у виробництві |
менінгіт (Гемофільний грип, стрептокок пневмонії, менінгіти Neisseria) |
| Відсутність захисту від антигенних змін | ||||
| Краща реакція у маленьких дітей | Може заважати іншим вакцинам |
Вправа\(\PageIndex{3}\)
- Який ризик пов'язаний з живою ослабленою вакциною?
- Чому в деяких випадках необхідна кон'югована вакцина?
ДНК-вакцини являють собою відносно новий і перспективний підхід до вакцинації. ДНК-вакцина виробляється шляхом включення генів антигенів в рекомбінантну плазмідну вакцину. Введення ДНК-вакцини пацієнту призводить до поглинання рекомбінантної плазміди деякими клітинами пацієнта з подальшою транскрипцією і трансляцією антигенів і представленням цих антигенів з MHC I для активації адаптивного імунітету. Це призводить до стимуляції як гуморального, так і клітинного імунітету без ризику активного захворювання, пов'язаного з живими ослабленими вакцинами.
Хоча більшість ДНК-вакцин для людей все ще знаходяться в розробці, цілком ймовірно, що вони стануть більш поширеними найближчим часом, оскільки дослідники працюють над інженерними вакцинами ДНК, які активують адаптивний імунітет проти декількох різних патогенів одночасно. ДНК-вакцини першого покоління, випробувані в 1990-х роках, виглядали багатообіцяючими у моделями тварин, але були невтішними при випробуванні на людських суб'єктах Погане поглинання клітинами ДНК плазмід було однією з основних проблем, що впливають на їх ефективність. Випробування ДНК-вакцин другого покоління були більш перспективними завдяки новим методам посилення поглинання клітин та оптимізації антигенів. В даний час розробляються ДНК-вакцини для різних видів раку та вірусних збудників, таких як ВІЛ, ВПЛ та гепатит В і С.
Деякі вакцини ДНК вже використовуються. У 2005 році ДНК-вакцина проти вірусу Західного Нілу була схвалена для використання у коней в США. Канада також схвалила вакцину ДНК для захисту риб від інфекційного вірусу гемопоетичного некрозу. 4 ДНК-вакцина проти вірусу японського енцефаліту була схвалена для використання у людей у 2010 році в Австралії.
Клінічна спрямованість: Дозвіл
Грунтуючись на симптомах Олівії, її лікар поставив попередній діагноз бактеріального менінгіту, не чекаючи позитивної ідентифікації зі зразків крові та ліквору, надісланих до лабораторії. Олівія була прийнята до лікарні та лікувалася внутрішньовенними антибіотиками широкого спектру дії та регідратаційною терапією. Протягом наступних кількох днів її стан почав покращуватися, а нові зразки крові та проби люмбальної пункції показали відсутність мікробів у крові та лікворі з поверненням рівня лейкоцитів в норму. За цей час лабораторія провела позитивну ідентифікацію Neisseria meningitidis, збудника менінгококового менінгіту, у її вихідному зразку ліквору.
N. meningitidis виробляє полісахаридну капсулу, яка служить фактором вірулентності. N. meningitidis має тенденцію вражати немовлят після того, як вони починають втрачати природний пасивний імунітет, що забезпечується материнськими антитілами. У однорічному віці материнські антитіла IgG Олівії зникли б, і вона не виробила б клітин пам'яті, здатних розпізнавати антигени, пов'язані з полісахаридною капсулою N. meningitidis. В результаті її адаптивна імунна система не змогла виробляти захисні антитіла для боротьби з інфекцією, а без антибіотиків вона, можливо, не вижила. Інфекції Олівії, ймовірно, вдалося б уникнути взагалі, якби вона була вакцинована. Кон'югатна вакцина для запобігання менінгококового менінгіту доступна і схвалена для немовлят у віці двох місяців. Однак нинішні графіки вакцинації в Сполучених Штатах рекомендують вводити вакцину у віці 11—12 років з підсилювачем у віці 16 років.
У країнах з розвиненими системами охорони здоров'я багато вакцин регулярно вводяться дітям та дорослим. Графіки вакцин періодично змінюються на основі нової інформації та результатів досліджень, зібраних установами охорони здоров'я. У США CDC публікує графіки та іншу оновлену інформацію про вакцини.
Ключові поняття та резюме
- Адаптивний імунітет можна розділити на чотири різні класифікації: природний активний імунітет, природний пасивний імунітет, штучний пасивний імунітет, штучний активний імунітет.
- Штучний активний імунітет є основою для вакцинації та розробки вакцин. Програми вакцинації не тільки надають штучний імунітет окремим особам, але й сприяють зміцненню імунітету стада у населення.
- Варіоляція проти віспи виникла в 10 столітті в Китаї, але процедура була ризикованою, оскільки могла спричинити захворювання, яке вона мала на меті запобігти. Сучасна вакцинація була розроблена Едвардом Дженнером, який розробив практику щеплення хворих інфекційними матеріалами від уражень коров'ячої віспи для профілактики віспи.
- Живі ослаблені вакцини та інактивовані вакцини містять цілі патогени, які слабкі, убиті або інактивовані. Субодиничні вакцини, вакцини проти анатоксину та кон'югатні вакцини містять ацелюлярні компоненти з антигенами, які стимулюють імунну відповідь.
Виноски
- 1 К. Мупапа, Масамба М., Кібаді К., К.Ківула, А.Бвака, М.Кіпаса, Р. Коулбандерс, Дж. Муембе-Тамфум. «Лікування геморагічної лихоманки Ебола переливанням крові від пацієнтів, що видужують». Журнал інфекційних хвороб 179 Suppl. (1999): S18—S23.
- 2 Елізабет Єль. «Чому рухи проти вакцинації ніколи не можна приручити». Релігія і політика, 22 липня 2014 року. religionandpolitics.org/2014/... ніколи не бути прирученими.
- 3 Н.Дж. Вілліс. «Едвард Дженнер і викорінення віспи». Шотландський медичний журнал 42 (1997): 118—121.
- 4 М. Алонсо і Дж. «Ліцензовані ДНК-вакцини проти вірусу інфекційного гемопоетичного некрозу (IHNV)». Останні патенти на ДНК та послідовності генів (припинено) 7 № 1 (2013): 62-65, ISSN 1872-2156/2212-3431. doi 10.2174/1872215611307010009.
- 5 С.Б. Холстед і С.Дж. Томас. «Нові вакцини проти японського енцефаліту: альтернативи виробництву в мозку миші». Експертний огляд вакцин 10 № 3 (2011): 355—64.
