11.5: Мутації
- Page ID
- 3916
Цілі навчання
- Порівняйте точкові мутації та мутації зсуву кадрів
- Опишіть відмінності між міссенсом, дурницею та мовчазними мутаціями
- Опишіть відмінності між світлим і темним ремонтом
- Поясніть, як діють різні мутагени
- Поясніть, чому тест Еймса можна використовувати для виявлення канцерогенів
- Проаналізуйте послідовності ДНК і виявляйте приклади типів мутацій
Мутація - це спадкова зміна послідовності ДНК організму. Отриманий організм, званий мутантом, може мати впізнавану зміну фенотипу в порівнянні з диким типом, який є фенотипом, найбільш часто спостерігається в природі. Зміна послідовності ДНК надається мРНК через транскрипцію і може призвести до зміненої послідовності амінокислот в білку при перекладі. Оскільки білки виконують переважну більшість клітинних функцій, зміна послідовності амінокислот в білку може призвести до зміненого фенотипу для клітини та організму.
Вплив мутацій на послідовність ДНК
Існує кілька типів мутацій, які класифікуються відповідно до того, як змінюється молекула ДНК. Один тип, званий точковою мутацією, впливає на одну базу і найчастіше виникає, коли одна база підставляється або замінюється іншою. Мутації також виникають внаслідок додавання однієї або декількох основ, відомих як вставка, або видалення однієї або декількох основ, відомих як видалення.
Вправа\(\PageIndex{1}\)
Який тип мутації виникає, коли ген має на два менше нуклеотидів у своїй послідовності?
Вплив мутацій на структуру та функцію білка
Точкові мутації можуть надавати широкий спектр впливу на білкову функцію (рис.\(\PageIndex{1}\)). Як наслідок виродження генетичного коду, точкова мутація зазвичай призводить до того, що одна і та ж амінокислота буде включена в отриманий поліпептид, незважаючи на зміну послідовності. Ця зміна не вплине на структуру білка, і, таким чином, називається безшумною мутацією. Мутація missense призводить до того, що інша амінокислота включається в отриманий поліпептид. Ефект мутації missense залежить від того, наскільки хімічно відрізняється нова амінокислота від амінокислоти дикого типу. Розташування зміненої амінокислоти всередині білка також має важливе значення. Наприклад, якщо змінена амінокислота входить до складу активної ділянки ферменту, то ефект мутації міссенсу може бути значним. Багато мутації missense призводять до білків, які все ще функціональні, принаймні до певної міри. Іноді наслідки мутацій missense можуть бути очевидними лише за певних умов навколишнього середовища; такі мутації missense називаються умовними мутаціями. Рідко мутація missense може бути корисною. За правильних умов навколишнього середовища цей тип мутації може дати організму, який несе його, вибіркову перевагу. Ще один тип точкової мутації, званий мутацією дурниці, перетворює кодон, що кодує амінокислоту (кодон сенсу), в стоп-кодон (дурничий кодон). Нісенітниці мутації призводять до синтезу білків, які коротше дикого типу і зазвичай не функціональні.
Видалення та вставки також викликають різні ефекти. Оскільки кодони є триплетами нуклеотидів, вставки або видалення в групах з трьох нуклеотидів можуть призвести до введення або видалення однієї або декількох амінокислот і не можуть спричинити значного впливу на функціональність отриманого білка. Однак мутації зсуву кадрів, викликані вставками або видаленням ряду нуклеотидів, які не кратні трьом, вкрай проблематичні, оскільки зсув результатів кадру зчитування (рис.\(\PageIndex{1}\)). Оскільки рибосоми читають мРНК у триплетних кодонів, мутації зрушення кадрів можуть змінити кожну амінокислоту після точки мутації. Новий кадр читання може також включати стоп-кодон до закінчення послідовності кодування. Отже, білки, виготовлені з генів, що містять мутації зрушення кадрів, майже завжди нефункціональні.
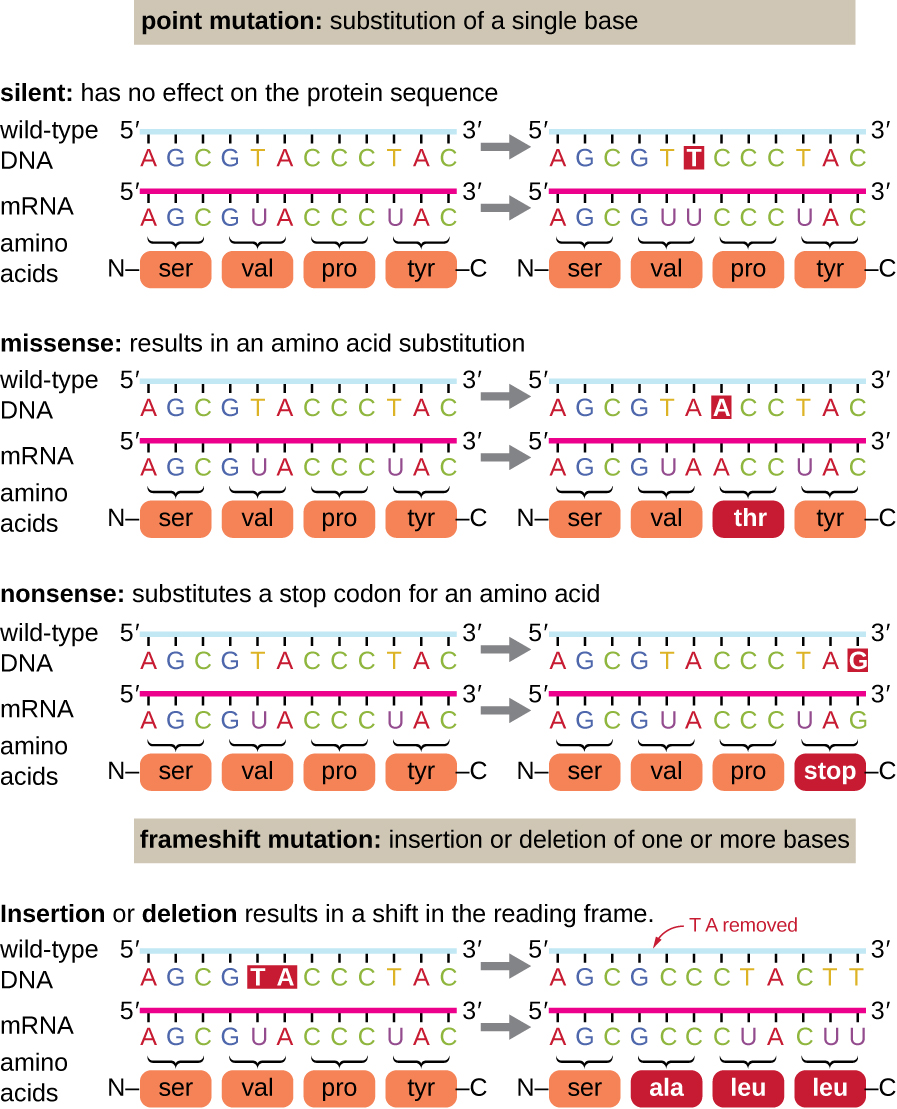
Вправа\(\PageIndex{2}\)
- Які причини зміни нуклеотидів в гені білка можуть не впливати на фенотип цього гена?
- Чи можливо введення трьох нуклеотидів разом після п'ятого нуклеотиду в гені, що кодує білок, який коротший за норму? Як чи як ні?
Корисна мутація
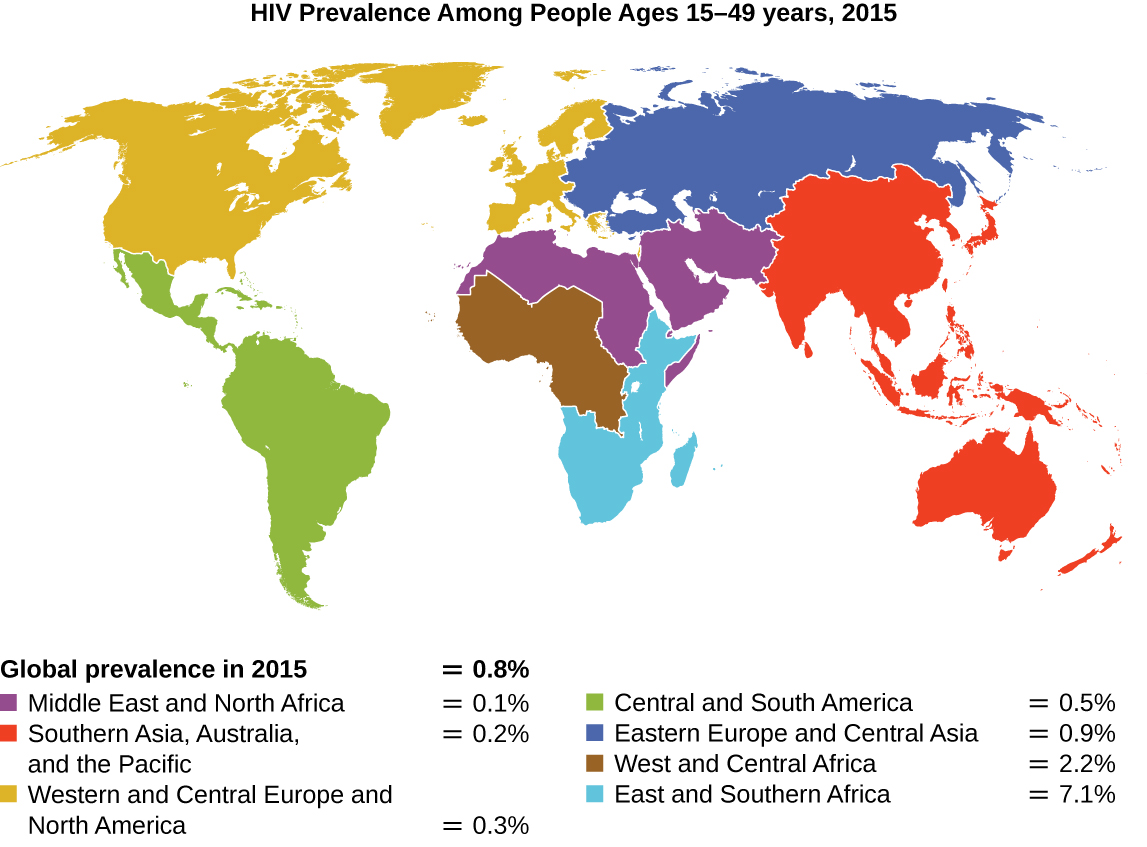
З моменту першого випадку зараження вірусом імунодефіциту людини (ВІЛ) було зареєстровано в 1981 році, майже 40 мільйонів людей померли від ВІЛ-інфекції, 1 вірус, який викликає синдром набутого імунного дефіциту (СНІД). Вірус націлений на допоміжні Т-клітини, які відіграють ключову роль у подоланні вродженої та адаптивної імунної відповіді, заражаючи та вбиваючи клітини, які зазвичай беруть участь у реакції організму на інфекцію. Не існує ліків від ВІЛ-інфекції, але розроблено багато препаратів для уповільнення або блокування прогресування вірусу. Хоча люди по всьому світу можуть бути інфіковані, найвища поширеність серед людей 15-49 років припадає на Африку на південь від Сахари, де заражена майже одна людина з 20 років, що становить понад 70% інфекцій у всьому світі 2 (рис.\(\PageIndex{2}\)). На жаль, це також частина світу, де стратегій профілактики та ліків для лікування інфекції найбільше бракує.
В останні роки науковий інтерес викликає відкриття кількох осіб з північної Європи, стійких до ВІЛ-інфекції. У 1998 році американський генетик Стівен О'Брайен з Національного інституту охорони здоров'я (NIH) і його колеги опублікували результати свого генетичного аналізу понад 4000 осіб. Вони вказували на те, що багато особин євразійського походження (до 14% в деяких етнічних групах) мають мутацію делеції, звану CCR5-Delta 32, в гені, що кодує CCR5. CCR5 - це корецептор, виявлений на поверхні Т-клітин, який необхідний багатьом штамам вірусу для проникнення в клітину-господаря. Мутація призводить до вироблення рецептора, до якого ВІЛ не може ефективно зв'язуватися і тим самим блокує вірусне проникнення. Люди, гомозиготні для цієї мутації, значно знизили сприйнятливість до ВІЛ-інфекції, а ті, хто гетерозиготний, також мають певний захист від інфекції.
Незрозуміло, чому люди північноєвропейського походження, зокрема, переносять цю мутацію, але її поширеність, здається, найвища в північній Європі і неухильно зменшується в популяціях, коли рухається на південь. Дослідження показують, що мутація була присутня ще до появи ВІЛ і, можливо, була відібрана для європейського населення внаслідок впливу чуми або віспи. Ця мутація може захистити людей від чуми (спричиненої бактерією Yersinia pestis) та віспи (спричиненої вірусом варіоли), оскільки цей рецептор також може бути залучений до цих захворювань. Вік цієї мутації є предметом дискусій, але, за оцінками, вона з'явилася між 1875 роками і 225 роками тому, і, можливо, була поширена з Північної Європи через вторгнення вікінгів.
Ця захоплююча знахідка призвела до нових шляхів дослідження ВІЛ, включаючи пошук препаратів для блокування прив'язки CCR5 до ВІЛ у осіб, яким бракує мутації. Хоча тестування ДНК для визначення того, які особи несуть мутацію CCr5-Delta 32, можливо, є задокументовані випадки гомозиготних осіб для мутації, що заражаються ВІЛ. З цієї причини ДНК-тестування на мутацію широко не рекомендується чиновниками охорони здоров'я, щоб не заохочувати ризиковану поведінку у тих, хто несе мутацію. Тим не менш, інгібування зв'язування ВІЛ з CCR5 продовжує залишатися дійсною стратегією розвитку медикаментозної терапії для інфікованих ВІЛ.
причини мутацій
Помилки в процесі реплікації ДНК можуть викликати спонтанні мутації. Частота помилок ДНК-полімерази - це одна неправильна база на мільярд пар основ, реплікованих. Вплив мутагенів може викликати індуковані мутації, якими є різні види хімічних агентів або випромінювання (табл.\(\PageIndex{1}\)). Вплив мутагену може збільшити швидкість мутації більш ніж в 1000 разів. Мутагени часто також є канцерогенами, агентами, що викликають рак. Однак, хоча майже всі канцерогени є мутагенними, не всі мутагени обов'язково є канцерогенами.
Хімічні мутагени
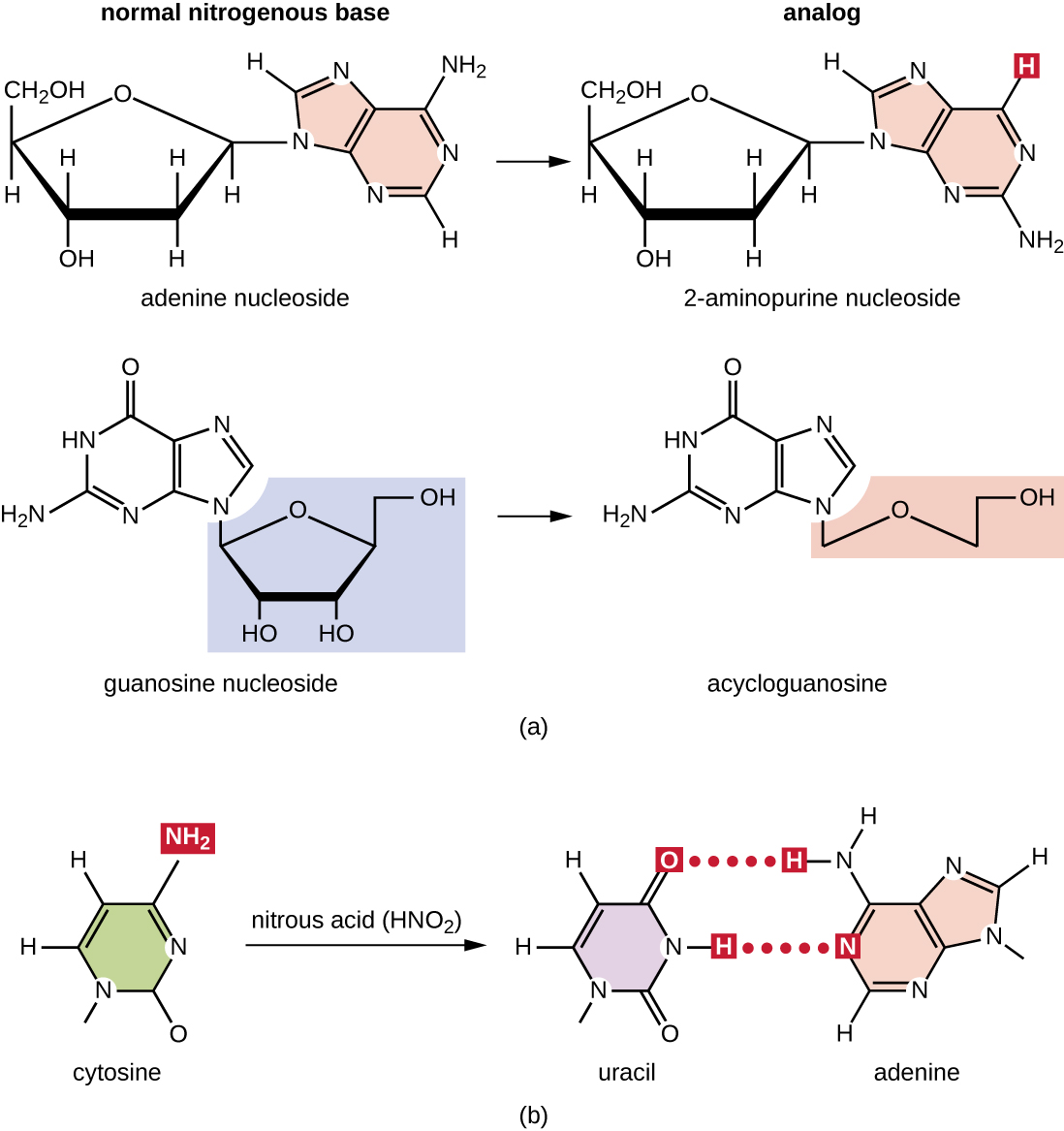
Різні типи хімічних мутагенів взаємодіють безпосередньо з ДНК або діючи як нуклеозидні аналоги, або модифікуючи нуклеотидні основи. Хімічні речовини, звані нуклеозидними аналогами, структурно схожі з нормальними нуклеотидними основами і можуть бути включені в ДНК під час реплікації (рис.\(\PageIndex{3}\)). Ці базові аналоги викликають мутації, оскільки вони часто мають різні правила сполучення основ, ніж основи, які вони замінюють. Інші хімічні мутагени можуть змінювати нормальні основи ДНК, що призводить до різних правил сполучення основ. Наприклад, азотна кислота знешкоджує цитозин, перетворюючи його в урацил. Потім урацил поєднується з аденіном в наступному раунді реплікації, що призводить до перетворення базової пари GC в базову пару AT. Азотна кислота також дезамінує аденін до гіпоксантину, який створює пари з цитозином замість тиміну, що призводить до перетворення базової пари TA в базову пару CG.
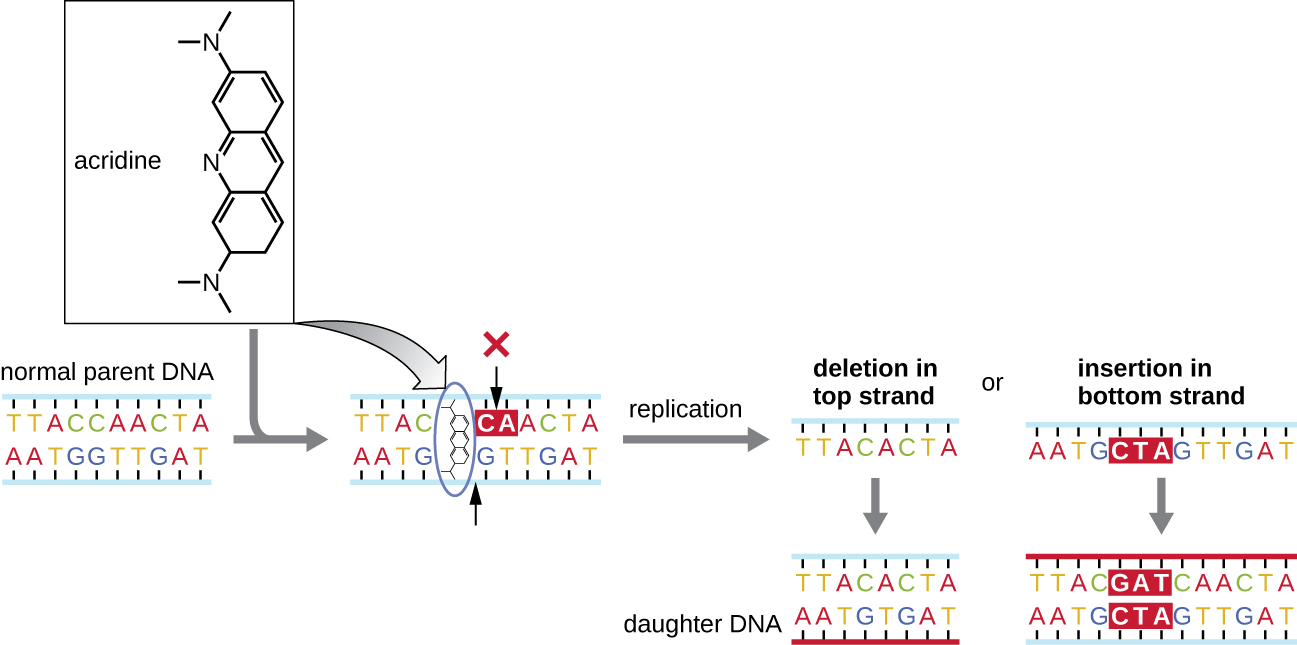
Хімічні мутагени, відомі як інтеркалятори, працюють по-різному. Ці молекули ковзають між укладеними азотистими основами подвійної спіралі ДНК, спотворюючи молекулу і створюючи нетиповий інтервал між парами нуклеотидних основ (рис.\(\PageIndex{4}\)). В результаті під час реплікації ДНК ДНК-полімераза може або пропустити реплікацію декількох нуклеотидів (створюючи делецію), або вставляти зайві нуклеотиди (створюючи вставку). Будь-який результат може призвести до мутації зсуву кадрів. Продукти горіння, такі як поліциклічні ароматичні вуглеводні, є особливо небезпечними інтеркаляторами, які можуть призвести до раку, спричиненого мутацією. Інтеркаляційні агенти бромід етидію та акридин апельсин зазвичай використовуються в лабораторії для фарбування ДНК для візуалізації та є потенційними мутагенами.
Радіація
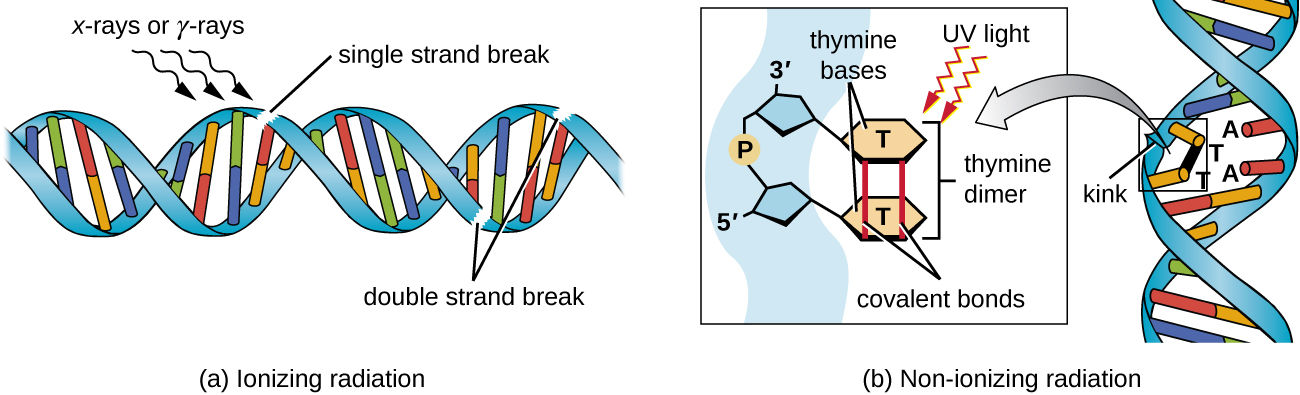
Вплив іонізуючого або неіонізуючого випромінювання може викликати мутації в ДНК, хоча і за допомогою різних механізмів. Сильне іонізуюче випромінювання, таке як рентгенівські та гамма-промені, може викликати одно- і дволанцюгові розриви в магістралі ДНК через утворення гідроксильних радикалів при опроміненні (рис.\(\PageIndex{5}\)). Іонізуюче випромінювання також може модифікувати основи; наприклад, дезамінація цитозину на урацил, аналогічний дії азотної кислоти. 3 Іонізуюче опромінення використовується для знищення мікробів для стерилізації медичних виробів та харчових продуктів через його драматичний неспецифічний ефект у пошкодженні ДНК, білків та інших клітинних компонентів (див. Використання фізичних методів для боротьби з мікроорганізмами).
Неіонізуюче випромінювання, як і ультрафіолетове світло, недостатньо енергійне, щоб ініціювати ці типи хімічних змін. Однак неіонізуюче випромінювання може викликати утворення димеру між двома сусідніми піримідиновими основами, як правило, двома тимінами, всередині нуклеотидної нитки. Під час формування тимінового димеру два сусідніх тиміну стають ковалентно пов'язаними, і, якщо їх залишити без ремонту, як реплікація ДНК, так і транскрипція зупиняються на цьому етапі. ДНК-полімераза може протікати і відтворювати димер неправильно, що потенційно призводить до зрушення кадрів або точкових мутацій.
| Мутагенні агенти | Режим дії | Вплив на ДНК | Отриманий тип мутації |
|---|---|---|---|
| аналоги нуклеозидів | |||
| 2-аміносерина | Вставляється замість А, але базові пари з C | Перетворює AT на базову пару GC | Точка |
| 5-бромурацил | Вставляється замість T, але базові пари з G | Перетворює AT на базову пару GC | Точка |
| Нуклеотид-модифікуючий агент | |||
| закис азоту | Перезначає C до U | Перетворює GC в базову пару AT | Точка |
| Інтеркаляційні агенти | |||
| Акридин апельсин, бромід етидію, поліциклічні ароматичні вуглеводні | Спотворює подвійну спіраль, створює незвичайний інтервал між нуклеотидами | Вводить невеликі вилучення та вставки | Зсув кадру |
| Іонізуюче випромінювання | |||
| Рентген, γ-промені | Утворює гідроксильні радикали | Викликає одно- і двониткові розриви ДНК | Ремонтні механізми можуть вводити мутації |
| Рентген, γ-промені | Модифікує основи (наприклад, демінізація C до U) | Перетворює GC в базову пару AT | Точка |
| Неіонізуюче випромінювання | |||
| ультрафіолет | Утворює піримідинові (зазвичай тимінові) димери | Причини помилок реплікації ДНК | Зсув кадру або точка |
Вправа\(\PageIndex{3}\)
- Як базовий аналог вводить мутацію?
- Як інтеркаляційний агент вводить мутацію?
- Який тип мутагену викликає тимінові димери?
Ремонт ДНК
Процес реплікації ДНК є високоточним, але помилки можуть відбуватися спонтанно або бути викликані мутагенами. Невиправлені помилки можуть призвести до серйозних наслідків для фенотипу. Клітини розробили кілька механізмів відновлення, щоб мінімізувати кількість мутацій, які зберігаються.
Коректура
Більшість помилок, допущених під час реплікації ДНК, оперативно виправляються більшістю ДНК-полімераз за допомогою функції, яка називається коректурою. При коректурі ДНК-полімераза зчитує знову додану основу, гарантуючи, що вона доповнює відповідну основу в шаблоні нитка перед додаванням наступної. Якщо була додана неправильна основа, фермент робить розріз, щоб вивільнити неправильний нуклеотид і додається нова основа.
Невідповідність Ремонт
Деякі помилки, введені під час реплікації, виправляються незабаром після того, як машина реплікації перемістилася. Цей механізм називається невідповідністю ремонту. Ферменти, що беруть участь в цьому механізмі, розпізнають неправильно доданий нуклеотид, висікають його і замінюють правильною основою. Одним із прикладів є метил-спрямоване відновлення невідповідності в кишковій паличці. ДНК геміметильована. Це означає, що батьківська пасмо метилюється, тоді як знову синтезована дочірня нитка - ні. Пройде кілька хвилин, перш ніж нова пасмо буде метилирована. Білки MUTs, mUTl та MuTH зв'язуються з геміметильованим сайтом, де виявлено неправильний нуклеотид. Мут зрізає неметилірованную пасмо (нову пасмо). Екзонуклеаза видаляє частину пасма (включаючи неправильний нуклеотид). Потім утворилася щілина заповнюється ДНК пол III і лігаза.
Ремонт тимінових димерів
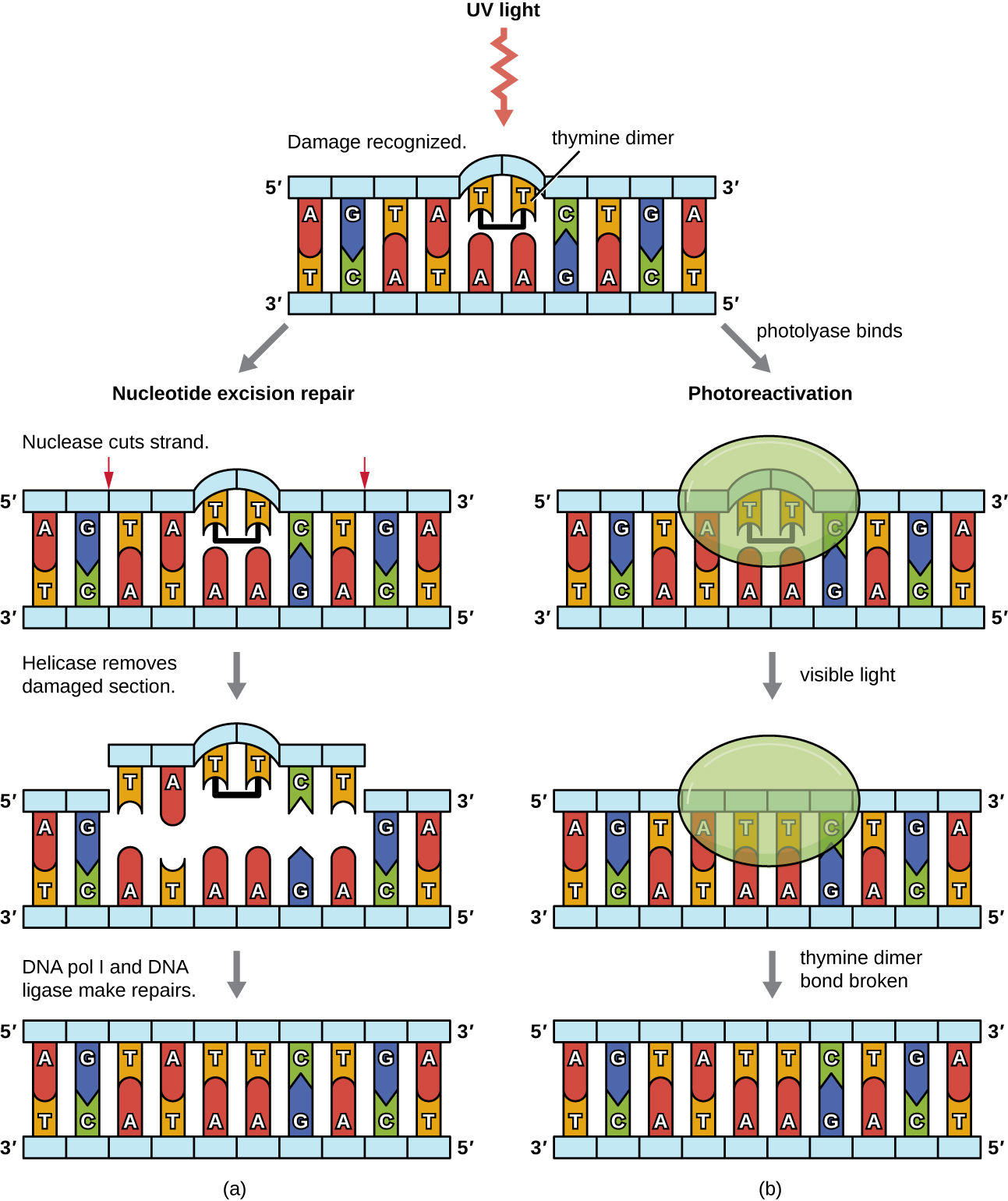
Оскільки вироблення тимінових димерів є загальним явищем (багато організмів не можуть уникнути ультрафіолету), механізми еволюціонували для відновлення цих уражень. При відновленні висічення нуклеотидів (також званий темним відновленням) ферменти видаляють піримідиновий димер і замінюють його правильними нуклеотидами (рис.\(\PageIndex{6}\)). У кишкової палички ДНК сканується ферментним комплексом. Якщо виявлено спотворення в подвійній спіралі, яке було введено піримідиновим димером, ферментний комплекс розрізає цукрово-фосфатну магістраль на кілька основ вище за течією і нижче за течією димера, а сегмент ДНК між цими двома розрізами потім ферментативно видаляється. ДНК-пол I замінює відсутні нуклеотиди правильними, а ДНК-лігаза ущільнює щілину в цукрово-фосфатній кістці.
Прямий ремонт (також званий світловим ремонтом) тимінових димерів відбувається через процес фотореактивації в присутності видимого світла. Фермент під назвою фотоліаза розпізнає спотворення в спіралі ДНК, викликане тиміновим димером, і зв'язується з димером. Потім, у присутності видимого світла, фермент фотоліази змінює конформацію і розбиває тиміновий димер, дозволяючи тимінам знову правильно базувати пару з аденінами на додатковій пасма. Фотореактивація, здається, присутня у всіх організмах, за винятком плацентарних ссавців, включаючи людину. Фотореактивація особливо важлива для організмів, які хронічно піддаються впливу ультрафіолетового випромінювання, таких як рослини, фотосинтетичні бактерії, водорості та корали, щоб запобігти накопиченню мутацій, спричинених утворенням тимінового димера.
Вправа\(\PageIndex{4}\)
- Під час ремонту невідповідності, як фермент розпізнає, яка нова, а яка - стара пасмо?
- Який тип мутації ремонтує фотоліаза?
Визначення бактеріальних мутантів
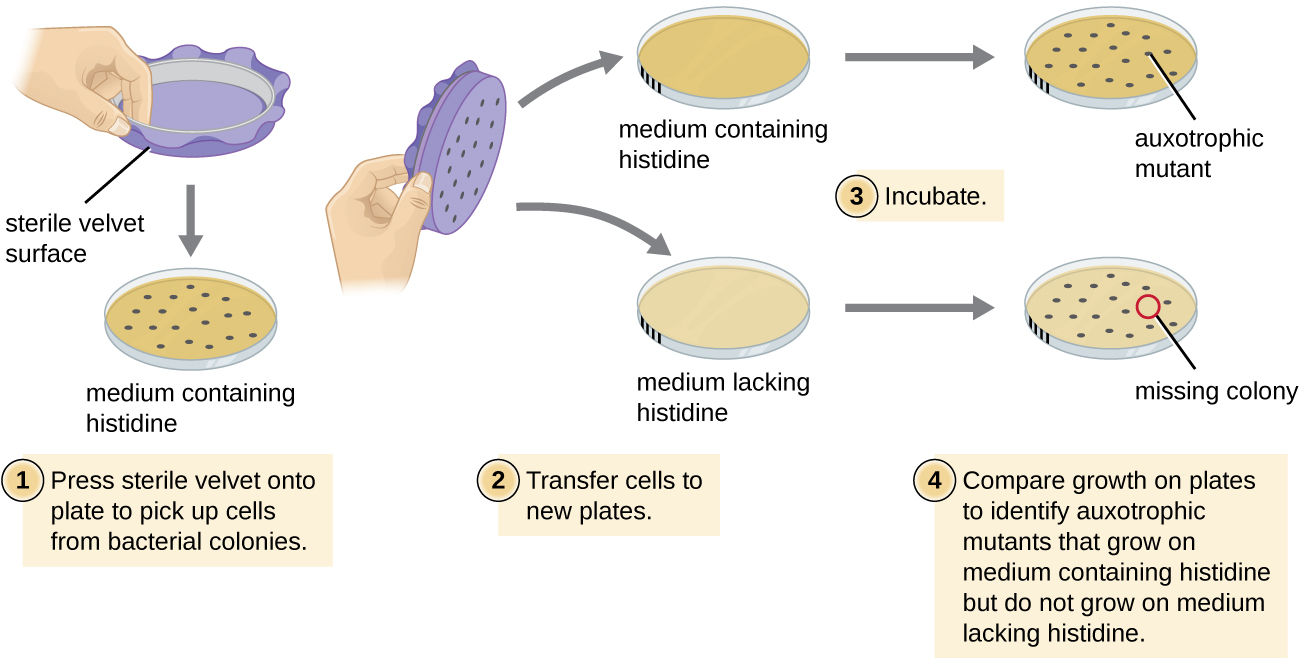
Один поширений метод, який використовується для ідентифікації бактеріальних мутантів, називається репліка покриття. Ця методика використовується для виявлення поживних мутантів, званих ауксотрофами, які мають мутацію в гені, що кодує фермент на шляху біосинтезу певної поживної речовини, наприклад амінокислоти. В результаті, тоді як клітини дикого типу зберігають здатність нормально рости на середовищі, де бракує специфічної поживної речовини, ауксотрофи не здатні рости на такому середовищі. Під час покриття репліки (рис.\(\PageIndex{7}\)) популяція бактеріальних клітин мутагенізується, а потім покривається як окремі клітини на складній поживно повній пластині і дозволяє рости в колонії. Клітини з цих колоній видаляють з цієї майстер-пластини, часто використовуючи стерильний оксамит. Цей оксамит, що містить осередки, потім пресується в тій же орієнтації на пластини різних середовищ. Принаймні одна тарілка також повинна бути повноцінною поживною, щоб забезпечити належне перенесення клітин між пластинами. Іншим пластинам не вистачає специфічних поживних речовин, що дозволяє досліднику виявити різні ауксотрофні мутанти, нездатні виробляти конкретні поживні речовини. Клітини з відповідної колонії на поживно повній пластинці можуть бути використані для відновлення мутанта для подальшого вивчення.
Вправа\(\PageIndex{5}\)
Чому клітини наносяться на повноцінну поживну пластину на додаток до пластин з дефіцитом поживних речовин при пошуку мутанта?
Тест Еймса
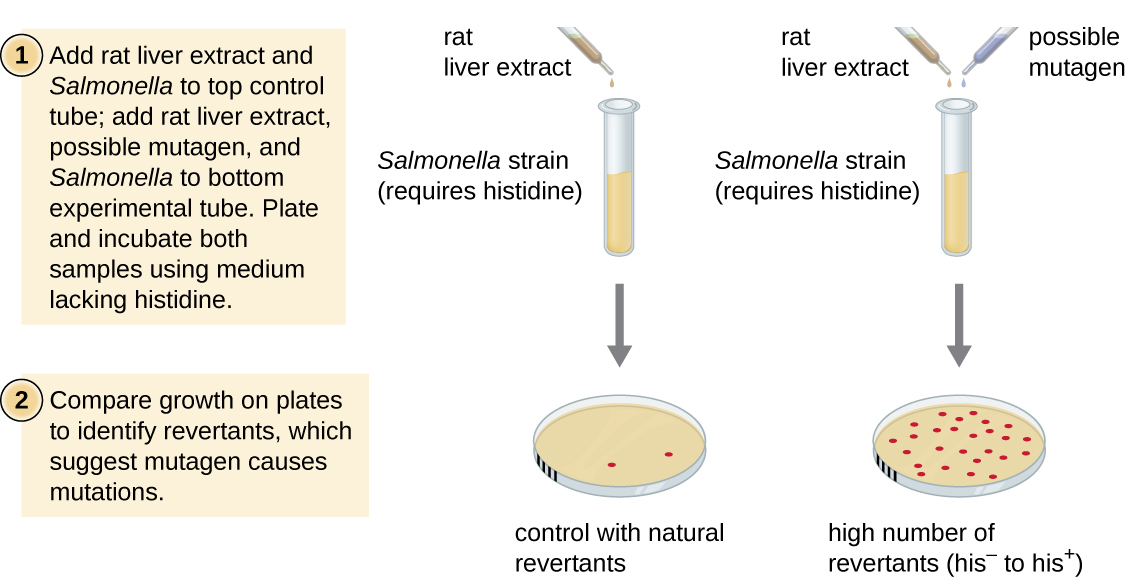
Тест Еймса, розроблений Брюсом Еймсом (1928—) у 1970-х роках, є методом, який використовує бактерії для швидкого, недорогого скринінгу канцерогенного потенціалу нових хімічних сполук. Тест вимірює швидкість мутації, пов'язану з впливом сполуки, яка, якщо підвищена, може свідчити про те, що вплив цієї сполуки пов'язане з більшим ризиком раку. Тест Еймса використовує в якості тестового організму штам Salmonella typhimurium, який є ауксотрофом гістидину, не здатний синтезувати власний гістидин через мутацію в необхідному гені, необхідному для його синтезу. Після впливу потенційного мутагену ці бактерії наносяться на середовище, в якій бракує гістидину, і реєструється кількість мутантів, що відновлюють здатність синтезувати гістидин, і порівнюють з кількістю таких мутантів, що виникають при відсутності потенційного мутагену (рис.\(\PageIndex{8}\)). Хімічні речовини, які є більш мутагенними, призведуть до більшої кількості мутантів з відновленим синтезом гістидину в тесті Еймса. Оскільки багато хімічних речовин не є безпосередньо мутагенними, але метаболізуються до мутагенних форм печінковими ферментами, екстракт печінки щурів зазвичай включається на початку цього експерименту для імітації метаболізму печінки. Після проведення тесту Еймса сполуки, ідентифіковані як мутагенні, додатково перевіряються на їх потенційні канцерогенні властивості за допомогою інших моделей, включаючи моделі тварин, такі як миші та щури.
Вправа\(\PageIndex{6}\)
- Яка мутація використовується як показник швидкості мутації в тесті Еймса?
- Чому тест Еймса може працювати як тест на канцерогенність?
Ключові поняття та резюме
- Мутація - це спадкова зміна ДНК. Мутація може призвести до зміни амінокислотної послідовності білка, можливо впливаючи на його функцію.
- Точкова мутація впливає на одну базову пару. Точкова мутація може спричинити безшумну мутацію, якщо кодон мРНК кодує ту ж амінокислоту, мутацію missense, якщо кодон мРНК кодів для іншої амінокислоти, або мутацію нісенсу, якщо кодон мРНК стає стоп-кодоном.
- Missense мутації можуть зберігати функцію, в залежності від хімії нової амінокислоти і її розташування в білку. Нісенітниці мутації виробляють усічені і часто нефункціональні білки.
- Мутація зрушення кадру виникає внаслідок введення або видалення ряду нуклеотидів, що не кратне трьом. Зміна кадру читання змінює кожну амінокислоту після точки мутації і призводить до нефункціонального білка.
- Спонтанні мутації відбуваються через помилки реплікації ДНК, тоді як індуковані мутації відбуваються через вплив мутагену.
- Мутагенні агенти часто є канцерогенними, але не завжди. Однак майже всі канцерогени є мутагенними.
- До хімічних мутагенів відносяться базові аналоги і хімічні речовини, що модифікують існуючі основи. В обох випадках мутації вводяться після декількох раундів реплікації ДНК.
- Іонізуюче випромінювання, таке як рентгенівські промені та γ-промені, призводить до поломки основи фосфодіефіру ДНК, а також може хімічно модифікувати основи, щоб змінити правила сполучення основи.
- Неіонізуюче випромінювання, як ультрафіолетове світло, може вводити піримідинові (тимінові) димери, які під час реплікації та транскрипції ДНК можуть вводити зрушення кадрів або точкові мутації.
- Клітини мають механізми відновлення мутацій, що відбуваються в природі. ДНК-полімераза має коректорську активність. Ремонт невідповідності - це процес відновлення неправильно вбудованих баз після завершення реплікації ДНК.
- Піримідинові димери також можуть бути відремонтовані. При відновленні висічення нуклеотидів (темний ремонт) ферменти розпізнають спотворення, введене піримідиновим димером, і замінюють пошкоджену нитку правильними основами, використовуючи неушкоджену нитку ДНК як шаблон. Бактерії та інші організми також можуть використовувати прямий ремонт, при якому фермент фотоліази при наявності видимого світла розщеплює піримідини.
- Через порівняння зростання на повній платівці та відсутності росту на середовищах, що не мають специфічних поживних речовин, можна визначити специфічні мутанти втрати функції, які називаються ауксотрофами.
- Тест Еймса - це недорогий метод, який використовує ауксотрофні бактерії для вимірювання мутагенності хімічної сполуки. Мутагенність - показник канцерогенного потенціалу.
Виноски
- 1 Всесвітня організація охорони здоров'я «Глобальна обсерваторія охорони здоров'я (GHO) Дані, ВІЛ/СНІД». http://www.who.int/gho/hiv/en/. Доступ до 5 серпня 2016 року.
- 2 Всесвітня організація охорони здоров'я «Глобальна обсерваторія охорони здоров'я (GHO) Дані, ВІЛ/СНІД». http://www.who.int/gho/hiv/en/. Доступ до 5 серпня 2016 року.
- 3 К.Р. Тіндалл та ін. «Зміни базової послідовності ДНК, спричинені гамма-мутагенезом лямбда-фагів та профагів». Генетика 118 № 4 (1988) :551—560.
