11.4: Синтез білка (переклад)
- Page ID
- 3913
Цілі навчання
- Опишіть генетичний код і поясніть, чому він вважається практично універсальним.
- Поясніть процес перекладу та функції молекулярної машини перекладу
- Порівняйте переклад у еукаріотів і прокаріотів
Синтез білків споживає більше енергії клітини, ніж будь-який інший метаболічний процес. У свою чергу, на білки припадає більша маса, ніж будь-яка інша макромолекула живих організмів. Вони виконують практично кожну функцію клітини, виступаючи як функціональними (наприклад, ферментами), так і структурними елементами. Процес трансляції, або синтезу білка, другої частини експресії генів, передбачає декодування рибосомою повідомлення мРНК в поліпептидний продукт.
Генетичний код
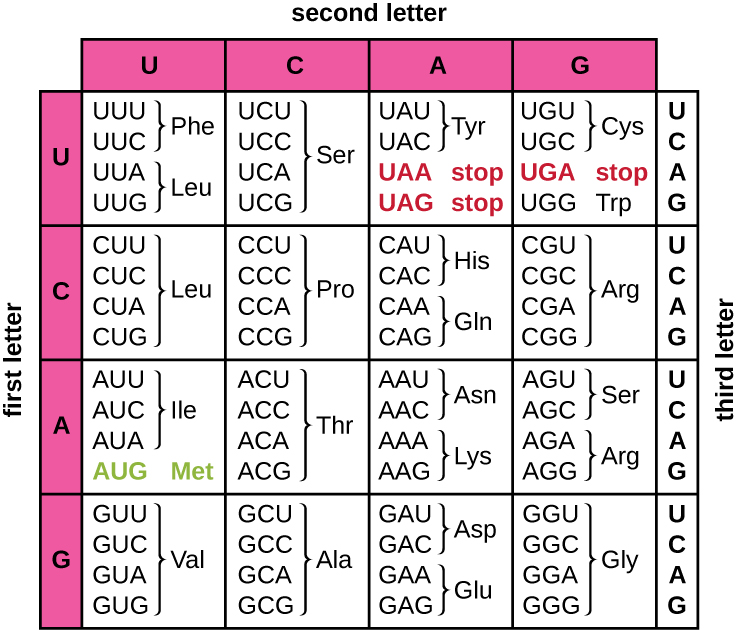
Переклад шаблону мРНК перетворює генетичну інформацію на основі нуклеотидів в «мову» амінокислот для створення білкового продукту. Білкова послідовність складається з 20 часто зустрічаються амінокислот. Кожна амінокислота визначається всередині мРНК триплетом нуклеотидів, званих кодоном. Зв'язок між кодоном мРНК і відповідною йому амінокислотою називається генетичним кодом.
Тринуклеотидний код означає, що існує загалом 64 можливі комбінації (4 3, з чотирма різними нуклеотидами, можливими на кожному з трьох різних положень всередині кодону). Це число більше, ніж кількість амінокислот і дана амінокислота кодується більш ніж одним кодоном (рис.\(\PageIndex{1}\)). Така надмірність в генетичному коді називається виродженням. Як правило, в той час як перші дві позиції в кодоні важливі для визначення того, яка амінокислота буде включена в зростаючий поліпептид, третя позиція, яка називається коливанням положення, є менш критичною. У деяких випадках, якщо нуклеотид в третій позиції змінюється, все ж включається та ж амінокислота.
Тоді як 61 з 64 можливих триплетів коду для амінокислот, три з 64 кодонів не кодують для амінокислоти; вони припиняють синтез білка, вивільняючи поліпептид з машини перекладу. Вони називаються стоп-кодон s або дурниця codon s. Ще один кодон, AUG, також має особливу функцію. На додаток до визначення амінокислоти метіонін, він також зазвичай служить початковим кодоном для ініціювання перекладу. Кадр зчитування, спосіб нуклеотиди в мРНК згруповані в кодони, для перекладу встановлюється стартовим кодоном AUG поблизу 5' кінця мРНК. Кожен набір з трьох нуклеотидів після цього початкового кодону є кодоном у повідомленні мРНК.
Генетичний код майже універсальний. За кількома винятками, практично всі види використовують один і той же генетичний код для синтезу білка, що є потужним доказом того, що все існуюче життя на землі має спільне походження. Однак у архей та бактерій спостерігалися незвичайні амінокислоти, такі як селеноцистеїн та піролізин. У випадку селеноцистеїну використовується кодон UGA (зазвичай стоп-кодон). Однак UGA може кодувати селеноцистеїн, використовуючи структуру стовбурової петлі (відому як послідовність вставки селеноцистеїну або елемент SECIS), яка знаходиться в 3-футовій неперекладеній області мРНК. Піролізин використовує інший стоп-кодон, UAG. Для включення піролізину потрібен ген PylS та унікальна трансферна РНК (тРНК) з антикодоном CUA.
Вправа\(\PageIndex{1}\)
- Скільки основ в кожному кодоні?
- Яка амінокислота закодована кодоном AAU?
- Що відбувається при досягненні стоп-кодону?
Машини синтезу білка
Крім шаблону мРНК, багато молекули і макромолекули сприяють процесу трансляції. Склад кожного компонента змінюється в залежності від таксомів; наприклад, рибосоми можуть складатися з різної кількості рибосомних РНК (РРНК) і поліпептидів залежно від організму. Однак загальні структури та функції механізмів синтезу білка можна порівняти від бактерій до клітин людини. Переклад вимагає введення шаблону мРНК, рибосом, тРНК та різних ферментативних факторів.
Рибосоми
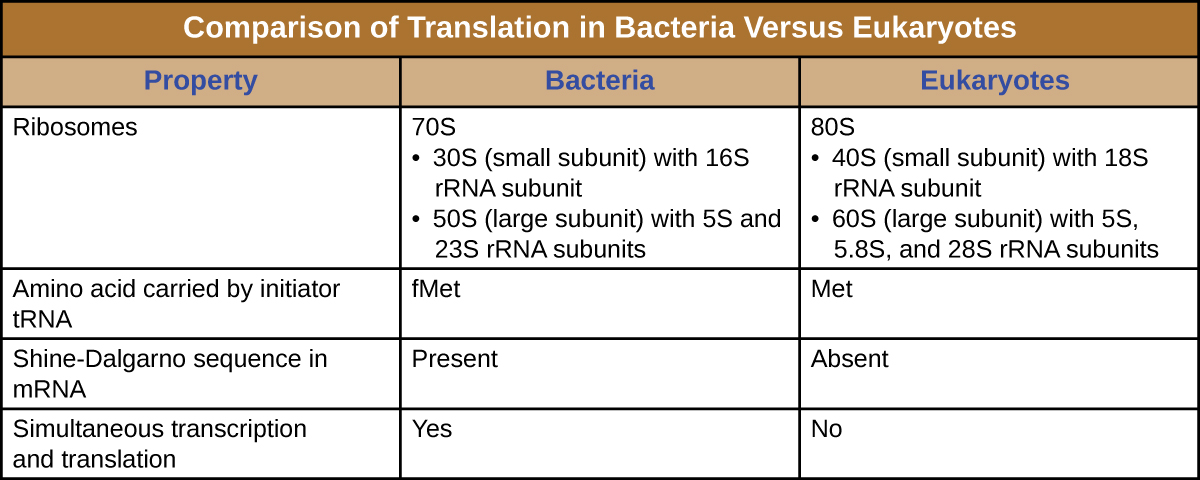
Рибосома - це складна макромолекула, що складається з каталітичних РРНК (званих рибоцимами) та структурних РРНК, а також багатьох різних поліпептидів. Зрілі РРНК складають приблизно 50% кожної рибосоми. Прокаріоти мають 70-ті рибосоми, тоді як еукаріоти мають 80S рибосоми в цитоплазмі і шорсткий ендоплазматичний ретикулум, а 70-ті рибосоми в мітохондріях і хлоропластах. Рибосоми дисоціюються на великі і малі субодиниці, коли вони не синтезують білки і реассоціюються під час ініціації трансляції. У кишковій паличці мала субодиниця описується як 30S (яка містить субодиницю 16S рРНК), а велика субодиниця - 50S (яка містить субодиниці 5S та 23S рРНК), загалом 70S (одиниці Сведберга не є адитивними). Рибосоми еукаріота мають невелику субодиницю 40S (яка містить субодиницю 18S рРНК) та велику субодиницю 60S (яка містить субодиниці 5S, 5.8S та 28S рРНК), загалом 80S. Мала субодиниця відповідає за зв'язування шаблону мРНК, тоді як велика субодиниця зв'язує тРНК (розглянуто в наступному підрозділі).
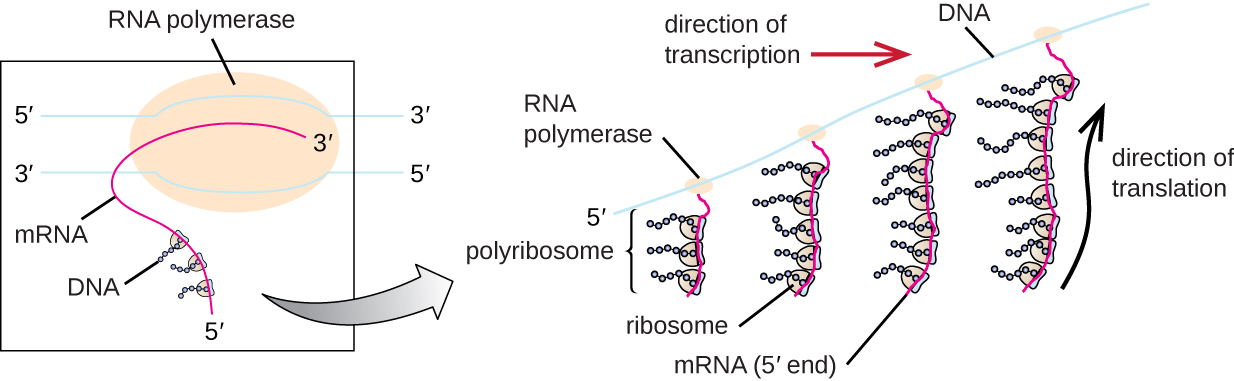
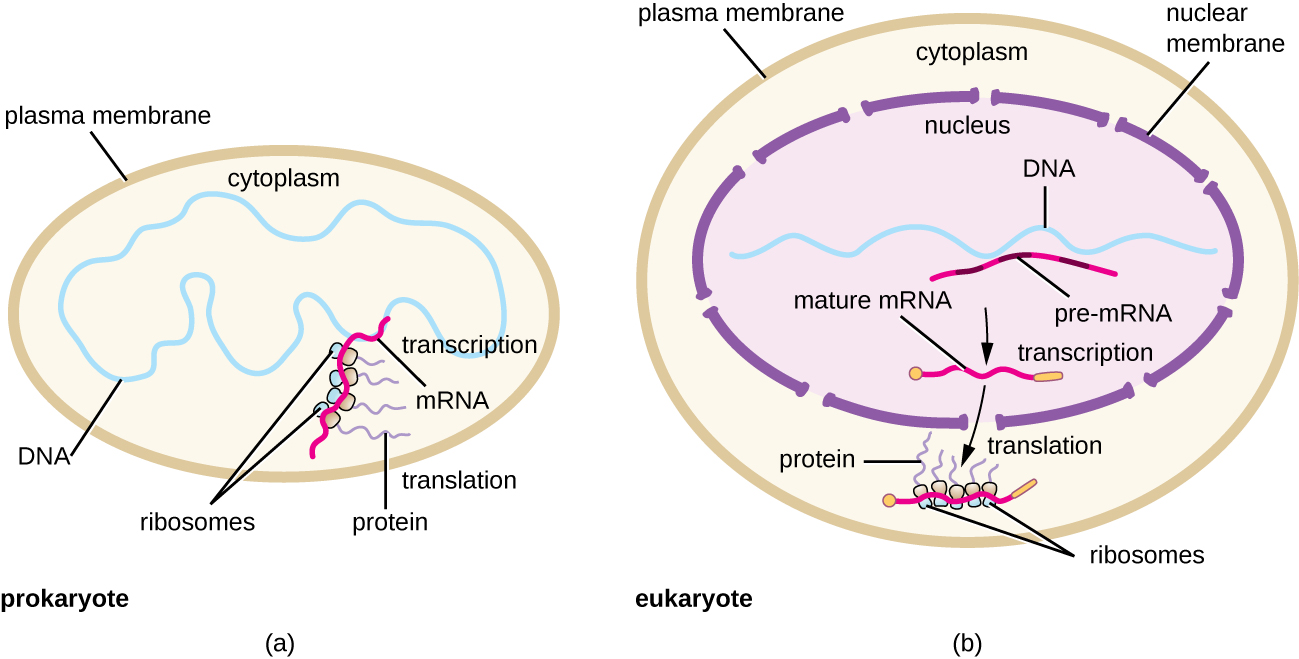
Кожна молекула мРНК одночасно перекладається багатьма рибосомами, всі синтезують білок в одному напрямку: зчитуючи мРНК від 5' до 3' і синтезуючи поліпептид від N кінцевої до закінчення С. Повна структура, що містить мРНК з множинними асоційованими рибосомами, називається полірибосомою (або полісомою). Як у бактерій, так і в архей, перш ніж відбувається припинення транскрипції, кожна транскрипція, що кодує білок, вже використовується для початку синтезу численних копій закодованого поліпептиду (ів), оскільки процеси транскрипції та транскрипції можуть відбуватися одночасно, утворюючи полірибосоми (рис. \(\PageIndex{2}\)). Причина, чому транскрипція та переклад можуть відбуватися одночасно, полягає в тому, що обидва ці процеси відбуваються в одному напрямку 5' до 3', вони обидва відбуваються в цитоплазмі клітини, і тому, що стенограма РНК не обробляється після її транскрибування. Це дозволяє прокаріотичної клітині дуже швидко реагувати на сигнал навколишнього середовища, що вимагає нових білків. На відміну від цього, в клітині еукаріот одночасна транскрипція і переклад неможливі. Хоча полірибосоми також утворюються в еукаріотах, вони не можуть цього зробити, поки синтез РНК не завершиться і молекула РНК не буде модифікована та транспортована з ядра.
Перенесення РНК
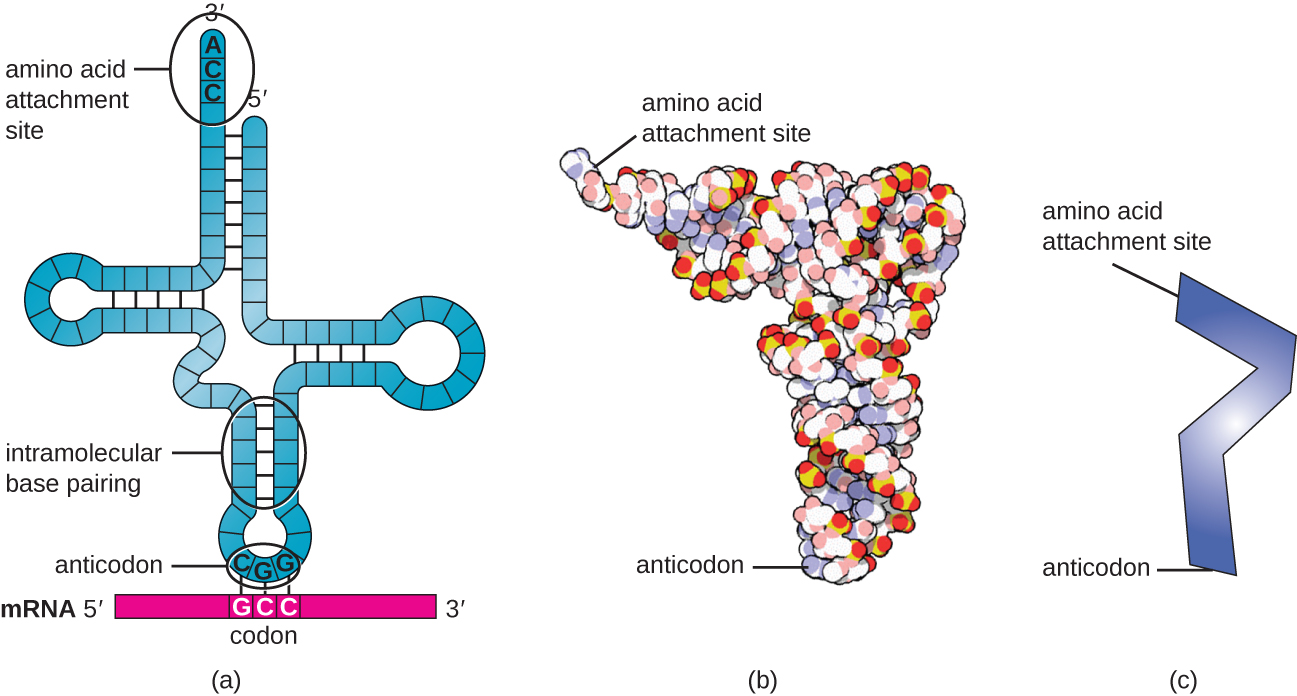
Трансферні РНК (ТРНК) - це структурні молекули РНК, і, залежно від виду, в цитоплазмі існує безліч різних типів ТРНК. Бактеріальні види зазвичай мають від 60 до 90 типів. Виконуючи роль адаптерів, кожен тип тРНК зв'язується з певним кодоном на шаблоні мРНК і додає відповідну амінокислоту в поліпептидний ланцюг. Тому тРНК - це молекули, які насправді «переводять» мову РНК на мову білків. Як адаптерні молекули перекладу, дивно, що тРНК можуть вмістити стільки специфічності в такий невеликий пакет. Молекула тРНК взаємодіє з трьома факторами: аміноацильними тРНК синтетазами, рибосомами та мРНК.
Зрілі тРНК набувають тривимірну структуру, коли комплементарні основи піддаються впливу в одножильних молекулах РНК водневого зв'язку між собою (рис.\(\PageIndex{3}\)). Ця форма позиціонує місце зв'язування амінокислот, званий кінцем зв'язування амінокислот CCA, який є послідовністю цитозин-цитозин-аденін на 3' кінці тРНК, а антикодонат на іншому кінці. Антикодон - це тринуклеотидна послідовність, яка зв'язується з кодоном мРНК шляхом комплементарного сполучення основи.
Амінокислота додається до кінця молекули тРНК через процес «зарядки» тРНК, під час якого кожна молекула тРНК пов'язана зі своєю правильною або когнатною амінокислотою групою ферментів, званих аміноацильними тРНК синтетазами. Принаймні один тип аміноацильної тРНК синтетази існує для кожної з 20 амінокислот. Під час цього процесу амінокислота спочатку активується додаванням аденозинмонофосфату (АМФ), а потім переноситься в тРНК, роблячи її зарядженою тРНК, і AMP вивільняється.
Вправа\(\PageIndex{2}\)
- Опишіть будову і склад прокаріотичної рибосоми.
- В якому напрямку читається шаблон мРНК?
- Опишіть структуру та функцію тРНК.
Механізм синтезу білка
Переклад подібний у прокаріотів і еукаріот. Тут ми вивчимо, як відбувається переклад кишкової палички, представника прокаріота, і уточнимо будь-які відмінності між бактеріальним та еукаріотичним перекладом.
Ініціація
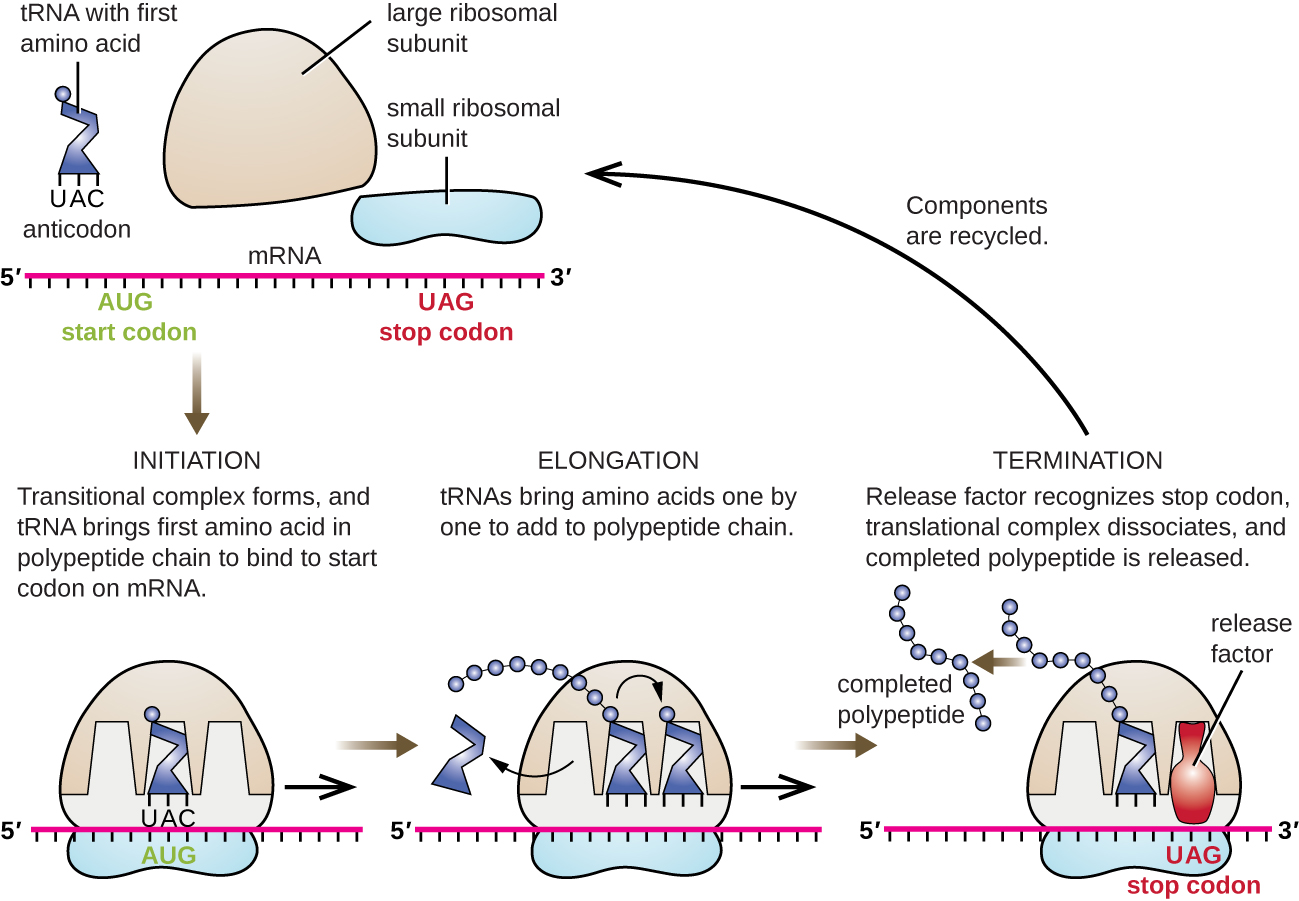
Ініціювання синтезу білка починається з формування комплексу ініціації. У кишковій паличці цей комплекс включає невелику рибосому 30S, шаблон мРНК, три фактори ініціації, які допомагають рибосомі правильно збиратися, гуанозинтрифосфат (GTP), який діє як джерело енергії, і спеціальний ініціатор тРНК, що несе N -форміл-метіонін (FMET-тРНК) ) (Малюнок\(\PageIndex{4}\)). Ініціатор тРНК взаємодіє з початковим кодоном AUG мРНК і несе формульований метіонін (fMet). Через свою участь у ініціації FMEt вставляється на початку (N кінцевий) кожного поліпептидного ланцюга, синтезованого кишковою паличкою. У мРНК кишкової палички, провідна послідовність вище за течією першого кодону AUG, звана послідовністю Shine-Dalgarno (також відомою як рибосомальний сайт зв'язування AGGAGG), взаємодіє через взаємодоповнюючу базу спаровування з молекулами рРНК, що складають рибосому. Ця взаємодія закріплює рибосомну субодиницю 30S у правильному місці на шаблоні мРНК. У цей момент рибосомна субодиниця 50S потім зв'язується з комплексом ініціації, утворюючи інтактну рибосому.
У еукаріотів формування комплексу ініціації схоже, з наступними відмінностями:
- Ініціатором тРНК є інша спеціалізована тРНК, що несе метіонін, званий мет-ТРНК.
- Замість зв'язування з мРНК в послідовності Shine-Dalgarno, еукаріотичний комплекс ініціації розпізнає 5' шапку еукаріотичної мРНК, потім відстежує вздовж мРНК в напрямку 5' до 3' до тих пір, поки не буде розпізнано початковий кодон AUG. У цей момент субодиниця 60S зв'язується з комплексом мет-ТРНК, мРНК та субодиниці 40S.
Подовження
У прокаріот і еукаріот основи подовження перекладу однакові. У кишковій паличці зв'язування рибосомальної субодиниці 50S для отримання інтактної рибосоми утворює три функціонально важливі рибосомальні ділянки: A (аміноацил) сайт зв'язує вхідні заряджені аміноацильні тРНК. Сайт P (peptidyl) зв'язує заряджені тРНК, що несуть амінокислоти, які утворили пептидні зв'язки зі зростаючим поліпептидним ланцюгом, але ще не дисоційовані від їх відповідної тРНК. Сайт Е (вихід) випускає дисоційовані ТРНК, щоб їх можна було заряджати вільними амінокислотами. Існує один помітний виняток з цієї конвеєрної лінії тРНК: під час формування комплексу ініціації бактеріальний FMET−тРНК (FMET) або еукаріотичний MET-tRNAI потрапляє на ділянку P безпосередньо без попереднього входу на ділянку А, забезпечуючи вільний ділянку А, готовий прийняти тРНК, відповідну першому кодону після серп.
Подовження протікає при однокодонових рухах рибосоми, кожна з яких називається транслокаційною подією. Під час кожної події транслокації заряджені ТРНК входять на ділянку А, потім переходять на ділянку P, а потім, нарешті, до місця E для видалення. Рибосомальні рухи, або кроки, індукуються конформаційними змінами, які просувають рибосому на три основи в напрямку 3'. Пептидні зв'язки утворюються між аміногрупою амінокислоти, прикріпленої до а-сайту тРНК, і карбоксильної групою амінокислоти, прикріпленої до р-сайту тРНК. Формування кожного пептидного зв'язку каталізується пептидилтрансферазою, рибоцимом на основі РНК, який інтегрований в рибосомну субодиницю 50S. Амінокислота, пов'язана з р-сайтом тРНК, також пов'язана зі зростаючим поліпептидним ланцюгом. Коли рибосома переходить через мРНК, колишня р-ділянка тРНК потрапляє в ділянку Е, відокремлюється від амінокислоти і виганяється. Кілька етапів під час подовження, включаючи зв'язування зарядженої аміноацильної тРНК з ділянкою А і транслокацію, вимагають енергії, отриманої в результаті гідролізу GTP, який каталізується специфічними факторами подовження. Дивно, але апарат перекладу E. coli займає всього 0,05 секунди, щоб додати кожну амінокислоту, а це означає, що 200 амінокислотний білок можна перевести всього за 10 секунд.
Припинення
Припинення перекладу відбувається, коли зустрічається дурничий кодон (UAA, UAG або UGA), для якого немає комплементарної тРНК. При вирівнюванні з ділянкою А, ці дурниці кодони визнаються факторами вивільнення в прокаріотів і еукаріотів, які призводять до того, що амінокислота P-сайту відокремлюється від його тРНК, вивільняючи новоспечений поліпептид. Малі та великі рибосомальні субодиниці дисоціюють від мРНК і один від одного; вони набираються майже відразу в інший комплекс ініціації трансляції.
Підсумовуючи, є кілька ключових особливостей, які відрізняють експресію прокаріотичних генів від експресії, що спостерігається у еукаріотів. Вони проілюстровані на малюнку\(\PageIndex{5}\) і перераховані на рис\(\PageIndex{6}\).
Націлювання на білок, складання та модифікація
Під час і після перекладу поліпептиди, можливо, доведеться модифікувати, перш ніж вони стануть біологічно активними. Пост-трансляційні модифікації включають:
- видалення послідовностей перекладених сигналів - коротких хвостів амінокислот, які допомагають направляти білок у певний клітинний відсік
- правильне «згортання» поліпептиду та асоціація множинних субодиниць поліпептиду, часто сприяє білки шаперону, в чітку тривимірну структуру
- протеолітична обробка неактивного поліпептиду для вивільнення активного білкового компонента, і
- різні хімічні модифікації (наприклад, фосфорилювання, метилювання або глікозилювання) окремих амінокислот.
Вправа\(\PageIndex{3}\)
- Які складові комплексу ініціації для трансляції у прокаріотів?
- Які дві відмінності між ініціацією прокаріотичного та еукаріотичного перекладу?
- Що відбувається на кожному з трьох активних ділянок рибосоми?
- Які причини припинення перекладу?
Ключові поняття та резюме
- У перекладі поліпептиди синтезуються за допомогою послідовностей мРНК та клітинних механізмів, включаючи тРНК, які відповідають кодонам мРНК зі специфічними амінокислотами та рибосомами, що складаються з РНК та білків, які каталізують реакцію.
- Генетичний код вироджується тим, що кілька кодонів мРНК кодують одні й ті ж амінокислоти. Генетичний код практично універсальний серед живих організмів.
- Прокаріотичні (70S) та цитоплазматичні еукаріотичні (80S) рибосоми складаються з великої субодиниці та малої субодиниці різних розмірів між двома групами. Кожна субодиниця складається з рРНК і білка. Рибосоми органел в еукаріотичних клітині нагадують прокаріотичні рибосоми.
- У бактеріях існує від 60 до 90 видів тРНК. Кожна тРНК має тринуклеотидний антикодон, а також місце зв'язування для конгнатної амінокислоти. Всі ТРНК зі специфічним антикодоном будуть нести одну і ту ж амінокислоту.
- Ініціація трансляції відбувається, коли мала рибосомальна субодиниця зв'язується з факторами ініціації та ініціатором тРНК на стартовому кодоні мРНК з подальшим зв'язуванням з комплексом ініціації великої рибосомальної субодиниці.
- У прокаріотичних клітині стартові кодонові коди для N-формил-метіоніну переносяться спеціальним ініціатором тРНК. У клітинах-еукаріотів стартові кодонові коди метіоніну переносяться спеціальним ініціатором тРНК. Крім того, тоді як рибосомальне зв'язування мРНК у прокаріотів сприяє послідовність Шина-Далгарно всередині мРНК, еукаріотичні рибосоми зв'язуються з 5' шапкою мРНК.
- Під час стадії подовження трансляції заряджена тРНК зв'язується з мРНК в ділянці А рибосоми; між двома сусідніми амінокислотами каталізується пептидний зв'язок, розриваючи зв'язок між першою амінокислотою і її тРНК; рибосома рухається по одному кодону уздовж мРНК; і перша тРНК переміщується з Р-ділянки рибосоми в ділянку Е і виходить з рибосомального комплексу.
- Припинення трансляції відбувається, коли рибосома стикається з стоп-кодоном, який не кодує тРНК. Фактори вивільнення викликають вивільнення поліпептиду, а рибосомальний комплекс дисоціює.
- У прокаріотів транскрипція та переклад можуть поєднуватися, причому переклад молекули мРНК починається, як тільки транскрипція дозволяє достатньо експозиції мРНК для зв'язування рибосоми, до припинення транскрипції. Транскрипція та переклад не пов'язані з еукаріот, оскільки транскрипція відбувається в ядрі, тоді як трансляція відбувається в цитоплазмі або в асоціації з грубим ендоплазматичним ретикулумом.
- Поліпептиди часто вимагають однієї або декількох посттрансляційних модифікацій, щоб стати біологічно активними.
