7.4: Білки
- Page ID
- 3972
Цілі навчання
- Опишіть фундаментальну структуру амінокислоти
- Опишіть хімічні структури білків
- Узагальнити унікальні характеристики білків
На початку цієї глави був описаний відомий експеримент, в якому вчені синтезували амінокислоти в умовах, що імітують присутніх на землі задовго до еволюції життя таким, яким ми його знаємо. Ці сполуки здатні склеюватися між собою практично в будь-якій кількості, даючи молекули практично будь-якого розміру, які володіють широким спектром фізико-хімічних властивостей і виконують численні життєво важливі для всіх організмів функції. Молекули, отримані з амінокислот, можуть функціонувати як структурні компоненти клітин та субклітинних утворень, як джерела поживних речовин, як резервуари для зберігання атомів та енергії, а також як функціональні види, такі як гормони, ферменти, рецептори та транспортні молекули.
Амінокислоти та пептидні зв'язки
Амінокислота - це органічна молекула, в якій атом водню, карбоксильна група (—COOH) та аміногрупа (—NH 2) пов'язані з одним і тим же атомом вуглецю, так званим α вуглецем. Четверта група, пов'язана з α вуглецем, варіюється між різними амінокислотами і називається залишком або бічним ланцюгом, представленим у структурних формулах буквою R. Залишок - це мономер, який виникає, коли дві або більше амінокислот об'єднуються і видаляють молекули води. Первинна структура білка, пептидний ланцюг, складається з залишків амінокислот. Унікальні характеристики функціональних груп та R груп дозволяють цим компонентам амінокислот утворювати водневі, іонні та дисульфідні зв'язки, а також полярні/неполярні взаємодії, необхідні для формування вторинних, третинних та четвертинних білкових структур. Ці групи складаються переважно з вуглецю, водню, кисню, азоту та сірки у вигляді вуглеводнів, кислот, амідів, спиртів та амінів. Кілька прикладів, що ілюструють ці можливості, наведено на рис\(\PageIndex{1}\).
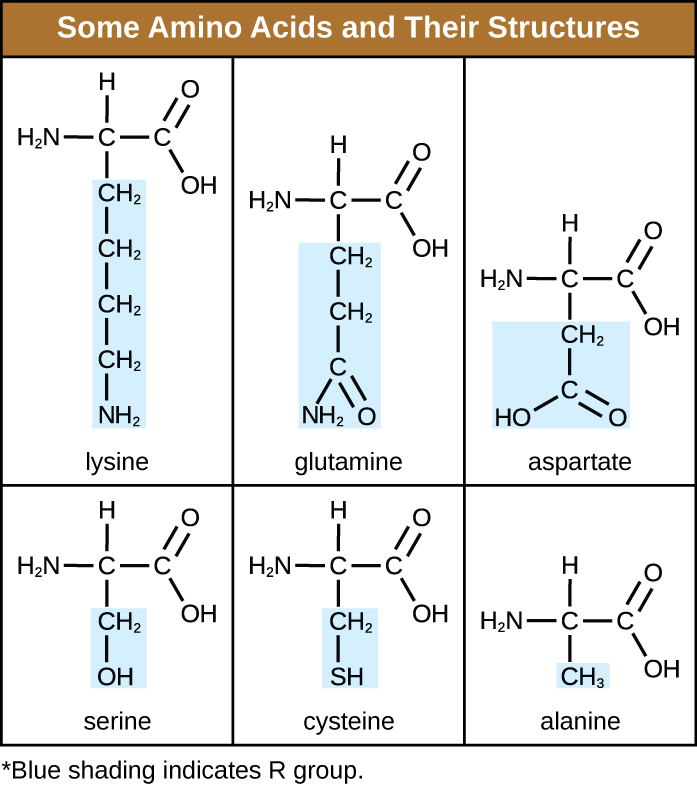
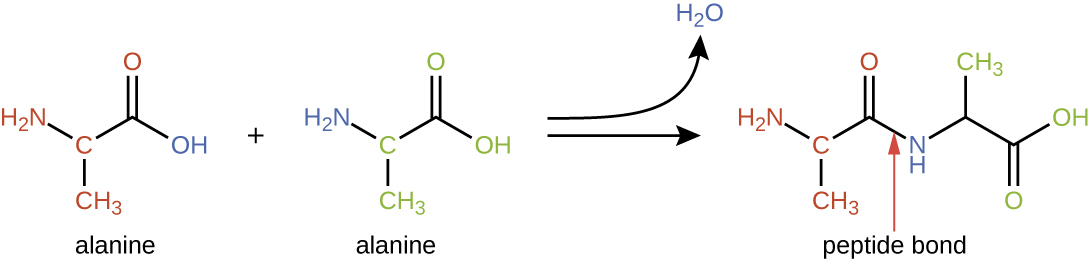
Амінокислоти можуть хімічно зв'язуватися між собою шляхом реакції групи карбонових кислот однієї молекули з амінною групою іншої. Ця реакція утворює пептидний зв'язок і молекулу води і є ще одним прикладом синтезу зневоднення (рис.\(\PageIndex{2}\)). Молекули, утворені хімічним зв'язком відносно скромних чисел амінокислот (приблизно 50 і менше), називаються пептидами, а префікси часто використовуються для вказівки цих чисел: дипептиди (дві амінокислоти), трипептиди (три амінокислоти) і так далі. Більш загально позначається приблизна кількість амінокислот: олігопептиди утворюються шляхом приєднання приблизно до 20 амінокислот, тоді як поліпептиди синтезуються приблизно з 50 амінокислот. Коли кількість амінокислот, пов'язаних між собою, стає дуже великою, або коли кілька поліпептидів використовуються як будівельні субодиниці, макромолекули, які в результаті називаються білками. Безперервна довжина (кількість мономерів) цих біополімерів, поряд з різноманітністю можливих груп R на кожній амінокислоті, дозволяє майже необмежену різноманітність типів білків, які можуть утворюватися.
Вправа\(\PageIndex{1}\)
Скільки амінокислот в поліпептидах?
білкова структура
Розмір (довжина) і специфічна амінокислотна послідовність білка є основними детермінантами його форми, а форма білка має вирішальне значення для його функції. Наприклад, в процесі біологічної фіксації азоту (див. Біогеохімічні цикли) ґрунтові мікроорганізми, спільно відомі як ризобія симбіотично взаємодіють з корінням бобових рослин, таких як соя, арахіс або квасоля, утворюючи нову структуру, яка називається бульбочок на коренях рослин. Потім рослина виробляє білок носій, який називається леггемоглобін, білок, який переносить азот або кисень. Леггемоглобін зв'язується з дуже високою спорідненістю до кисню субстрату в певній області білка, де форма і послідовність амінокислот відповідні (активний сайт). Якщо форма або хімічне середовище активної ділянки змінені, навіть незначно, субстрат може бути не в змозі зв'язуватися так сильно, або він може взагалі не зв'язуватися. Таким чином, щоб білок був повноцінно активним, він повинен мати відповідну форму для своєї функції.
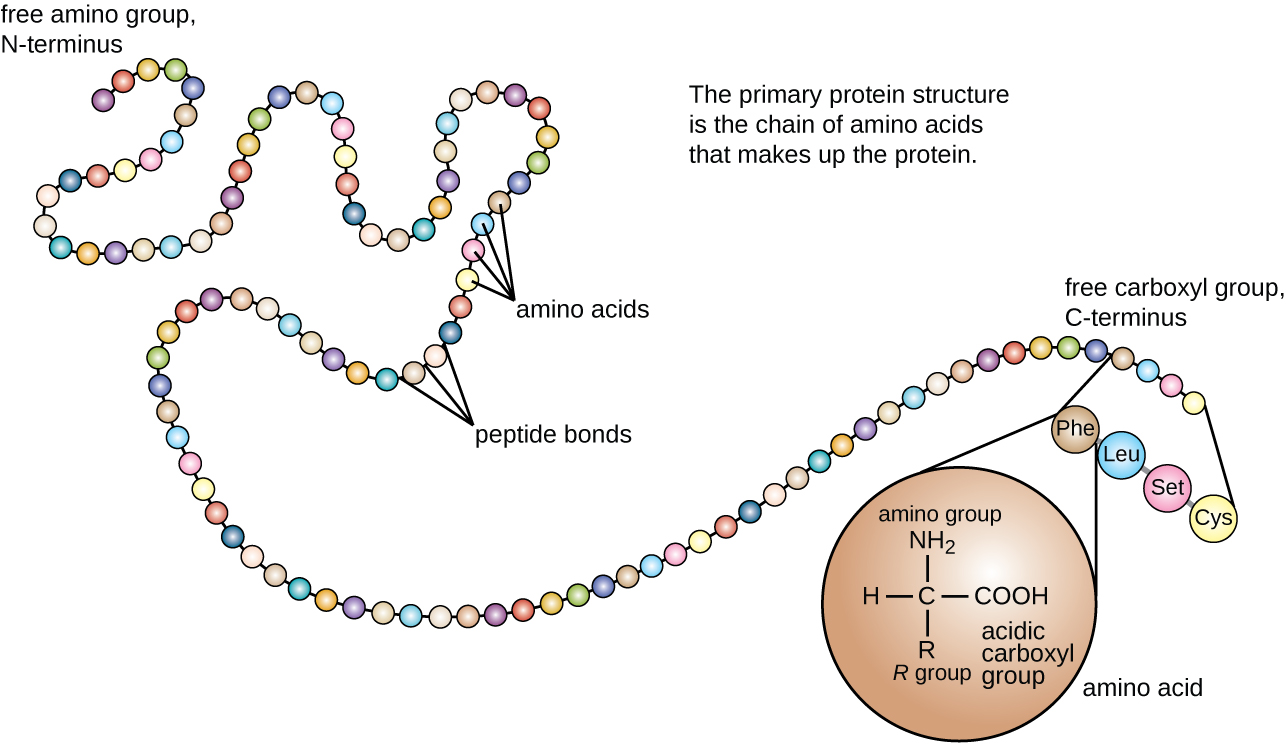
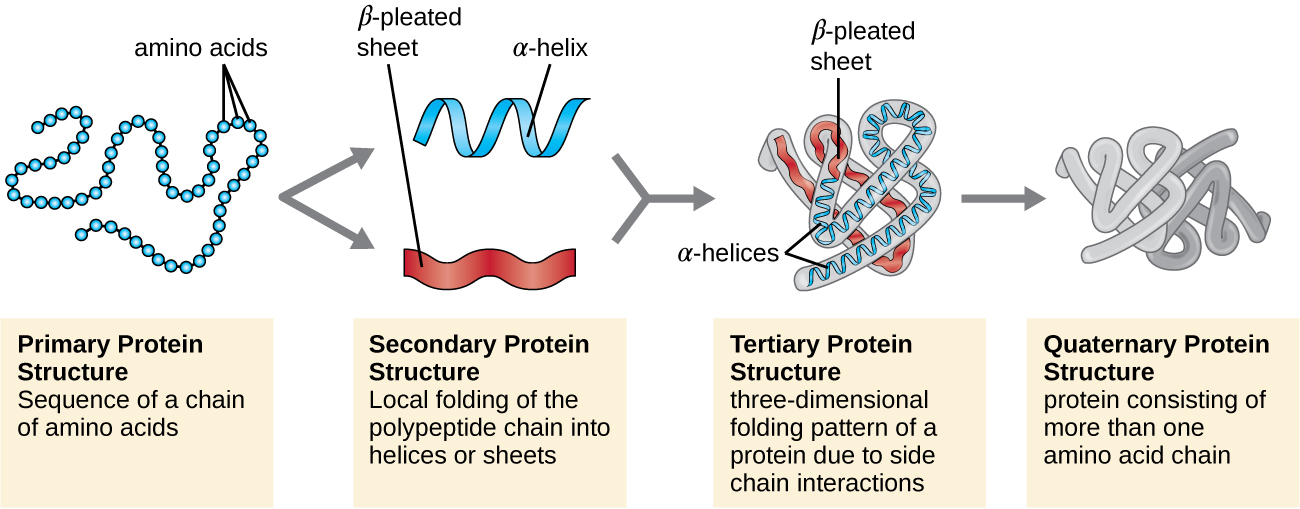
Структура білка класифікується за чотирма рівнями: первинний, вторинний, третинний та четвертинний. Первинна структура - це просто послідовність амінокислот, що входять до складу поліпептидного ланцюга. \(\PageIndex{3}\)На малюнку зображена первинна структура білка.
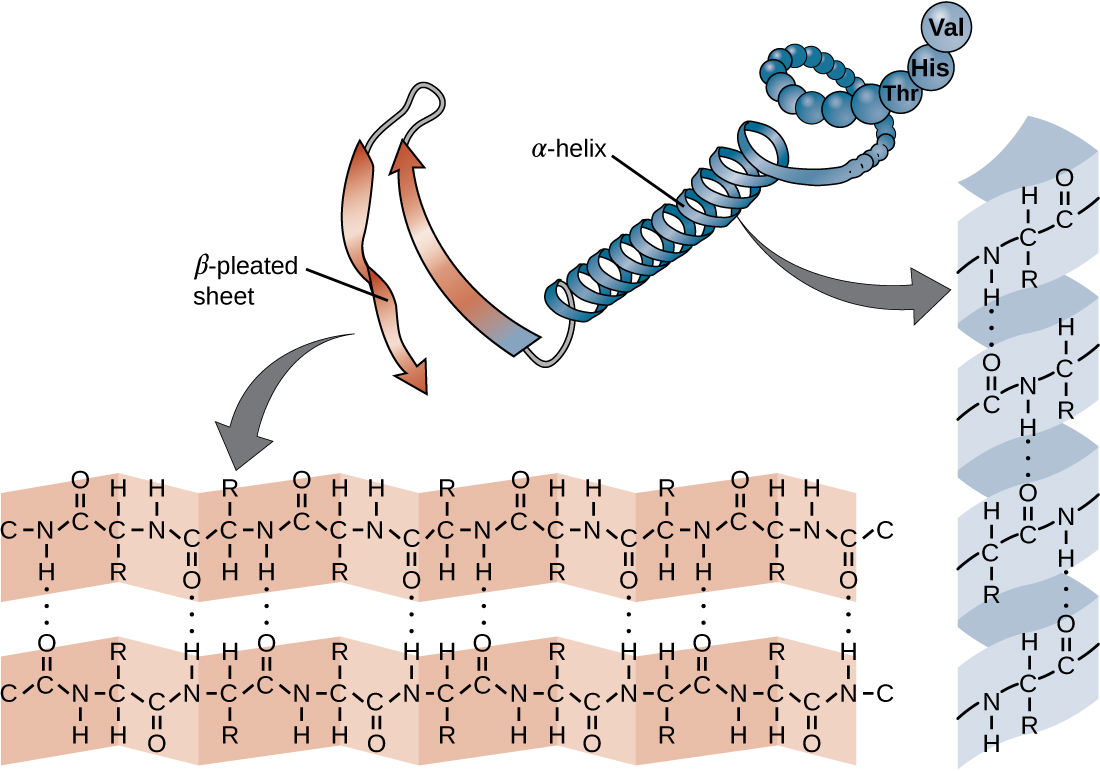
Ланцюг амінокислот, що визначає первинну структуру білка, не є жорсткою, а натомість є гнучкою через характер зв'язків, які утримують амінокислоти разом. Коли ланцюг досить довгий, водневий зв'язок може відбуватися між амінними та карбонільними функціональними групами всередині пептидного хребта (виключаючи бічну групу R), що призводить до локалізованого згортання поліпептидного ланцюга в спіралі та аркуші. Ці форми складають вторинну структуру білка. Найбільш поширеними вторинними структурами є α-спіраль і β-плісировані лист. У структурі α-спіралі спіраль утримується водневими зв'язками між атомом кисню в карбонільної групі однієї амінокислоти і атомом водню аміногрупи, що становить всього чотири амінокислотні одиниці далі по ланцюгу. У β-плісированому аркуші складки утворені аналогічними водневими зв'язками між безперервними послідовностями карбонільних і аміногруп, які додатково відокремлюються на кістці поліпептидного ланцюга (рис.\(\PageIndex{4}\)).
Наступним рівнем організації білка є третинна структура, яка представляє собою великомасштабну тривимірну форму єдиного поліпептидного ланцюга. Третинна структура визначається взаємодіями між залишками амінокислот, які знаходяться далеко один від одного в ланцюжку. Різноманітні взаємодії породжують третинну структуру білка, таку як дисульфідні мости, які є зв'язками між функціональними групами сульфгідрилу (—SH) на бічних групах амінокислот; водневі зв'язки; іонні зв'язки; і гідрофобні взаємодії між неполярними бічними ланцюгами. Всі ці взаємодії, слабкі і сильні, об'єднуються для визначення кінцевої тривимірної форми білка і його функції (рис.\(\PageIndex{5}\)).
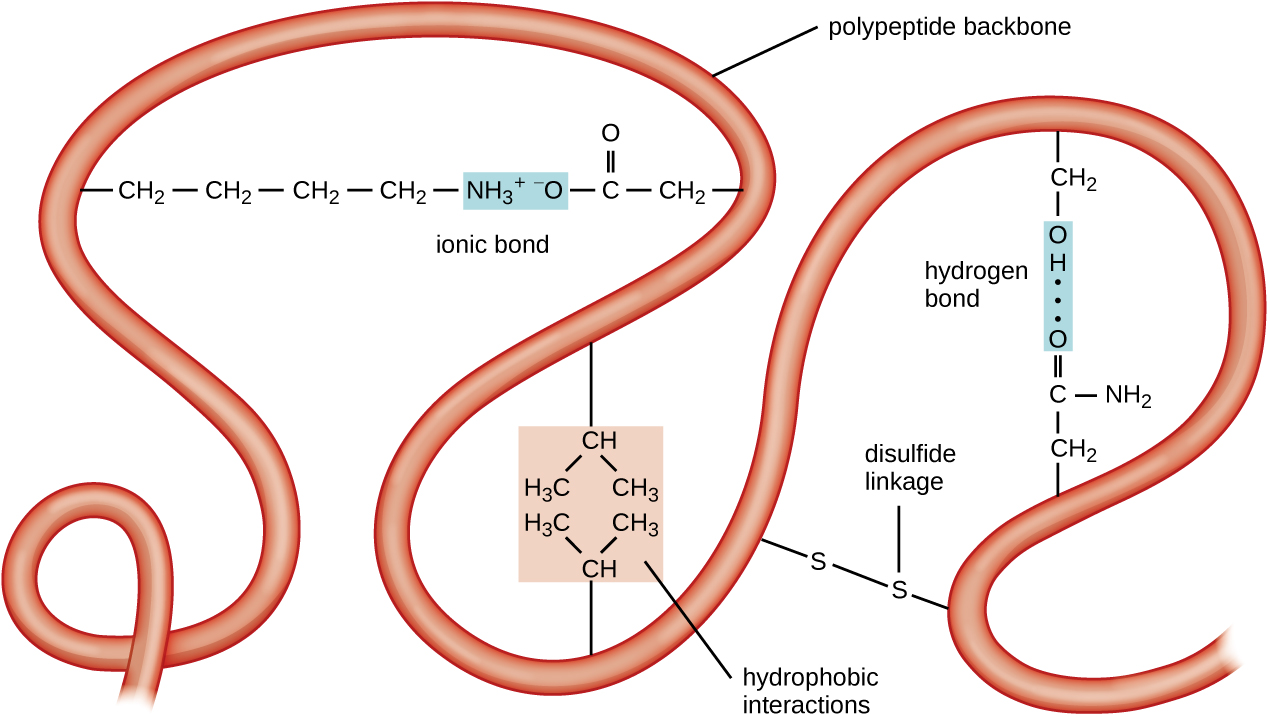
Процес, за допомогою якого поліпептидний ланцюг приймає масштабну, тривимірну форму, називається білковим згортанням. Складені білки, які повністю функціонують у своїй нормальній біологічній ролі, як кажуть, мають нативну структуру. Коли білок втрачає свою тривимірну форму, він може перестати бути функціональним. Ці розгорнуті білки денатуруються. Денатурація має на увазі втрату вторинної структури і третинної структури (і, якщо є, четвертинної структури) без втрати первинної структури.
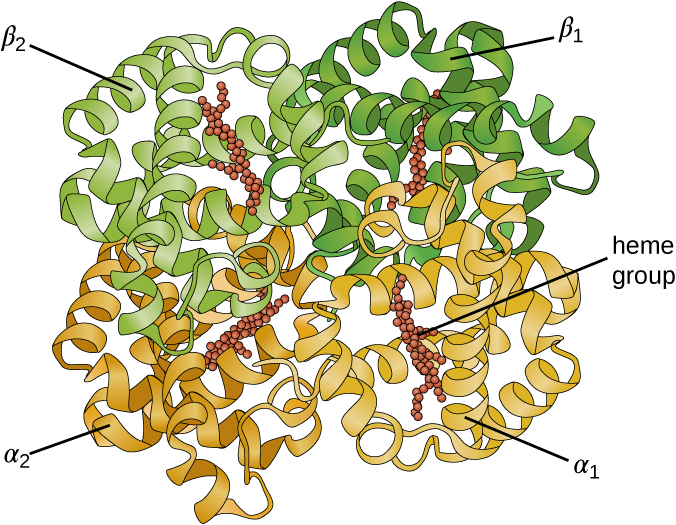
Деякі білки - це збірки декількох окремих поліпептидів, також відомих як білкові субодиниці. Ці білки функціонують адекватно тільки тоді, коли всі субодиниці присутні і належним чином налаштовані. Взаємодії, які утримують ці субодиниці разом, складають четвертинну структуру білка. Загальна четвертинна структура стабілізується відносно слабкими взаємодіями. Гемоглобін, наприклад, має четвертинну структуру з чотирьох глобулярних білкових субодиниць: двох α і двох β поліпептидів, кожна з яких містить хем на основі заліза (рис.\(\PageIndex{6}\)).
Ще один важливий клас білків - це кон'юговані білки, які мають небілкову частину. Якщо до кон'югованого білка приєднаний вуглевод, його називають глікопротеїном. Якщо до нього приєднаний ліпідний, його називають ліпопротеїном. Ці білки є важливими компонентами мембран. Малюнок\(\PageIndex{7}\) підсумовує чотири рівні структури білка.
Вправа\(\PageIndex{2}\)
Що може статися, якщо змінюється первинна, вторинна, третинна або четвертинна структура білка?
Первинна структура, дисфункціональні білки та муковісцидоз
Білки, пов'язані з біологічними мембранами, класифікуються як зовнішні або внутрішні. Зовнішні білки, також звані периферичними білками, нещільно пов'язані з однією стороною мембрани. Внутрішні білки, або інтегральні білки, вбудовані в мембрану і часто функціонують як частина транспортних систем як трансмембранні білки. Муковісцидоз (КФ) - генетичне захворювання людини, викликане зміною трансмембранного білка. Він вражає переважно легені, але може також впливати на підшлункову залозу, печінку, нирки та кишечник. CF викликаний втратою амінокислоти фенілаланін в трансмембранному білку муковісцидозу (CFTR). Втрата однієї амінокислоти змінює первинну структуру білка, який зазвичай допомагає транспортувати сіль і воду всередину і з клітин (рис.\(\PageIndex{8}\)).
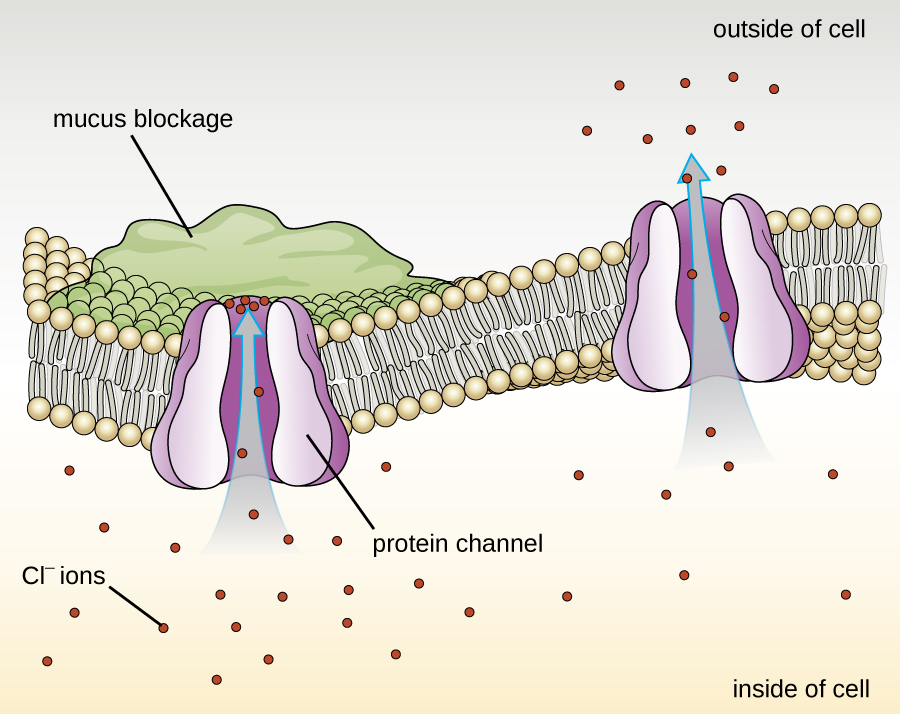
Зміна первинної структури заважає білку нормально функціонувати, що змушує організм виробляти незвично густу слиз, яка закупорює легені і призводить до накопичення липкої слизу. Слиз перешкоджає підшлунковій залозі і зупиняє природні ферменти, допомагаючи організму розщеплювати їжу і поглинати життєво важливі поживні речовини
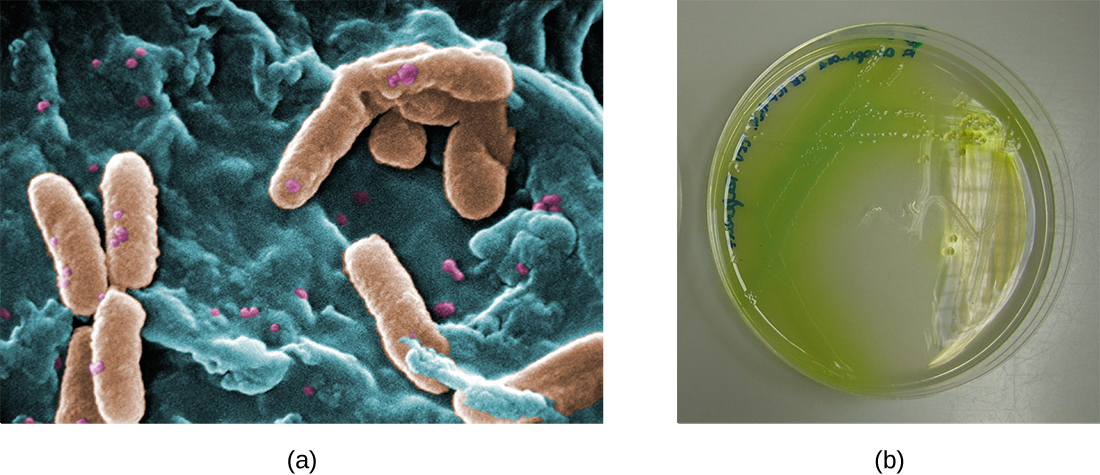
У легенях осіб з муковісцидозом змінена слиз забезпечує середовище, де бактерії можуть процвітати. Така колонізація призводить до утворення біоплівок в малих дихальних шляхах легенів. Найбільш поширеними збудниками, виявленими в легенях хворих на муковісцидоз, є синьогнійна паличка (рис.\(\PageIndex{9}\)) і Burkholderia cepacia. Pseudomonas диференціюється всередині біоплівки в легенях і утворює великі колонії, звані «мукоїдними» Pseudomonas. Колонії мають унікальну пігментацію, яка проявляється в лабораторних дослідженнях (рис.\(\PageIndex{9}\)) і дає лікарям першу підказку про те, що у пацієнта є КФ (такі колонії рідкісні у здорових осіб).
Для отримання додаткової інформації про муковісцидоз відвідайте веб-сайт Фонду муковісцидозу.
Ключові поняття та резюме
- Амінокислоти - це невеликі молекули, необхідні для всього життя. Кожен має α вуглецю, з яким пов'язані атом водню, карбоксильна група та амінна група. Четверта зв'язана група, представлена R, варіюється за хімічним складом, розміром, полярністю та зарядом серед різних амінокислот, забезпечуючи варіацію властивостей.
- Пептиди - це полімери, утворені зв'язком амінокислот за допомогою синтезу зневоднення. Зв'язки між пов'язаними амінокислотами називаються пептидними зв'язками. Кількість амінокислот, пов'язаних між собою, може варіюватися від декількох до багатьох.
- Білки - це полімери, утворені зв'язком дуже великої кількості амінокислот. Вони виконують багато важливих функцій в клітині, слугуючи поживними речовинами та ферментами; молекули зберігання вуглецю, азоту та енергії; і структурні компоненти.
- Структура білка є критичним детермінантом його функції і описується градуйованою класифікацією: первинна, вторинна, третинна і четвертинна. Нативна структура білка може бути порушена денатурацією, що призводить до втрати його структури вищого порядку та його біологічної функції.
- Деякі білки утворені декількома окремими білковими субодиницями, взаємодія цих субодиниць складають четвертинну структуру білкового комплексу.
- Кон'юговані білки мають неполипептидную частину, яка може бути вуглеводом (утворюючи глікопротеїн) або ліпідної фракцією (утворюючи ліпопротеїн). Ці білки є важливими компонентами мембран.
