6.3: Виділення, культура та ідентифікація вірусів
- Page ID
- 3890
Цілі навчання
- Обговоріть, чому віруси спочатку описувалися як фільтровані агенти
- Опишіть культивування вірусів та збір зразків та поводження з ними
- Порівняйте in vivo та in vitro методи, що використовуються для культивування вірусів
На початку цієї глави ми описали, як порцелянові фільтри Chamberland з порами, досить малими, щоб дозволити вірусам проходити крізь, були використані для виявлення ВТМ. Сьогодні порцелянові фільтри замінені мембранними фільтрами та іншими пристроями, що використовуються для ізоляції та ідентифікації вірусів.
виділення вірусів
На відміну від бактерій, багато з яких можна вирощувати на штучному живильному середовищі, віруси вимагають живої клітини-господаря для реплікації. Заражені клітини господаря (еукаріотичні або прокаріотичні) можна культивувати і вирощувати, а потім середовище росту можна збирати як джерело вірусу. Віріони в рідкому середовищі можуть бути відокремлені від клітин господаря шляхом центрифугування або фільтрації. Фільтри можуть фізично видалити все, що присутнє в розчині, що більше, ніж віріони; потім віруси можуть бути зібрані в фільтраті (рис.\(\PageIndex{1}\)).
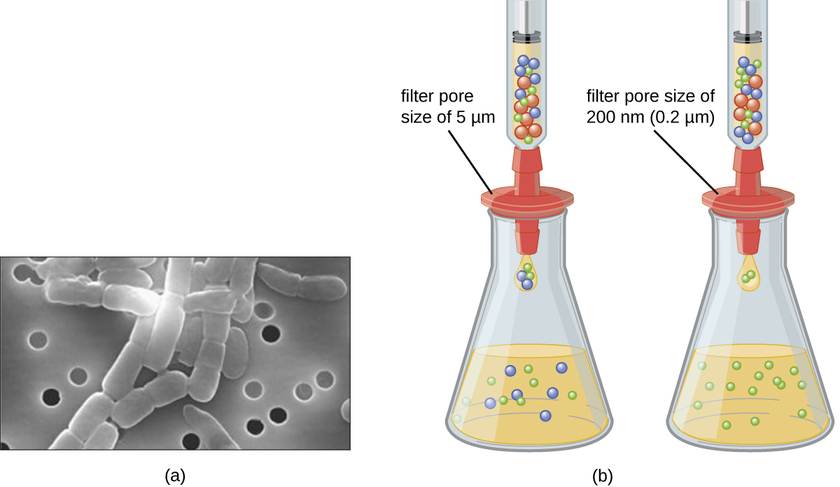
Вправа\(\PageIndex{1}\)
Який розмір пори фільтра потрібен для збору вірусу?
вирощування вірусів
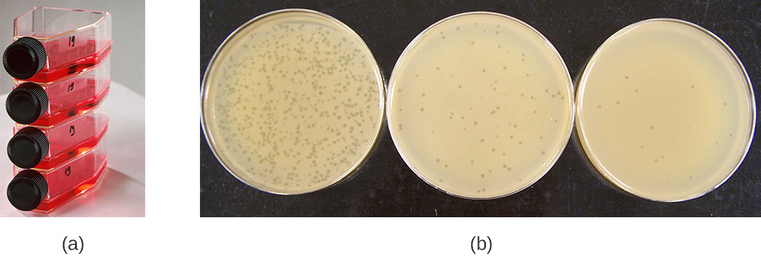
Віруси можуть вирощуватися in vivo (всередині цілого живого організму, рослини або тварини) або in vitro (поза живим організмом в клітині в штучному середовищі, наприклад, пробірці, колбі культури клітин або агарової пластини). Бактеріофаги можна вирощувати в присутності щільного шару бактерій (також званих бактеріальним газоном), вирощених в 0,7% м'якому агарі в чашці Петрі або плоскої (горизонтальної) колбі (рис.\(\PageIndex{2a}\)). Концентрація агару зменшується з 1,5%, які зазвичай використовуються при культивуванні бактерій. М'який 0,7% агар дозволяє бактеріофагів легко дифузіроваться через середовище. Для літичних бактеріофагів лізування бактеріальних господарів можна легко спостерігати при виявленні прозорої зони, яка називається бляшкою (рис.\(\PageIndex{1b}\)). Оскільки фаг вбиває бактерії, серед хмарного бактеріального газону спостерігається багато бляшок.
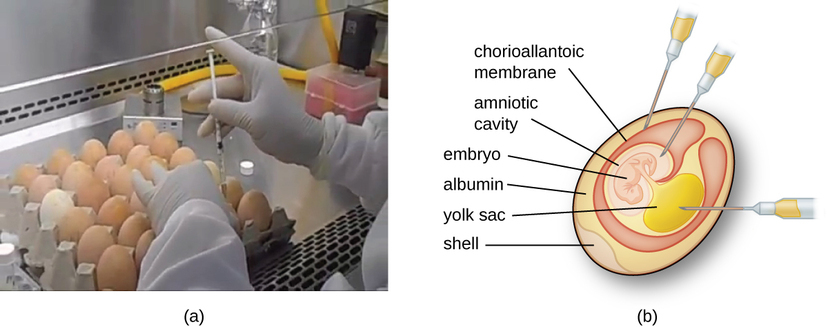
Віруси тварин вимагають клітин всередині тварини-господаря або клітин культури тканин, отриманих від тварини. Культивування вірусу тварин має важливе значення для 1) ідентифікації та діагностики патогенних вірусів у клінічних зразках, 2) виробництва вакцин та 3) фундаментальних досліджень. Джерелами господаря in vivo може бути ембріон, що розвивається в яйці зародка птаха (наприклад, курка, індичка) або ціла тварина. Наприклад, більшість вакцини проти грипу, виготовленої для щорічних програм вакцинації проти грипу, культивується в курячих яйцях.
Ембріон або тварина-господар служить інкубатором для вірусної реплікації (рис.\(\PageIndex{3}\)). Розташування всередині ембріона або тварини-господаря має важливе значення. Багато вірусів мають тканинний тропізм, і тому їх необхідно впроваджувати в певний ділянку для зростання. Всередині ембріона цільові ділянки включають амніотичну порожнину, хоріоаллантоїчну мембрану або жовтковий мішок. Вірусна інфекція може пошкодити тканинні мембрани, виробляючи ураження, звані віспою; порушувати ембріональний розвиток; або викликати смерть ембріона.
Для досліджень in vitro можна використовувати різні типи клітин для підтримки росту вірусів. Первинна культура клітин свіжоприготовлена з органів або тканин тварин. Клітини витягуються з тканин шляхом механічного вискоблювання або подрібнення для звільнення клітин або ферментативним методом з використанням трипсину або колагенази для розщеплення тканини та вивільнення окремих клітин у суспензію. Через вимоги до якірної залежності, первинні культури клітин вимагають рідкого культурального середовища в чашці Петрі або колбі культури тканин, тому клітини мають тверду поверхню, таку як скло або пластик для кріплення та росту. Первинні культури зазвичай мають обмежений термін життя. Коли клітини первинної культури піддаються мітозу і виробляється достатня щільність клітин, клітини контактують з іншими клітинами. Коли відбувається цей контакт клітина-клітина, мітоз запускається зупинка. Це називається контактним гальмуванням, і це запобігає занадто високій щільності клітин. Для запобігання контактного гальмування клітини з первинної культури клітин повинні бути перенесені в іншу посудину зі свіжим середовищем росту. Це називається вторинною культурою клітин. Періодично щільність клітин повинна зменшуватися, виливаючи деякі клітини та додаючи свіже середовище, щоб забезпечити простір та поживні речовини для підтримки росту клітин. На відміну від первинних клітинних культур, безперервні клітинні лінії, як правило, отримані з перетворених клітин або пухлин, часто здатні підкультивуватися багато разів або навіть вирощуватися на невизначений термін (в цьому випадку їх називають безсмертними). Безперервні клітинні лінії можуть не проявляти залежність кріплення (вони будуть рости в суспензії) і, можливо, втратили гальмування контакту. В результаті безперервні клітинні лінії можуть рости купками або грудочками, що нагадують невеликі пухлинні нарости (рис.\(\PageIndex{4}\)).
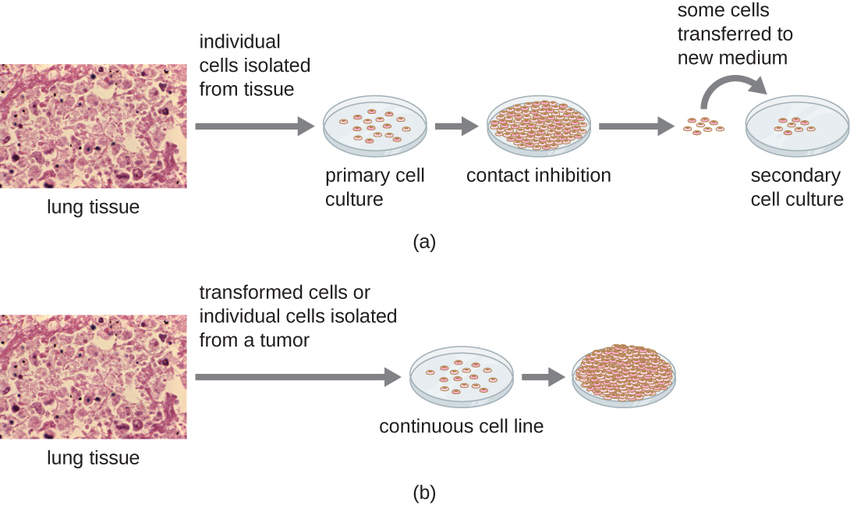
Прикладом безсмертної клітинної лінії є клітинна лінія HelA, яка спочатку культивувалася з пухлинних клітин, отриманих від Генрієтти Лакс, пацієнтки, яка померла від раку шийки матки в 1951 році. Клітини HelA були першою безперервною клітинною лінією культури тканин і використовувалися для встановлення культури тканин як важливої технології для досліджень у клітинній біології, вірусології та медицині. До відкриття клітин HelA вченим не вдалося встановити культури тканин з будь-якою надійністю або стабільністю. Більш ніж через шість десятиліть ця клітинна лінія все ще жива і використовується для медичних досліджень. Дивіться Безсмертну клітинну лінію Генрієтти Лакс, щоб прочитати більше про цю важливу клітинну лінію та суперечливі засоби, за допомогою яких вона була отримана.
Вправа\(\PageIndex{2}\)
Яке властивість клітин робить необхідні періодичні розведення первинних клітинних культур?
Безсмертна клітинна лінія Генрієтти Лакс
У січні 1951 року Генрієтта Лакс, 30-річна афроамериканка з Балтімора, була діагностована рак шийки матки в лікарні Джона Хопкінса. Тепер ми знаємо, що її рак був викликаний вірусом папіломи людини (ВПЛ). Цитопатичні ефекти вірусу змінили характеристики її клітин в процесі, званому трансформацією, що дає клітинам здатність безперервно ділитися. Ця здатність, звичайно, призвела до ракової пухлини, яка врешті-решт вбила місіс Лакс у жовтні у віці 31 року. Перед смертю зразки її ракових клітин брали без її відома або дозволу. Зразки врешті-решт опинилися у володінні доктора Джорджа Гея, біомедичного дослідника з Університету Джона Хопкінса. Гей зміг виростити деякі клітини з зразка Лакса, створивши те, що сьогодні відомо як безсмертна клітинна лінія HelA. Ці клітини мають здатність жити і рости нескінченно довго і навіть сьогодні все ще широко використовуються в багатьох областях досліджень.
За словами чоловіка Лакса, ні Генрієтта, ні сім'я не дали лікарні дозволу на збір її зразка тканини. Дійсно, сім'я не знала лише через 20 років після смерті Лакса, що її клітини ще живі і активно використовуються в комерційних та дослідницьких цілях. Однак клітини HelA були ключовими у численних дослідницьких відкриттях, пов'язаних з поліомієлітом, раком та СНІДом, серед інших захворювань. Клітини також були комерціалізовані, хоча самі вони ніколи не були запатентовані. Незважаючи на це, маєток Генрієтти Лакс ніколи не отримував користі від використання клітин, хоча в 2013 році сім'я Лакс отримала контроль над публікацією генетичної послідовності її клітин.
Цей випадок викликає кілька біоетичних питань, пов'язаних з інформованою згодою пацієнтів та правом знати. У той час, коли тканини Лакса були взяті, не було ніяких законів або вказівок щодо інформованої згоди. Чи означає це, що в той час до неї ставилися справедливо? Звичайно, за сьогоднішніми мірками відповідь була б ні. Збір тканин або органів у вмираючого пацієнта без згоди не тільки вважається неетичним, але і незаконним, незалежно від того, чи може такий акт врятувати життя інших пацієнтів. Чи етично тоді вченим продовжувати використовувати тканини Лакса для досліджень, хоча вони були отримані незаконно за сьогоднішніми стандартами?
Етичні чи ні, клітини Лакса широко використовуються сьогодні для такої кількості додатків, що неможливо перерахувати їх усі. Це випадок, коли цілі виправдовують засоби? Чи були б Lacs раді дізнатися про її внесок у науку та мільйони людей, які отримали користь? Чи хотіла б вона, щоб її родина отримала компенсацію за комерційні продукти, розроблені з використанням її клітин? Або вона відчувала б себе порушеною та експлуатованою дослідниками, які брали частину її тіла без її згоди? Тому що її ніколи не питали, ми ніколи не дізнаємося.
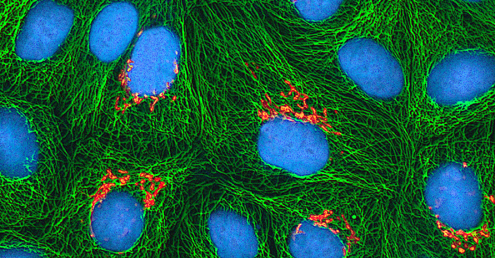
Виявлення вірусу
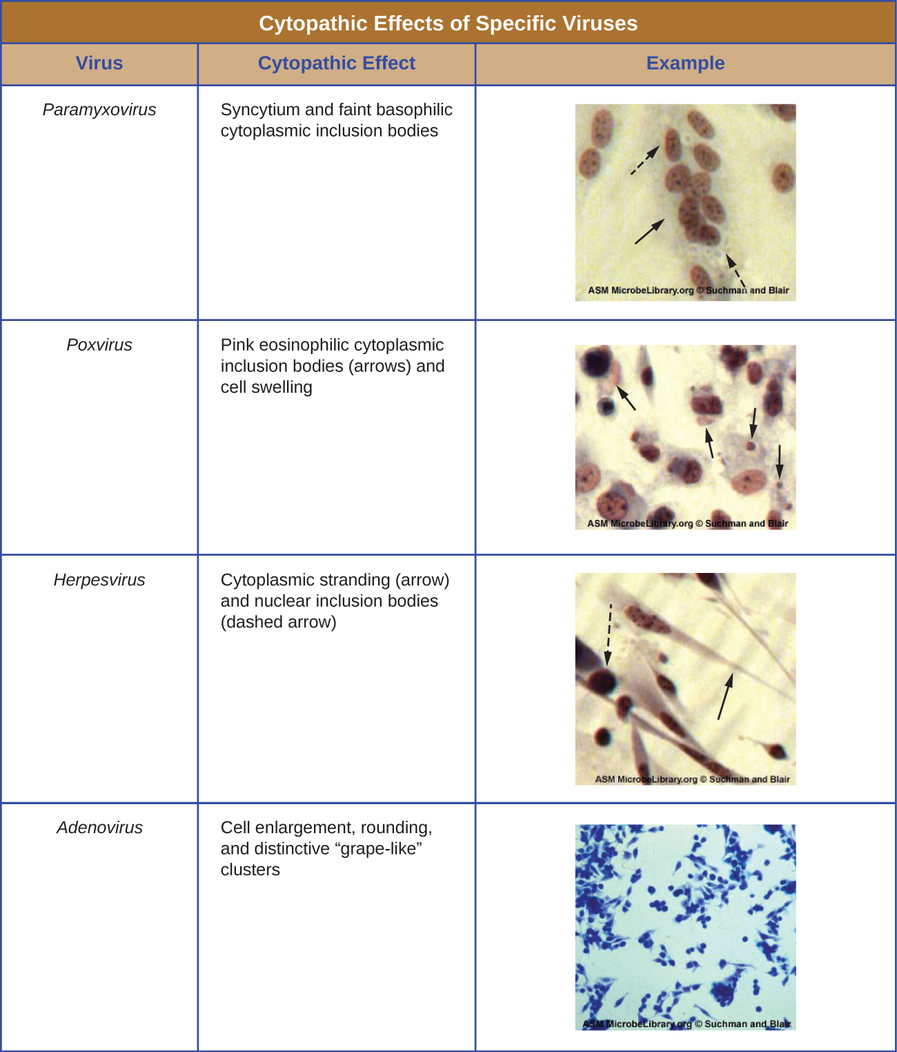
Незалежно від способу культивування, після введення вірусу в цілий організм господаря, ембріон або клітину культури тканин, зразок може бути отриманий із зараженого господаря, ембріона або клітинної лінії для подальшого аналізу під яскравим полем, електронним або флуоресцентним мікроскопом. Цитопатичні ефекти (CPE) - це виразні спостережувані відхилення клітин внаслідок вірусної інфекції. CPE можуть включати втрату прилипання до поверхні контейнера, зміни форми клітин від плоскої до круглої, усадку ядра, вакуолі в цитоплазмі, злиття цитоплазматичних мембран і утворення багатоядерної синцитії, тіла включення в ядрі або цитоплазмі, а також повний лізис клітин ( див. Малюнок\(\PageIndex{6}\)).
Подальші патологічні зміни включають вірусне порушення генома господаря та зміну нормальних клітин на трансформовані клітини, які є типами клітин, пов'язаних з карциномами та саркомами. Тип або тяжкість CPE залежить від типу задіяного вірусу. На малюнку\(\PageIndex{6}\) перераховані CPE для конкретних вірусів.
Перегляньте це відео, щоб дізнатися про вплив вірусів на клітини.
Аналіз на гемагглютинацію
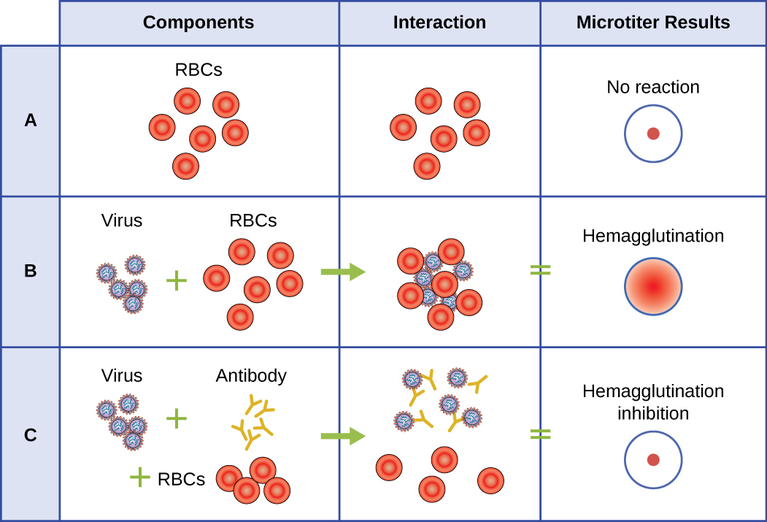
Серологічний аналіз використовується для виявлення наявності певних типів вірусів в сироватці пацієнта. Сироватка - це рідка фракція плазми крові солом'яного кольору, з якої були видалені фактори згортання крові. Сироватка може бути використана в прямому аналізі, який називається гемаглютинаційним аналізом для виявлення конкретних типів вірусів у зразку пацієнта. Гемаглютинація - це аглютинація (злипання) разом еритроцитів (еритроцитів). Багато вірусів виробляють поверхневі білки або шипи, звані гемаглютиніни, які можуть зв'язуватися з рецепторами на мембранах еритроцитів і змушувати клітини агглютинуватися. Гемаглютинацію можна спостерігати без використання мікроскопа, але цей метод не завжди диференціює інфекційні та неінфекційні вірусні частинки, оскільки обидва можуть аглютинувати еритроцити.
Для виявлення конкретного патогенного вірусу за допомогою гемаглютинації треба використовувати непрямий підхід. Білки, звані антитілами, що генеруються імунною системою пацієнта для боротьби з конкретним вірусом, можуть використовуватися для зв'язування з такими компонентами, як гемаглютиніни, які однозначно пов'язані з конкретними типами вірусів. Зв'язування антитіл з виявленими на вірусі гемаглютинінів згодом перешкоджає безпосередній взаємодії еритроцитів з вірусом. Отже, коли еритроцити додаються до вірусів, покритих антитілами, немає появи аглютинації; аглютинація була пригнічена. Ми називаємо ці типи непрямих аналізів для вірусспецифічних антитіл інгібування гемаглютинації (HAI) аналізів. HAI може бути використаний для виявлення наявності антитіл, специфічних для багатьох типів вірусів, які можуть викликати або викликати інфекцію у пацієнта навіть через місяці або роки після зараження (див.\(\PageIndex{7}\) Рис. Цей аналіз більш детально описаний в аглютинаційних аналізах.
Вправа\(\PageIndex{3}\)
Який результат позитивного тесту на ОВЗ?
Тест на посилення нуклеїнової кислоти
Тести на ампліфікацію нуклеїнових кислот (NAAT) використовуються в молекулярній біології для виявлення унікальних послідовностей нуклеїнових кислот вірусів у зразках пацієнтів. Полімеразна ланцюгова реакція (ПЛР) - це NAAT, що використовується для виявлення наявності вірусної ДНК у зразку тканини або рідини організму пацієнта. ПЛР - це методика, яка підсилює (тобто синтезує багато копій) цікавить вірусного сегмента ДНК. Використовуючи ПЛР, короткі нуклеотидні послідовності, звані праймерами, зв'язуються з конкретними послідовностями вірусної ДНК, дозволяючи ідентифікувати вірус.
ПЛР із зворотною транскриптазою (ЗТ-ПЛР) - це NAAT, що використовується для виявлення наявності РНК-вірусів. ЗТ-ПЛР відрізняється від ПЛР тим, що фермент зворотної транскриптази (RT) використовується для виготовлення кДНК з невеликої кількості вірусної РНК у зразку. Потім кДНК може бути ампліфікована методом ПЛР. Як ПЛР, так і ЗТ-ПЛР використовуються для виявлення та підтвердження наявності вірусної нуклеїнової кислоти у зразках пацієнтів.
ВПЛ лякати
Мішель, 21-річна студентка медсестер, прийшла в університетську клініку, стурбована тим, що вона, можливо, піддалася захворюванню, що передається статевим шляхом (ЗПСШ). Її статевий партнер нещодавно розвинув кілька шишок на підставі пеніса. Він відклав похід до лікаря, але Мішель підозрює, що вони генітальні бородавки, викликані ВПЛ. Вона особливо стурбована тим, що знає, що ВПЛ не тільки викликає бородавки, але є важливою причиною раку шийки матки. Вона і її партнер завжди використовують презервативи для контрацепції, але вона не впевнена, що ця обережність захистить її від ВПЛ.
Лікар Мішель не виявляє фізичних ознак генітальних бородавок або будь-яких інших ЗПСШ, але рекомендує Мішель отримати мазок Папа разом з тестом на ВПЛ. Мазок Папа буде перевіряти аномальні клітини шийки матки та CPE, пов'язані з ВПЛ; тест на ВПЛ перевірить наявність вірусу. Якщо обидва тести негативні, Мішель може бути більш впевнена, що вона, швидше за все, не заразилася ВПЛ. Однак її лікар припускає, що Мішель може бути розумним зробити щеплення від ВПЛ, щоб захистити себе від можливого майбутнього впливу.
Вправа\(\PageIndex{4}\)
Чому лікар Мішель призначає два різних тести замість того, щоб покладатися на той чи інший?
Імуноферментний аналіз
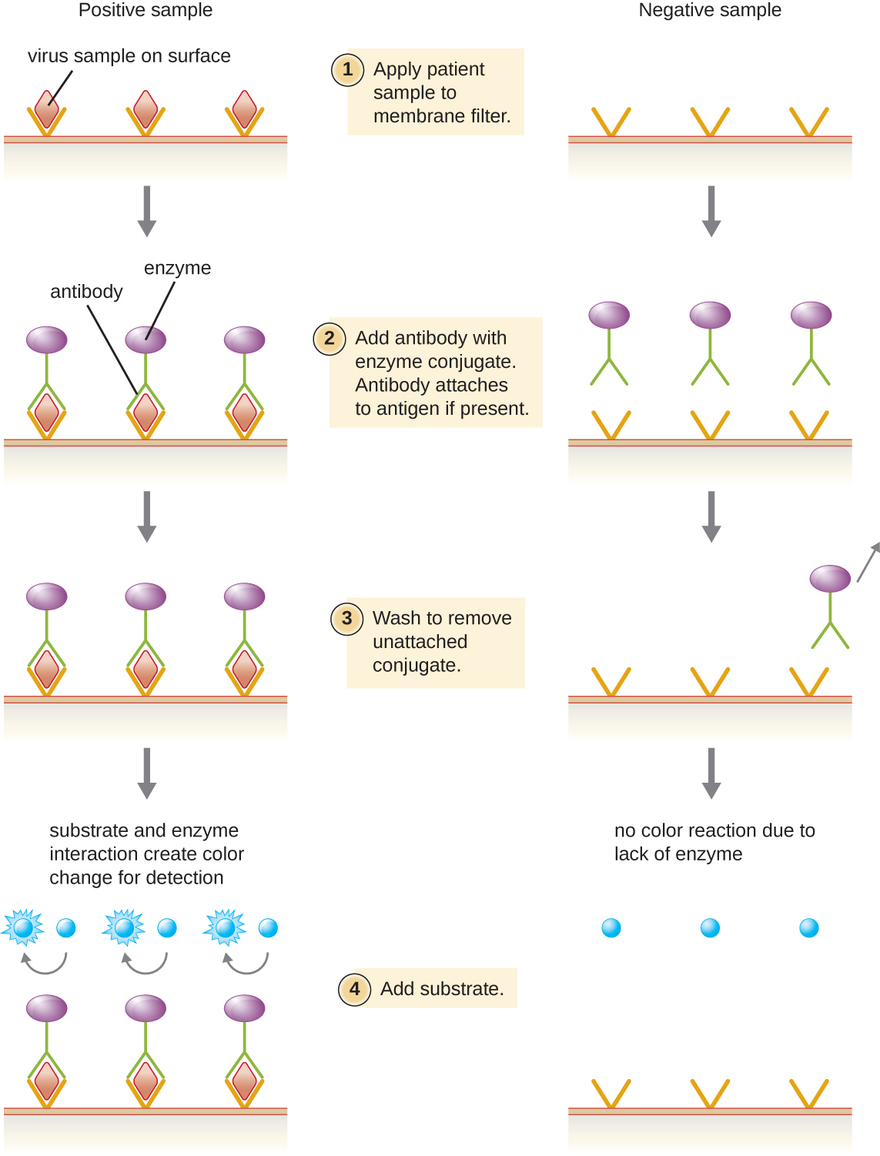
Імуноферментні аналізи (ЕІА) покладаються на здатність антитіл виявляти та приєднуватися до конкретних біомолекул, званих антигенами. Виявлене антитіло прикріплюється до цільового антигену з високим ступенем специфічності в тому, що може бути складною сумішшю біомолекул. Також в цей вид аналізу входить безбарвний фермент, приєднаний до детектуючого антитіла. Фермент діє як мітка на виявлення антитіла і може взаємодіяти з безбарвним субстратом, що призводить до отримання кольорового кінцевого продукту. EIA часто покладаються на шари антитіл для захоплення і реагування з антигенами, всі вони прикріплені до мембранного фільтра (див. Рис.\(\PageIndex{8}\)). ЕІА на вірусні антигени часто використовуються в якості попередніх скринінгових тестів. Якщо результати позитивні, подальше підтвердження потребують тестів з ще більшою чутливістю, таких як західний блот або NAAT. ОВД більш детально розглядаються в ОВД та ІФА.
Вправа\(\PageIndex{5}\)
Що зазвичай вказує на позитивний тест EIA?
Клінічна спрямованість: Частина 3
Поряд з аналізом ЗТ/ПЛР слину Девіда також збирали для вірусного культивування. Загалом, жодного діагностичного тесту не достатньо для передсмертної діагностики, оскільки результати залежатимуть від чутливості аналізу, кількості віріонів, присутніх на момент тестування, та термінів аналізу, оскільки вивільнення віріонів у слині може змінюватися. Як з'ясовується, результат виявився негативним для вірусного культивування зі слини. Це не дивно для лікаря Девіда, адже один негативний результат не є абсолютним показником відсутності інфекції. Може бути, що кількість віріонів в слині невисока на момент взяття проб. Незвично повторювати тест з інтервалами, щоб підвищити ймовірність виявлення більш високих вірусних навантажень.
Вправа\(\PageIndex{6}\)
Чи повинен лікар Девіда змінити свій курс лікування на основі цих результатів тесту?
Резюме
- Вірусне культивування вимагає наявності певної форми клітини-господаря (цілого організму, ембріона або культури клітин).
- Віруси можна виділити із зразків шляхом фільтрації.
- Вірусний фільтрат є багатим джерелом звільнених віріонів.
- Бактеріофаги виявляються за наявністю прозорих бляшок на бактеріальному газоні.
- Віруси тварин і рослин виявляються за допомогою цитопатичних ефектів, молекулярних методів (ПЛР, ЗТ-ПЛР), імуноферментних аналізів та серологічних аналізів (гемагглютинаційний аналіз, аналіз на інгібування гемаглютинації).
