9.2: Еукаріотична транскрипційна регуляція
Як і практично в кожному порівнянні з прокаріотичними системами, регуляція еукаріотичної транскрипції набагато складніше, ніж контроль прокаріотичних генів, хоча все ж заснована на аналогічних механізмах активаторів і репресорів. Однак немає близького еукаріотичного еквівалента оперонам: гени еукаріотів завжди транскрибуються по одному на мРНК. У попередньому розділі описано формування преініціативного комплексу факторів транскрипції для РНК-полімерази II. Ці фактори транскрипції (наприклад, TFIID, TFIIH тощо) відомі як загальні фактори транскрипції і необхідні для транскрипції будь-якого гена на будь-якому рівні. Однак існують також специфічні фактори транскрипції, які зазвичай називають просто факторами транскрипції (TF), які модулюють частоту транскрипції певних генів. Деякі елементи вище за течією та пов'язані з ними TF є досить поширеними, тоді як інші специфічні для генів або генів. Прикладом першого є верхній елемент AACCAAT і пов'язаний з ним фактор транскрипції, CP1. Інший фактор транскрипції, Sp1, є аналогічно загальним і зв'язується з послідовністю консенсусу ACGCCC. Обидва використовуються для контролю гена бета-глобіну, поряд з більш специфічними факторами транскрипції, такими як GATA-1, який пов'язує консенсус AAGTATCACT і в основному виробляється в клітині крові. Це ілюструє ще один варіант, знайдений в еукаріотичному контролі, який не зустрічається у прокаріотів: тканинно-специфічна експресія гена. Гени, перебуваючи в ДНК, технічно доступні будь-якій клітині, але, очевидно, потреби клітини крові сильно відрізняються від потреб клітини печінки або нейрона. Тому кожна клітина може виробляти фактори транскрипції, специфічні для її типу клітини або тканини. Ці фактори транскрипції можуть дозволити або пригнічувати експресію декількох генів, які допомагають de ne цей конкретний тип клітин, припускаючи, що всі вони мають послідовності розпізнавання для TF. Ці послідовності розпізнавання також відомі як елементи відповіді (RE).
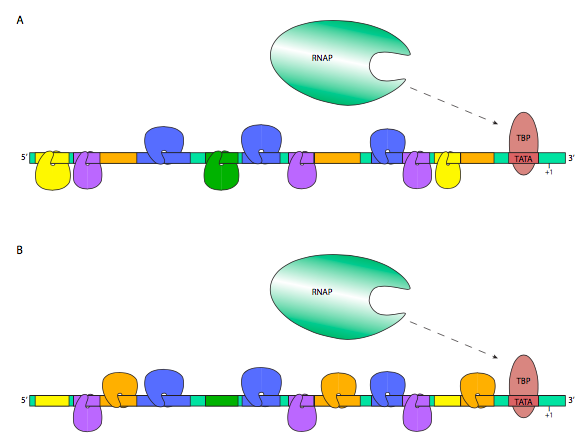
Дуже часто поєднання багатьох факторів транскрипції, як підсилювачів, так і глушників, відповідає за кінцеву швидкість експресії даного еукаріотичного гена. Це можна зробити градуйованим способом, в якому вираження стає сильнішим або слабшим, оскільки більше підсилювачів або глушників пов'язані відповідно, або це може бути двійковий режим управління, в якому для включення транскрипції потрібна чітко визначена група TF, а відсутні лише один може ефективно закрити транскрипція цілком. У першому випадку активація TF зазвичай зв'язується з GTF або РНК-полімеразою II безпосередньо, щоб допомогти їм розпізнати промоутер більш ефективно або стабільно, в той час як пригнічення TF може зв'язуватися з активуючими TF, або з GTF або RNAP II, запобігаючи розпізнаванню промоутера або дестабілізації RNAP II передініціативний комплекс. У другому випадку активація залежить від побудови енханцеосоми, в якій фактори транскрипції та елементи білкових риштувань та коактиватори збираються разом, щоб позиціонувати та стабілізувати комплекс преініціації та RNAP II на промоторі. Найвідоміший і майже всюдисущий коактиватор називається Mediator, і зв'язується з КТД β' субодиниці РНК-полімерази II, а також з різними факторами транскрипції.
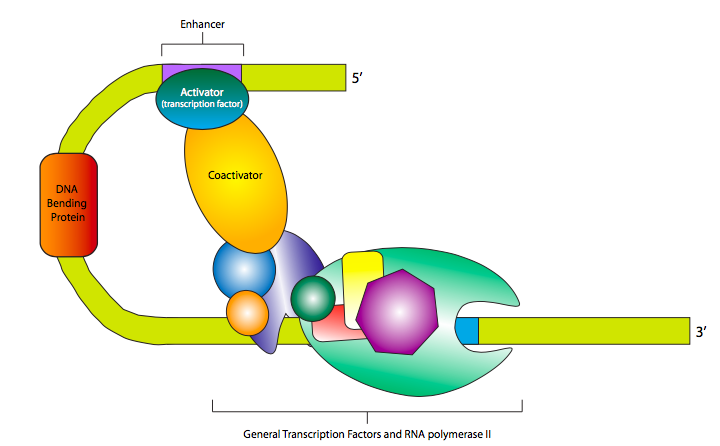
Еукаріотичні фактори транскрипції, хоча і різноманітні, зазвичай містять принаймні один з наступних мотивів фактора транскрипції: цинкові пальці, лейцинові блискавки, основні спірально-спіральні домени, області гомології Rel або їх варіація.
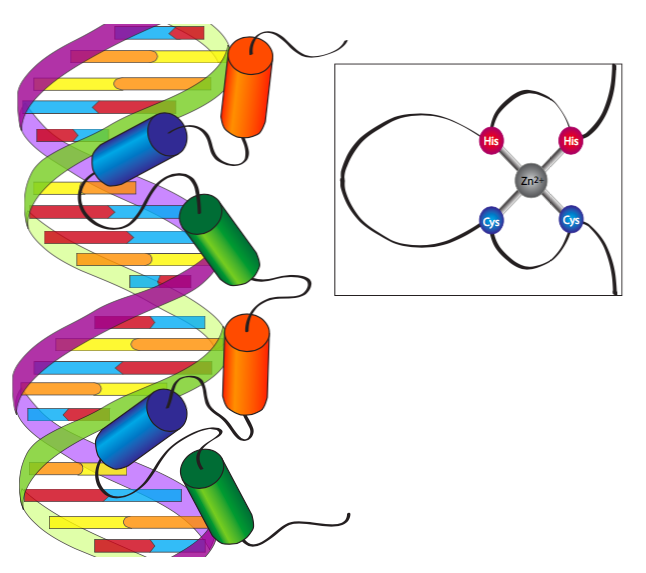
Мотив цинкового пальця був першим доменом, що зв'язує ДНК, який був виявлений, і був знайдений у загальному факторі транскрипції, пов'язаному з РНК-полімеразою III. Виявлена початкова структура була повторюваним ~ 30-амінокислотним мотивом з двома інваріантними Cys та двома інваріантними залишками Його, які разом зв'язують іон Zn 2+ і, таким чином, приносять щільну петлю або «палець» основних потенційно зв'язуючих залишків ДНК. Основний палець зв'язується з основною канавкою ДНК, при цьому точні характеристики узгодження послідовності визначаються топологією конкретних залишків, що складають палець. Хоча більшість мотивів, що зв'язують ДНК, вставляють позитивно заряджений α-спіральний домен у велику канавку ДНК, білки цинкового пальця є єдиними, які поєднують кілька таких мотивів для взаємодії з ДНК в декількох послідовних ділянках.
На додаток до першого типу Zn 2+ -зв'язування сайту, описаного з двома Cys та двома His (Cys 2 -His 2), слід зазначити дві основні варіації. Перший - це тип Cys 2 -Cys 2, який характерний для факторів транскрипції стероїдних рецепторів, таких як рецептор глюкокортикоїдів або рецептор естрогену. Ми розглянемо їх більш детально пізніше з обговоренням внутрішньоклітинної трансдукції сигналу, але поки загальна думка полягає в тому, що неактивовані рецептори стероїдних гормонів знаходяться в цитоплазмі, де вони контактують і зв'язують їх молекулу спорідненого гормону. Потім вони транслокуються в ядро, де димеризуються і здатні діяти як фактори транскрипції. Другою основною варіацією цинкового пальця є бінуклеарний Cys 6, який несе шість залишків Cys, щоб створити трохи більшу «кошик», в якій утримуються два іони Zn 2+, а не лише один. Найбільш вивченим прикладом цього типу білка цинкового пальця є GAL4, фактор транскрипції метаболізму дріжджів.
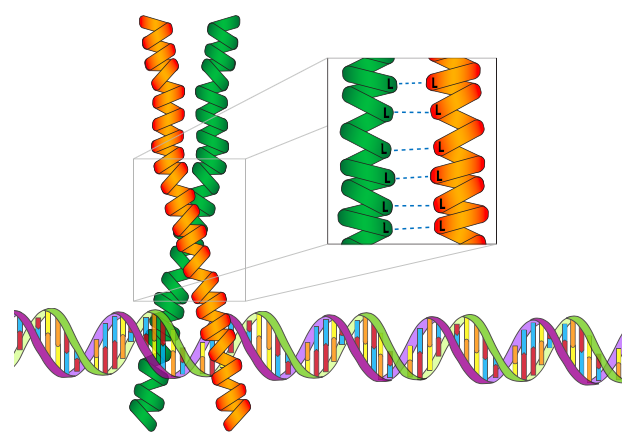
Наступний мотив - лейцинова блискавка. Хоча це загальний мотив факторів транскрипції, важливо зазначити, що на відміну від цинкового пальця, сама лейцинова блискавка не є мотивом, що зв'язує ДНК. Швидше, це мотив димеризації білка і визначає спосіб взаємодії двох білкових субодиниць. Однак лейцинова блискавка є загальним структурним мотивом у факторах транскрипції. Він працює через протилежні домени регулярно розташованих гідрофобних амінокислот, особливо лейцинів, які дуже ефективні при утриманні двох субодиниць разом у водному середовищі клітини. Лейцини знаходяться в кожному 7-му залишковому положенні α-спірального домену, що призводить до намотувано-котушкової надбудови при взаємодії двох субодиниць. (+) заряджені ДНК-зв'язуючі домени цих білків зазвичай є N-термінальними до лейцинових блискавок, як у випадку з категорією BZip білків лейцинової блискавки (назва розшифровується як основна область лейцинової блискавки).
BHLH, або основні спіральні спіральні домени, як видається, є розробками на тему лейцинової блискавки. У цьому випадку N-кінцева область є надзвичайно базовою, що робить її ідеальною для взаємодії з ДНК, і цей основний домен, який також є гвинтовим, веде в першу спіраль (H1) мотиву, яка потім з'єднується неспіральної петлею амінокислот, що веде у другу спіральну область (H2). Крім BHLH, ці фактори транскрипції можуть зливатися в лейциновий мотив блискавки або інший домен взаємодії білків для димеризації. Хоча первинний зв'язуючий домен є N-термінальним до H1, домени H1 також, здається, відіграють певну роль у зв'язуванні основної канавки ДНК. [Приклад myc]
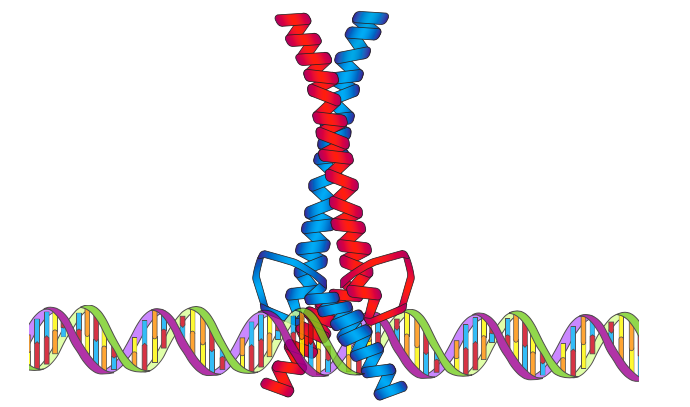
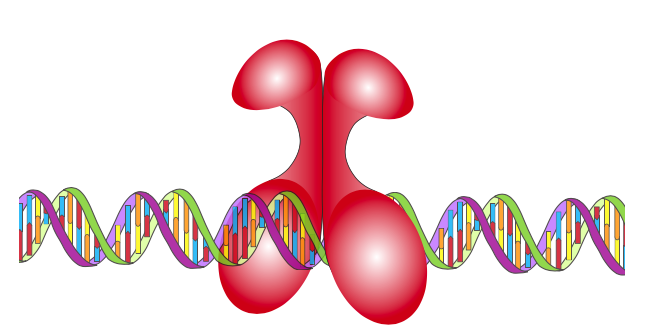
NF-kB (ядерний фактор kB) - всюдисущий транскрипційний фактор, виявлений (і найбільш помітний) в імунній системі. Коли активний, це гетеродимер, причому обидві субодиниці містять область гомології Rel (RHR). Rel - онкоген, і RHR названі за їх схожість з раніше секвенованим rel. Домени RHR зв'язуються з ДНК з надзвичайною спорідненістю, частково завдяки наявності петель ve для контакту ДНК на субодиницю. Так само, як і у випадку з іншими типами факторів транскрипції, деякі RHR-містять білки є репресорами, а інші - активаторами.
Регуляція NF-kB досить цікава: опинившись в ядрі, то в цілому активна. Однак він, як і майже всі клітинні білки, зроблений в цитоплазмі. Інгібітори NF-kB (iKB) також мешкають в цитоплазмі, і вони діють шляхом зв'язування NF-kB і покриваючи сигнал ядерної локалізації, що дозволяє імпортувати його в ядро. Таким чином секвестрований, NF-kB повинен залишатися в цитоплазмі неактивним до тих пір, поки якийсь стимул не активує кіназу iKB, яка фосфорилює iKB і призводить до убіквітунації та деградації, остаточно вивільняючи NF-kB зі своїх зв'язків.
Оскільки його можна швидко мобілізувати (порівняно з синтезом нового білка), NF-kB вважається фактором транскрипції швидкої відповіді, який часто використовується для початку експресії гена, необхідного незабаром після того, як він був «впорядкований» сигналом, або позаклітинним, або внутрішньоклітинним. Не дивно, що фактор, виявлений в імунній системі, він активується у відповідь на бактеріальні та вірусні антигени, а також інші види клітинного стресу або інсульту.
На додаток до відносно короткочасної регуляції експресії генів, контрольованої зв'язуючими факторами транскрипції з регуляторними елементами, існують також більш сильні методи блокування гена для запобігання його експресії. У главі 7 ацетилювання та деацетилювання гістонів обговорювалося як метод зменшення та підвищення їх спорідненості до ДНК. Це можна контролювати (рис.9.2.11 B) шляхом набору гістон-деацетилази (HDAC) до певних генів за допомогою репресорних/корепресорних комплексів. Деацетилаза змушує щільно намотувати цільову ДНК до гістонів, виключаючи доступ РНК-полімеразами або загальними факторами транскрипції.
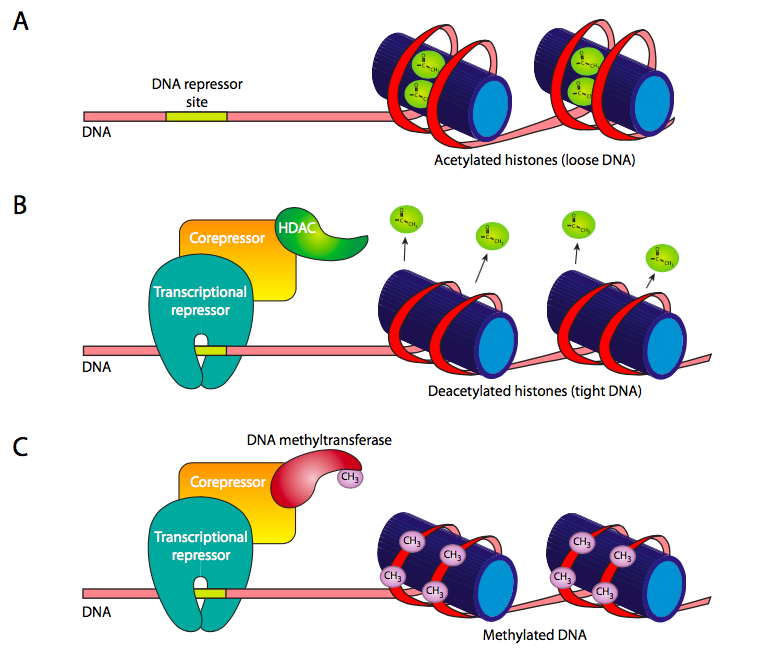
Ще одним рекрутером HDAC є білки MBD, які зв'язуються з метильованою ДНК. Метилювання ДНК у ссавців зазвичай відбувається на послідовностях динуклеотидів CpG. Це метилювання, здається, має ефект блокування доступу факторів транскрипції та ферментів до ДНК. Це може зробити безпосередньо, або шляхом набору MBD (метил-CPG-зв'язуючого домену) білків. У будь-якому випадку метилювання є довгостроковим методом блокування генів і є механізмом відключення генів, які ніколи не використовуватимуться в певному типі клітин (наприклад, гемоглобіну в нейроні).
