9.1: Прокаріотична транскрипційна регуляція
На відміну від багатоклітинних організмів, в яких більшість клітин знаходяться в жорстко регульованому внутрішньому середовищі, більшість прокаріотичних клітин постійно реагують на мінливі умови в їх безпосередньому оточенні, такі як зміна концентрації солі, температури, кислотності або доступності поживних речовин. Оскільки ці організми повинні реагувати швидко, термін життя РНК тримається коротким, близько декількох хвилин - тому генні продукти, які не корисні в нових умовах, не витрачають ресурси. З цієї ж причини ініціація нової транскрипції також повинна відбуватися дуже швидко - так що генні продукти, необхідні для стабілізації клітини в нових умовах, швидко доступні. Потрібна швидка і ефективна система управління, а у прокаріотів це означає, що елементи управління по транскрипції - прості активатори і репресори. Для деяких генів обидва можуть бути використані для регулювання, тоді як для інших потрібен лише один, щоб перейти від стану експресії за замовчуванням або неекспресії.
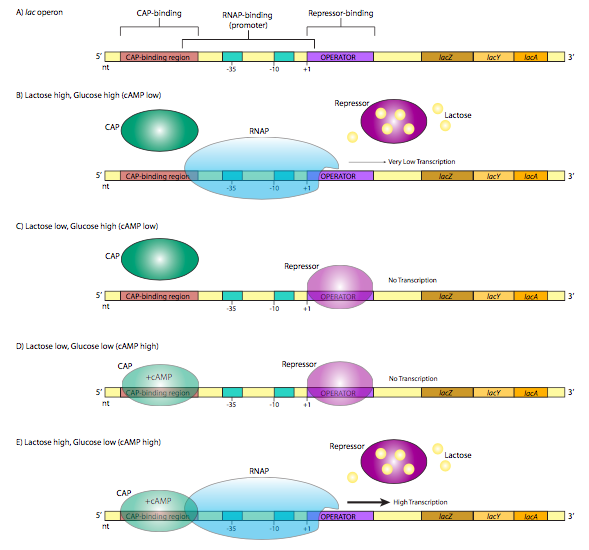
Класичний приклад репресорного контролю експресії генів, лак-оперон, також ілюструє інший метод, за допомогою якого бактерії можуть контролювати експресію генів. Оперон - це група генів, продукти яких беруть участь в одному метаболічному шляху, і транскрибуються під контролем одного промотора. Лак-оперон складається з трьох генів (LaCZ, LaCy, LaCa), які беруть участь в катаболізмі дисахариду, лактози. LaCZ - це β-галактозидаза, фермент, який розщеплює лактозу на галактозу та глюкозу. LaCy - це β-галактозидна пермеаза, яка транспортує лактозу з позаклітинного середовища в клітину. Обидва необхідні для катаболізму лактози. Як не дивно, LaCa не є абсолютно необхідним для метаболізму лактози, але його функція пов'язана з двома іншими: це β-галактозидна трансацетилаза, яка переносить ацетильні групи з ацетил-КоА в лактозу. Всі три перекладені (вони зберігають свої індивідуальні початкові і стоп-кодони для перекладу, не плутати з початком і зупинкою транскрипції) з однієї стенограми. Особливий інтерес щодо регулювання даної транскрипції викликає структура промоутерного регіону. Зверніть увагу, що на додаток до очікуваного промоутера σ 70 вище за течією стартового сайту, є ще одна послідовність управління на кожній стороні стартового сайту (рисунок9.1.1 А).
Зауважимо, що мотив спіралі повороту спіралі (HTH), який поширений у білках, що зв'язують бактеріальну ДНК, - це не те саме, що білки, що зв'язують ДНК спіраль-петлю, які використовуються в багатьох еукаріотичних системах. Розробка основного мотиву HTH, відомого як мотив крилатої спіралі, також зустрічається у різноманітних білках, що зв'язують прокаріотичну ДНК.
Оператор - це послідовність ДНК, яка лежить між промоутером і стартовим сайтом. Він розпізнається лаковим репресором, білком, що зв'язує ДНК з мотивом спіралі спіралі. При відсутності лактози (рис.9.1.1 С) лак-репресор має високу спорідненість до послідовності оператора і щільно зв'язується, перешкоджаючи стартовому майданчику та утворюючи фізичний «блокпост» до транскрипції, запобігаючи руху РНК-полімерази вперед від промотора. Це має сенс фізіологічно, оскільки клітина ефективніше метаболізує глюкозу, і якщо навколо немає лактози, то це марна трата ресурсів, щоб зробити ферменти, які метаболізують її. Однак що робити, якщо раптом в навколишньому середовищі з'являється велика кількість лактози? Коли лактоза потрапляє в клітину, внутрішньоклітинний рівень підвищується, і тепер для використання цього нового джерела їжі необхідні ферменти. Лактоза фактично включає експресію ферментів, які будуть метаболізувати її! Зокрема, лактоза зв'язується з білком лак-репресора (4 місця зв'язування лактози), що спричиняє конформаційну зміну, яка вивільняє її з послідовності операторів (рис.9.1.1 B). Тепер РНК-полімераза, яка приєднується до промотора лак-оперону, може безперешкодно транскрибувати повідомлення, виробляючи РНК і згодом білки, які використовуються для розщеплення лактози. Це триває до тих пір, поки в клітині є велика кількість лактози. У міру зниження рівня лактози протеїни-репресори більше не пов'язані лактозою, і можуть знову зв'язувати оператора і пригнічувати експресію оперону ще раз. На даний момент ігноруйте білок CAP на малюнку9.1.1, а частини D і E. Ми повернемося до цього. Лак-оперон є прикладом індукованого оперона, при якому нативний стан «вимкнено» і введення і індуктора (в даному випадку лактози) зв'яже репресор і включить оперон «на».
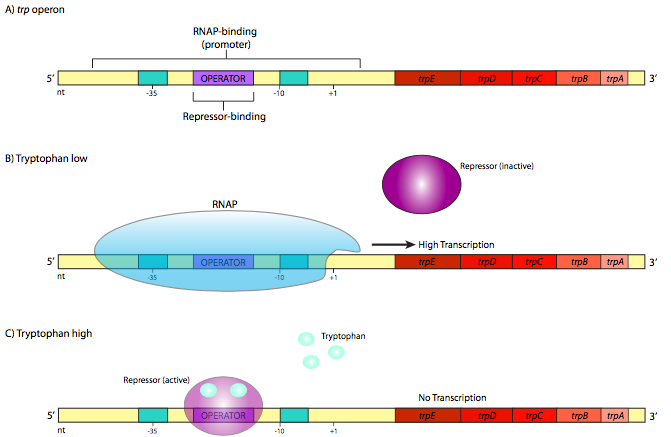
На відміну від них є і оперони з механізмом реверсу. Прикладом одного такого репресивного оперона є трп-оперон (рис.9.1.2). Цей оперон містить гени ve, які беруть участь в синтезі амінокислоти триптофану: TrPe і TrPD, які разом кодують субодиниці антранілатсинтетази, tRpC, який кодує N- (5'- фосфорибозил) -антранілатізомеразу, і TrPb і TrPA, які кожна кодує суб-одиниці триптофансинтетази. Репресор trp більший і складніший, ніж лаковий репресор, але він також використовує мотив ДНК-зв'язування спіралі спіралі спіралі.
Однак він відрізняється вирішальним аспектом. У рідному вигляді він не прив'язується до послідовності opera- tor. Він зв'язується з оператором лише після того, як він має перший зв'язаний триптофан (дві молекули trp зв'язуються з одним репресором). Це протилежність лакового репресора, але при розгляді фізіологічної функції цих генів це повинно мати ідеальний сенс. Поки немає триптофану, оператор незв'язаний, що дозволяє РНК-полімеразі транскрибувати гени, необхідні для виготовлення триптофану (рис.9.1.2 B). Коли в клітині накопичилася достатня кількість триптофану, частина «зайвого» триптофану зв'язується з репресором trp, що активує його і дозволяє зв'язуватися з оператором (рис.9.1.2 С). Коли це трапляється, RNAP не може досягти початкового місця, і ресурси не витрачаються даремно, транскрибуючи гени для ферментів, які роблять те, що клітина вже має багато.
Повернемося тепер до лак-оперону на рис9.1.1. Виявляється, навіть коли оперон індукується наявністю лактози, швидкість транскрипції низька. Обмеження не від репресора - те, що було знято, як описано вище (рис.9.1.1 Б). Натомість низька експресія обумовлена промотором низької спорідненості. Це стосується не тільки лак-оперона, а й інших генів цукрового катаболізму, що не є глюкозо-шляховим. Існує просте пояснення: навіть якщо є багато альтернативних цукрів (наприклад, лактоза), якщо є глюкоза, це найефективніший і кращий шлях клітини для виробництва енергії, а виробництво ферментів для інших шляхів буде неефективним використанням ресурсів. Отже, коли і як насправді включається лак оперон?
Відповідь полягає в CAP, білку активатора гена катаболіту, також відомому як CRP, або білок рецепторів цАМФ. Це невеликий гомодимерний ДНК зв'язуючий білок, який зв'язується з послідовністю, яка перекриває 5' сторону промотора. При наявності цАМФ, який зв'язується з білком, CAP має високу спорідненість до послідовності розпізнавання ДНК, і зв'язується з нею (рис.9.1.1 Е). Потім білок допомагає набирати RNAP на сайт промотора, зв'язуючись безпосередньо з C-термінальним доменом RNAP субодиниці для збільшення спорідненості полімерази для послідовності промотора для подолання слабкого промотора.
Яке відношення до цього має цАМФ? Коли є рясна позаклітинна глюкоза, цАМФ мало. Фермент, який синтезує цАМФ, аденілатциклазу, негативно регулюється транспортом глюкози. Однак, коли глюкози в навколишньому середовищі мало, аденілатциклаза є більш активною, робить цАМФ, який зв'язує CAP і призводить до надійного вироблення ферментів катаболізму лактози. CAP - приклад активатора, який може контролювати експресію генів в позитивному напрямку.
У кишковій паличці рівні цАМФ безпосередньо не пов'язані з внутрішньоклітинним рівнем глюкози або метаболізмом глюкози. Швидше за все, рівні цАМФ змінюються транспортом глюкози через фосфоенолпіруват-залежну систему фосфотрансферази (PTS), частина якої дефосфорилюється (продукт гена crr, також відомий як EIIA) при переміщенні глюкози всередину. Фосфорильований EIIA ~ P є активатором аденілатциклази. Так, коли глюкоза рухається в клітину, рівень цАМФ падає через неактивну аденілатциклази.
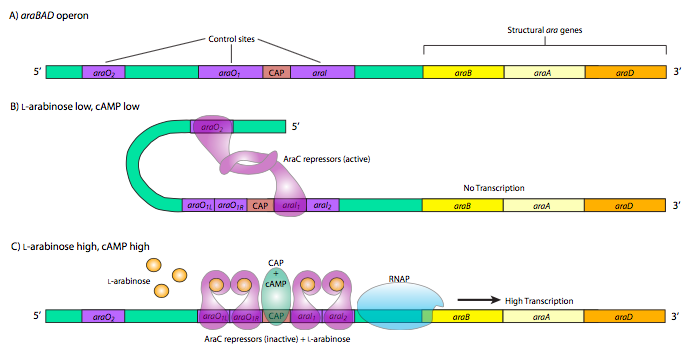
Останнім, і найскладнішим прикладом контролю прокаріотичного метаболічного гена є оперон Арабад. Цей оперон виробляє ферменти, використовувані для катаболізму 5-вуглецевого цукру, L-арабінози. Цікавим у цьому опероні є наявність як позитивних, так і негативних контрольних елементів, які використовуються одним і тим же контрольним білком, AraC. Коли арабіноза мало або взагалі відсутня, AraC зв'язується з операторними послідовностями AraO2 та AraI1. Потім два білки AraC взаємодіють, що змушує ДНК петляти навколо запобігання зв'язуванню RNAP з промотором та транскрипції AraBad. Крім того, цей оперон також знаходиться під контролем CAP, а подвійна структура петлі AraC також запобігає зв'язуванню CAP. Однак, коли існує велика кількість арабінози, AraC repres- sors зв'язують арабінозу, а потім взаємодіють по-різному, все ще утворюючи димери, але тепер в іншій конформації, що призводить до зв'язування AraO1l і AraO1r разом, а також AraI1 і AraI2. Арабінозний зв'язаний AraC на сайтах AraAi взаємодіє з RNAP і разом з CAP сприяють сильній активації експресії AraBad.
Система ремонту SOS
Не всі оперони стурбовані координацією метаболічної діяльності. Важливим неметаболічним опероном кишкової палички є оперон відповіді Lexa/ReCa SOS, який містить гени, які беруть участь у репарації ДНК. Система відновлення SOS використовується, щоб дозволити реплікації ДНК продовжувати через ділянки пошкодженої ДНК, але з покаранням низької вірності. Один з генних продуктів цього оперона, ReCa, важливий для розпізнавання та відновлення пошкоджень, спричинених УФ-світлом. Він також функціонує як регулятор білка репресора LexA. LEXa насправді є репресором для декількох оперонів SOS, прив'язуючись до загальної послідовності операторів вище за течією кожного гена/оперону. Він активується, коли ReCa, при виявленні пошкодження ДНК, зазнає конформаційного зсуву і активує активність протеази, яка потім розщеплює LexA, дозволяючи транскрипцію з генів/оперонів SOS.
Ремонт SOS схильний до помилок, оскільки, коли реплісома стикається з громіздкими пошкодженнями, він зазнає «колапсу вилки реплікації», в якому вивільняються одиниці ДНК-полімерази III. Заміна, або байпас, полімерази, Пол IV (DinB) і Pol V (UmUDC), не мають 3'—5' коректури екзонуклеазної активності. Дезінкорпорація G протилежних тимінових димерів відбувається приблизно з половиною швидкості належного включення А, і, як правило, байпасні полімерази приблизно в 1000 разів більш схильні до помилок, ніж Пол II або Пол I.
