11.7: Регуляція генів - теорія оперонів
- Page ID
- 3912
Цілі навчання
- Порівняйте індуковані оперони і репресивні оперони
- Опишіть, чому важлива регуляція оперонів
Кожна ядерна клітина в багатоклітинному організмі містить копії однієї і тієї ж ДНК. Аналогічно, всі клітини в двох чистих бактеріальних культурах, прищеплених з однієї стартової колонії, містять однакову ДНК, за винятком змін, що виникають внаслідок спонтанних мутацій. Якщо кожна клітина багатоклітинного організму має однакову ДНК, то як це відбувається, що клітини різних частин тіла організму виявляють різні характеристики? Точно так само, як однакові бактеріальні клітини в межах двох чистих культур, що піддаються різним умовам навколишнього середовища, можуть проявляти різні фенотипи? В обох випадках кожна генетично ідентична клітина не включає або не експресує однаковий набір генів. Виражається лише підмножина білків в клітці в даний момент часу.
Геномна ДНК містить як структурні гени, які кодують продукти, що служать клітинними структурами або ферментами, так і регуляторні гени, які кодують продукти, що регулюють експресію генів. Експресія гена є сильно регульованим процесом. Тоді як регулювання експресії генів у багатоклітинних організмах дозволяє проводити клітинну диференціацію, у одноклітинних організмів, таких як прокаріоти, це в першу чергу гарантує, що ресурси клітини не витрачаються даремно, роблячи білки, які клітина не потребує в той час.
Роз'яснення механізмів контролю експресії генів є важливим для розуміння здоров'я людини. Збої в цьому процесі у людини призводять до розвитку онкологічних та інших захворювань. Розуміння взаємодії між експресією гена збудника та експресією його людини є важливим для розуміння конкретного інфекційного захворювання. Генна регуляція включає складну мережу взаємодій всередині даної клітини серед сигналів із середовища клітини, сигнальних молекул всередині клітини та ДНК клітини. Ці взаємодії призводять до експресії одних генів і придушення інших, в залежності від обставин.
Прокаріоти та еукаріоти мають деяку схожість у своїх механізмах регулювання експресії генів; однак експресія генів у еукаріотів складніша через часовий та просторовий поділ між процесами транскрипції та трансляції. Таким чином, хоча більша частина регуляції експресії генів відбувається через транскрипційний контроль у прокаріотів, регуляція експресії генів у еукаріот відбувається на транскрипційному рівні та посттранскрипційно (після того, як була зроблена первинна розшифровка).
Регуляція прокаріотичних генів
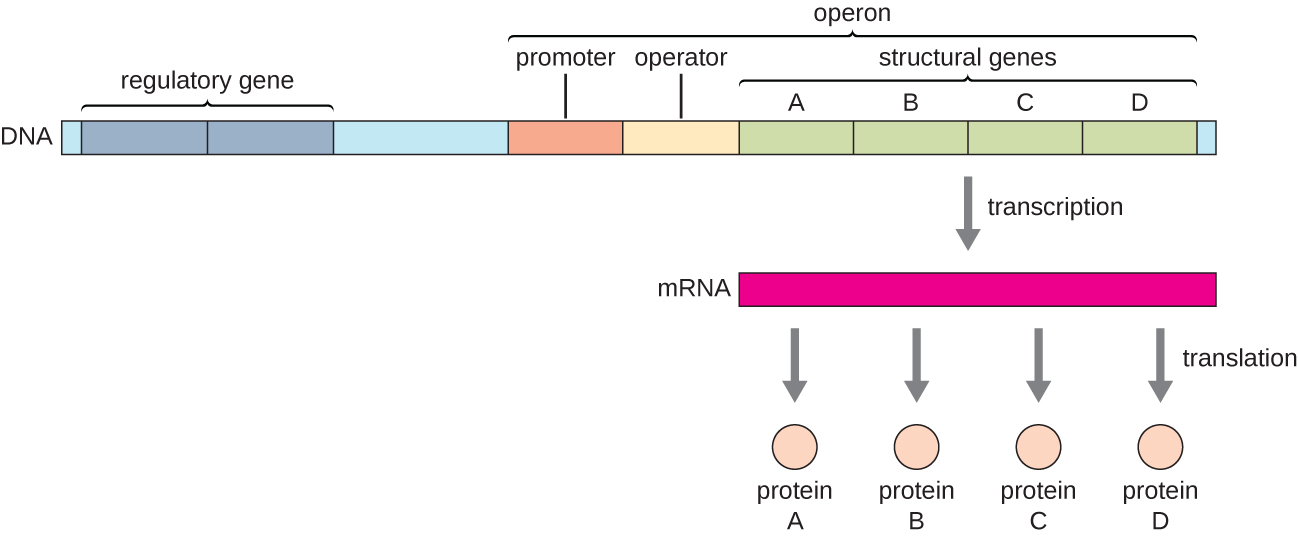
У бактерій і архей структурні білки зі спорідненими функціями зазвичай кодуються разом всередині генома в блоці, званому опероном, і транскрибуються разом під контролем одного промотора, в результаті чого утворюється поліцистронова розшифровка (рис.\(\PageIndex{1}\)). Таким чином, регуляція транскрипції всіх структурних генів, що кодують ферменти, які каталізують багато кроків в одному біохімічному шляху, може контролюватися одночасно, оскільки вони або всі будуть потрібні одночасно, або жоден не знадобиться. Наприклад, у кишкової палички всі структурні гени, які кодують ферменти, необхідні для використання лактози як джерела енергії, лежать поруч один з одним в лактозному (або лаковому) опероні під контролем одного промотора - промотора лаку. Французькі вчені Франсуа Якоб (1920—2013) та Жак Монод з Інституту Пастера першими показали організацію бактеріальних генів в оперони шляхом своїх досліджень на лак-опероні кишкової палички. За цю роботу вони отримали Нобелівську премію з фізіології або медицини в 1965 році. Хоча еукаріотичні гени не організовані в оперони, прокаріотичні оперони є чудовими моделями для вивчення регуляції генів загалом. У еукаріотів є деякі кластери генів, які функціонують подібно до оперонів. Багато принципів можуть бути застосовані до еукаріотичних систем і сприяють нашому розумінню змін експресії генів у еукаріотів, які можуть спричинити патологічні зміни, такі як рак.
Кожен оперон включає послідовності ДНК, які впливають на власну транскрипцію; вони розташовані в області, яка називається регуляторною областю. Регуляторна область включає промотор і область, що оточує промотор, до якої можуть зв'язуватися фактори транскрипції, білки, закодовані регуляторними генами. Фактори транскрипції впливають на зв'язування РНК-полімерази з промотором і дозволяють його прогресуванню транскрибувати структурні гени. Репресор - це фактор транскрипції, який пригнічує транскрипцію гена у відповідь на зовнішній подразник шляхом зв'язування з послідовністю ДНК в межах регуляторної області, яка називається оператором, яка знаходиться між сайтом зв'язування РНК-полімерази промотора і транскрипційним стартовим місцем першого структурний ген. Репресорне зв'язування фізично блокує РНК-полімеразу від транскрибування структурних генів. І навпаки, активатор - це фактор транскрипції, який збільшує транскрипцію гена у відповідь на зовнішній подразник, полегшуючи зв'язування РНК-полімерази з промотором. Індуктор, третій тип регуляторної молекули, являє собою невелику молекулу, яка або активує або пригнічує транскрипцію, взаємодіючи з репресором або активатором.
У прокаріотів є приклади оперонів, генні продукти яких потрібні досить послідовно і експресія яких, отже, нерегульована. Такі оперони конституційно виражені, тобто вони транскрибуються і переводяться безперервно, щоб забезпечити клітину постійними проміжними рівнями білкових продуктів. Такі гени кодують ферменти, що беруть участь у функціях домашнього господарства, необхідних для підтримки клітин, включаючи реплікацію, відновлення та експресію ДНК, а також ферменти, які беруть участь у метаболізмі ядра. На відміну від цього, існують і інші прокаріотичні оперони, які виражаються тільки при необхідності і регулюються репресорами, активаторами та індукторами.
Вправа\(\PageIndex{1}\)
- Які частини в послідовності ДНК оперона?
- Які типи регуляторних молекул існують?
Регулювання репресіями
Прокаріотичні оперони зазвичай контролюються зв'язуванням репресорів з операторними регіонами, тим самим запобігаючи транскрипції структурних генів. Такі оперони класифікуються як або репресивні оперони, або індуковані оперони. Репресивні оперони, як триптофан (trp) оперон, зазвичай містять гени, що кодують ферменти, необхідні для біосинтетичного шляху. Поки продукт шляху, як триптофан, продовжує вимагатися клітині, репресивний оперон буде продовжувати виражатися. Однак, коли продукт біосинтетичного шляху починає накопичуватися в клітині, знімаючи потребу в тому, щоб клітина продовжувала робити більше, експресія оперона пригнічується. І навпаки, індукувані оперони, як лак-оперон кишкової палички, часто містять гени, що кодують ферменти в шляху, що беруть участь у метаболізмі певного субстрату, такого як лактоза. Ці ферменти потрібні лише тоді, коли цей субстрат доступний, тому експресія оперонів зазвичай індукується лише у присутності субстрату.
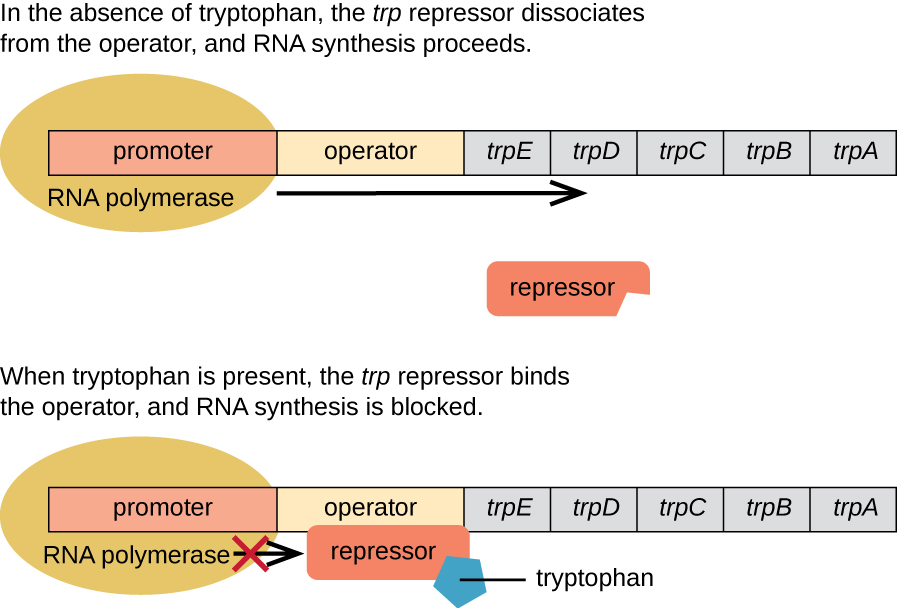
Трип-оперон: репресивний оперон
Кишкова паличка може синтезувати триптофан за допомогою ферментів, які кодуються п'ятьма структурними генами, розташованими поруч один з одним в trp опероні (рис.\(\PageIndex{2}\)). Коли триптофану навколишнього середовища низький, оперон включається. Це означає, що ініціюється транскрипція, гени експресуються, синтезується триптофан. Однак якщо триптофан присутній в навколишньому середовищі, то трп-оперон відключається. Транскрипція не відбувається і триптофан не синтезується.
Коли триптофану немає в клітині, репресор сам по собі не зв'язується з оператором, отже, оперон активний і синтезується триптофан. Однак, коли триптофан накопичується в клітині, дві молекули триптофану зв'язуються з молекулою репресора trp, яка змінює свою форму, дозволяючи їй зв'язуватися з оператором trp. Це зв'язування активної форми репресора trp з оператором блокує РНК-полімеразу від транскрибування структурних генів, зупиняючи експресію оперону. Таким чином, фактичний продукт біосинтетичного шляху, керованого опероном, регулює експресію оперона.
Перегляньте це відео, щоб дізнатися більше про trp operon.
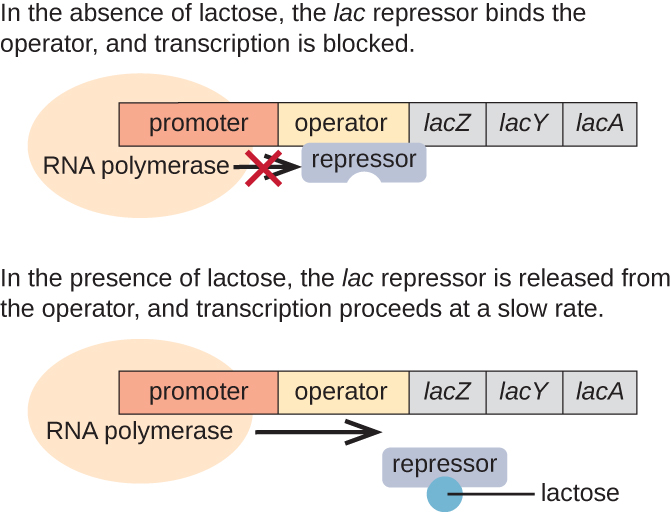
Мереживо Оперон: Індуктивний Оперон
Лак-оперон є прикладом індукуваного оперона, який також піддається активації при відсутності глюкози (рис.\(\PageIndex{3}\)). Лак-оперон кодує три структурні гени, необхідні для придбання і переробки дисахаридної лактози з навколишнього середовища, розщеплюючи її на прості цукру глюкозу і галактозу. Щоб лак-оперон був виражений, повинна бути присутня лактоза. Це має сенс для клітини, оскільки було б енергетично марнотратно створювати ферменти для переробки лактози, якщо лактоза не була доступною.
При відсутності лактози лактоза лак-репресор зв'язується з операторною областю лак-оперона, фізично не даючи РНК-полімеразі транскрибувати структурні гени. Однак при наявності лактози лактоза всередині клітини перетворюється в алолактозу. Алолактоза служить молекулою індуктора, зв'язуючись з репресором і змінюючи свою форму так, що вона вже не здатна зв'язуватися з ДНК оператора. Видалення репресора в присутності лактози дозволяє РНК-полімеразі переміщатися через операторну область і почати транскрипцію лакових структурних генів.
Лак Оперон: Активація протеїном активатора катаболіту
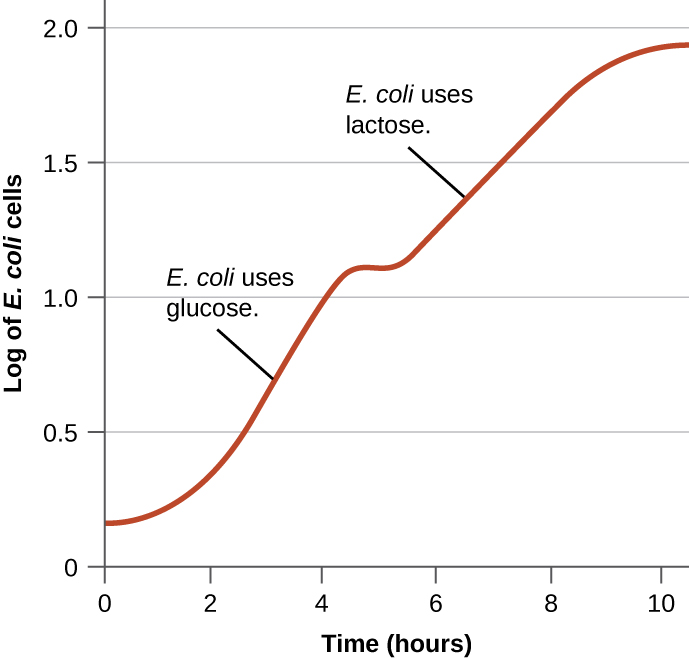
Бактерії, як правило, мають здатність використовувати різні субстрати як джерела вуглецю. Однак, оскільки глюкоза, як правило, краща за інші субстрати, бактерії мають механізми, що гарантують, що альтернативні субстрати використовуються лише тоді, коли глюкоза була виснажена. Крім того, бактерії мають механізми, що гарантують, що гени, що кодують ферменти для використання альтернативних субстратів, виражаються лише тоді, коли доступний альтернативний субстрат. У 1940-х роках Жак Монод першим продемонстрував перевагу певним субстратам перед іншими шляхом своїх досліджень росту кишкової палички при культивуванні в присутності двох різних субстратів одночасно. Такі дослідження породили діауксичні криві зростання, як показано на малюнку\(\PageIndex{4}\). Хоча спочатку використовується краща субстратна глюкоза, кишкова паличка швидко зростає, а ферменти для обміну лактози відсутні. Однак, як тільки рівень глюкози виснажується, темпи росту сповільнюються, індукуючи експресію ферментів, необхідних для метаболізму другого субстрату - лактози. Зверніть увагу, як швидкість росту лактози повільніше, про що свідчить нижча крутизна кривої зростання.
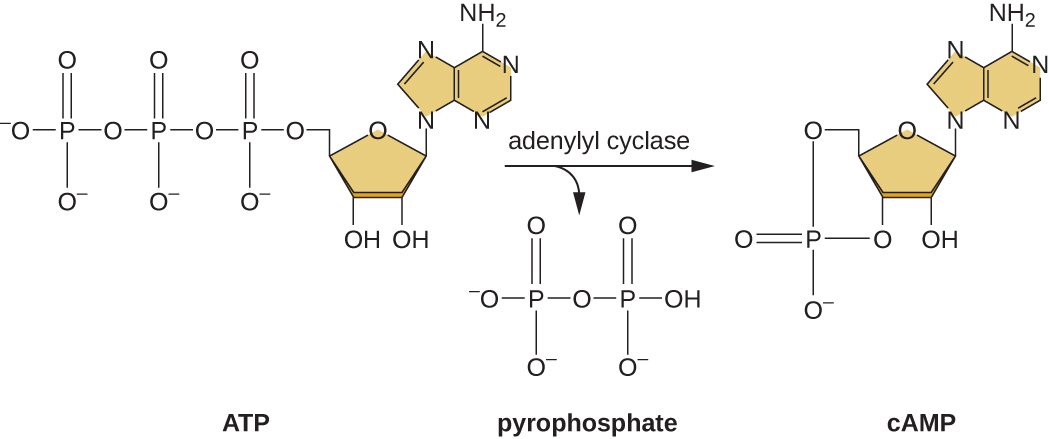
Здатність перемикатися з використання глюкози на інший субстрат, такий як лактоза, є наслідком активності ферменту під назвою Enzyme IIA (EIIA). Коли рівень глюкози падає, клітини виробляють менше АТФ від катаболізму (див. Catabolism вуглеводів), а EIIA стає фосфорильованим. Фосфорильований EIIA активує аденілілциклазу, фермент, який перетворює частину решти АТФ в циклічний АМФ (цАМФ), циклічне похідне AMP та важливу сигнальну молекулу, яка бере участь у метаболізмі глюкози та енергії в кишковій паличці. В результаті в осередку починають підвищуватися рівні цАМФ (рис.\(\PageIndex{5}\)).
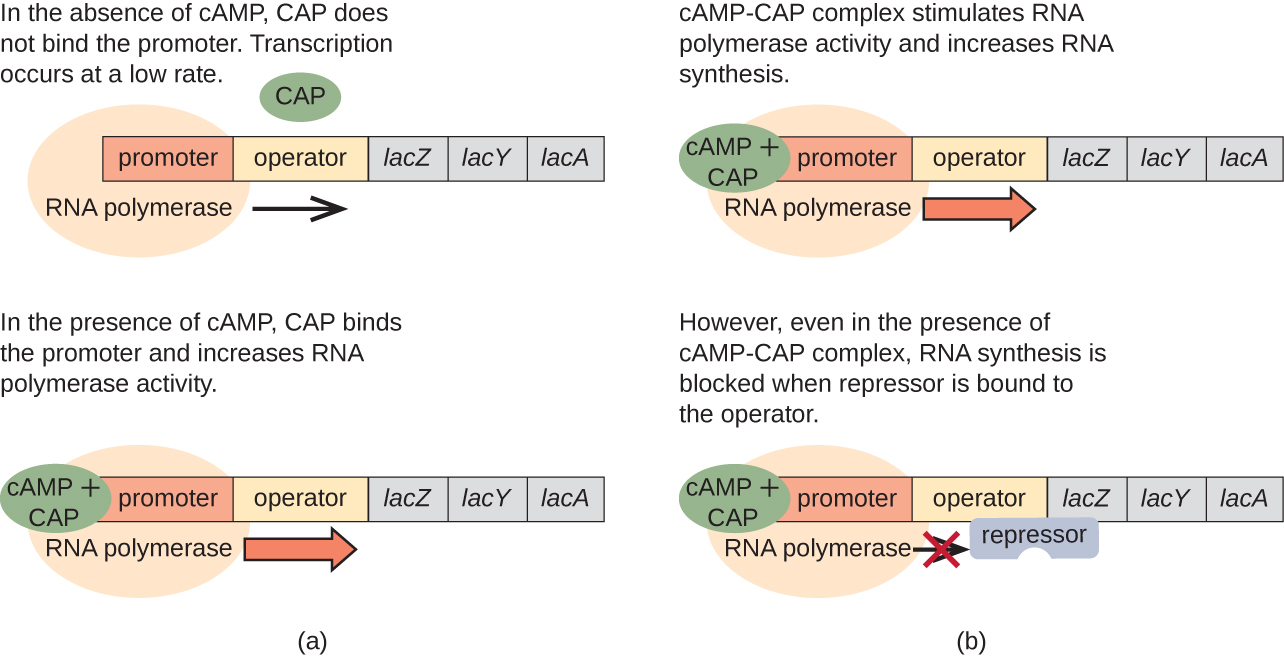
Лак-оперон також відіграє певну роль у цьому переході від використання глюкози до використання лактози. Коли глюкози дефіцитна, накопичується цАМФ, спричинений підвищеною активністю аденілілциклази, зв'язується з білком активатора катаболіту (CAP), також відомим як білок рецепторів цАМФ (CRP). Комплекс зв'язується з промоторной областю лак-оперона (рис.\(\PageIndex{6}\)). У регуляторних областях цих оперонів ділянку зв'язування CAP розташований вище за течією місця зв'язування РНК-полімерази в промоторі. Зв'язування комплексу Cap-camp з цією ділянкою підвищує зв'язуючу здатність РНК-полімерази з промоторною областю ініціювати транскрипцію структурних генів. Таким чином, у випадку з лак-опероном для транскрипції повинна бути присутня лактоза (видалення білка лак-репресора), а рівень глюкози повинен бути виснажений (дозволяючи зв'язувати активуючий білок). Коли рівень глюкози високий, відбувається катаболітне пригнічення оперонів, що кодують ферменти для метаболізму альтернативних субстратів. Через низький рівень цАМФ при цих умовах існує недостатня кількість комплексу CAP-Camp для активації транскрипції цих оперонів. Див. Таблицю\(\PageIndex{1}\) для зведення регуляції лак-оперона.
| Глюкоза | CAP зв'язує | Лактоза | репресор пов'язує | Транскрипція |
|---|---|---|---|---|
| + | — | — | + | Ні |
| + | — | + | — | Деякі |
| — | + | — | + | Ні |
| — | + | + | — | Так |
Дивіться анімований підручник про роботу Lac operon тут.
Вправа\(\PageIndex{2}\)
- Що впливає на прив'язку репресора trp оперона до оператора?
- Як і коли змінюється поведінка білка лак-репресора?
- Окрім того, що він репресивний, як ще регулюється лак-оперон?
Глобальні відповіді прокаріотів
У прокаріотів також існує кілька вищих рівнів регуляції генів, які мають здатність одночасно контролювати транскрипцію багатьох споріднених оперонів у відповідь на сигнал навколишнього середовища. Група оперонів, керованих усіма одночасно, називається регулоном.
Сигналізатори
При відчутті напруги, що насувається, прокаріоти змінюють вираз найрізноманітніших оперонів, щоб реагувати в координації. Вони роблять це за рахунок вироблення алармонів, які є невеликими внутрішньоклітинними похідними нуклеотидів. Алармони змінюють, які гени виражені, і стимулюють експресію специфічних генів стрес-відповіді. Використання алармонів для зміни експресії генів у відповідь на стрес, здається, має важливе значення для патогенних бактерій. При зіткненні з механізмами захисту господаря та іншими суворими умовами під час інфекції багато оперонів, що кодують гени вірулентності, регулюються у відповідь на сигналізацію тривоги. Знання цих відповідей є ключовим для того, щоб мати можливість повністю зрозуміти процес зараження багатьох патогенів та розробку методів лікування для протидії цьому процесу.
Альтернативні σ Фактори
Оскільки субодиниця σ бактеріальної РНК-полімерази надає специфічність щодо того, які промотори слід транскрибувати, зміна використовуваного фактора σ - це ще один спосіб для бактерій швидко та глобально змінити те, що регули транскрибуються в даний час. Коефіцієнт σ розпізнає послідовності всередині бактеріального промотора, тому різні фактори σ розпізнають дещо різні послідовності промоторів. Таким чином, коли клітина відчуває конкретні умови навколишнього середовища, вона може реагувати, змінивши, який фактор σ вона висловлює, погіршуючи старий і виробляючи новий для транскрибування оперонів, що кодують гени, продукти яких будуть корисні в нових умовах навколишнього середовища. Наприклад, у спорулюючих бактерій пологів Bacillus і Clostridium (до складу яких входить безліч патогенів) група σ факторів контролює експресію багатьох генів, необхідних для споруляції у відповідь на споруляційно-стимулюючі сигнали.
Вправа\(\PageIndex{3}\)
- Яку назву дають колекції оперонів, які можна регулювати як групу?
- Який тип подразника викликав би транскрипцію іншого фактора σ?
Додаткові методи регуляції у бактерій: загасання та рибоперемикачі
Хоча більшість експресії генів регулюється на рівні ініціації транскрипції у прокаріотів, існують також механізми контролю як завершення транскрипції, так і перекладу одночасно. З моменту їх відкриття було показано, що ці механізми контролюють завершення транскрипції та перекладу багатьох прокаріотичних оперонів. Оскільки ці механізми безпосередньо пов'язують регуляцію транскрипції та перекладу, вони специфічні для прокаріотів, оскільки ці процеси фізично розділені у еукаріотів.
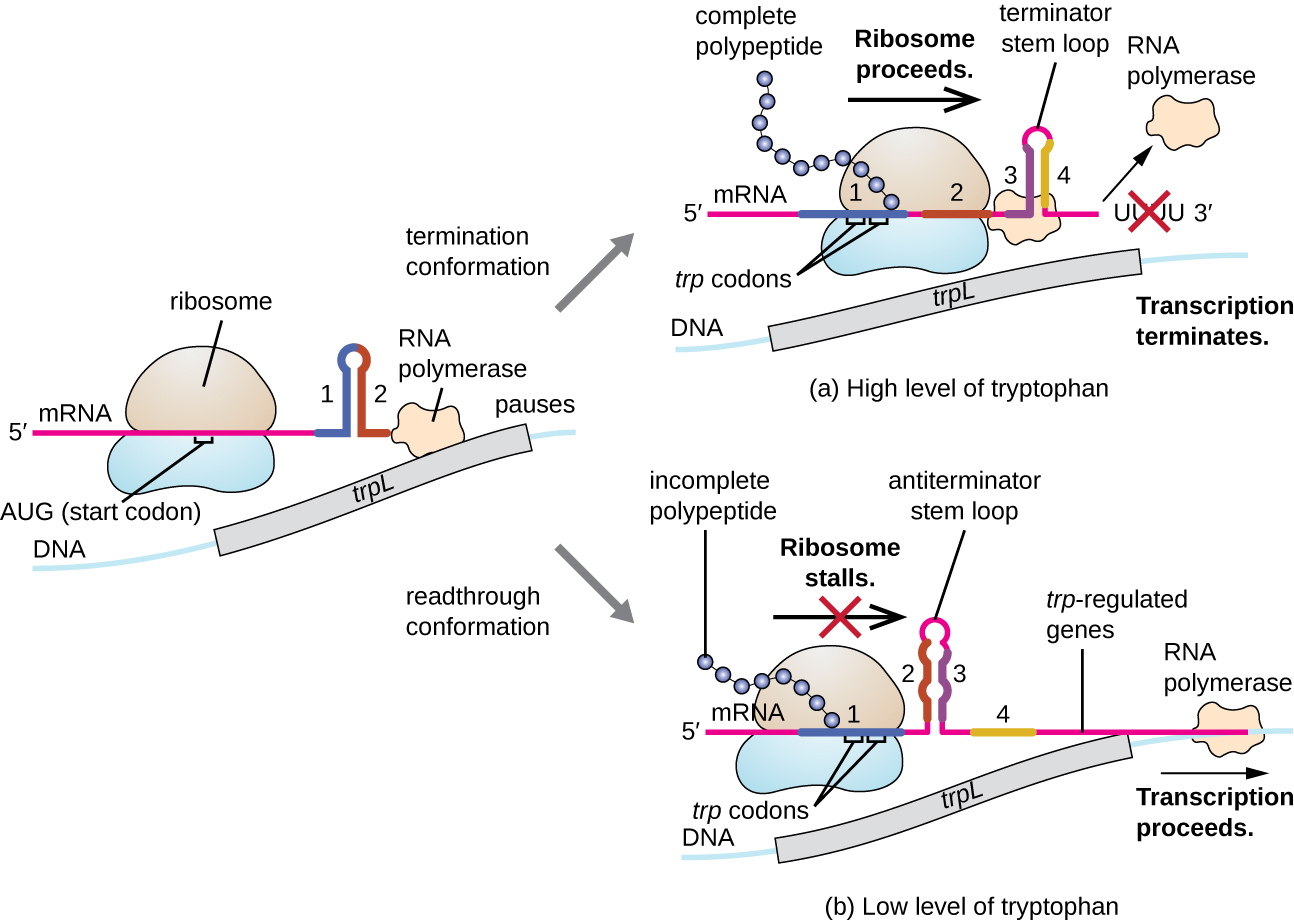
Однією з таких регуляторних систем є ослаблення, при якому вторинні структури стовбурової петлі, утворені в межах 5' кінця мРНК транскрибується визначити, чи відбудеться транскрипція для завершення синтезу цієї мРНК і якщо ця мРНК буде використовуватися для перекладу. Крім вже обговорюваного механізму репресії транскрипції, загасання також контролює експресію trp оперону в кишковій паличці (рис.\(\PageIndex{7}\)). Регуляторна область trp operon містить послідовність лідера, яка називається trPl між оператором і першим структурним геном, який має чотири ділянки РНК, які можуть базувати пару один з одним в різних комбінаціях. Коли утворюється стовбурова петля термінатора, транскрипція закінчується, вивільняючи РНК-полімеразу з мРНК. Однак, коли утворюється стовбурова петля антітермінатора, це запобігає утворенню стовбура-петлі термінатора, тому РНК-полімераза може транскрибувати структурні гени.
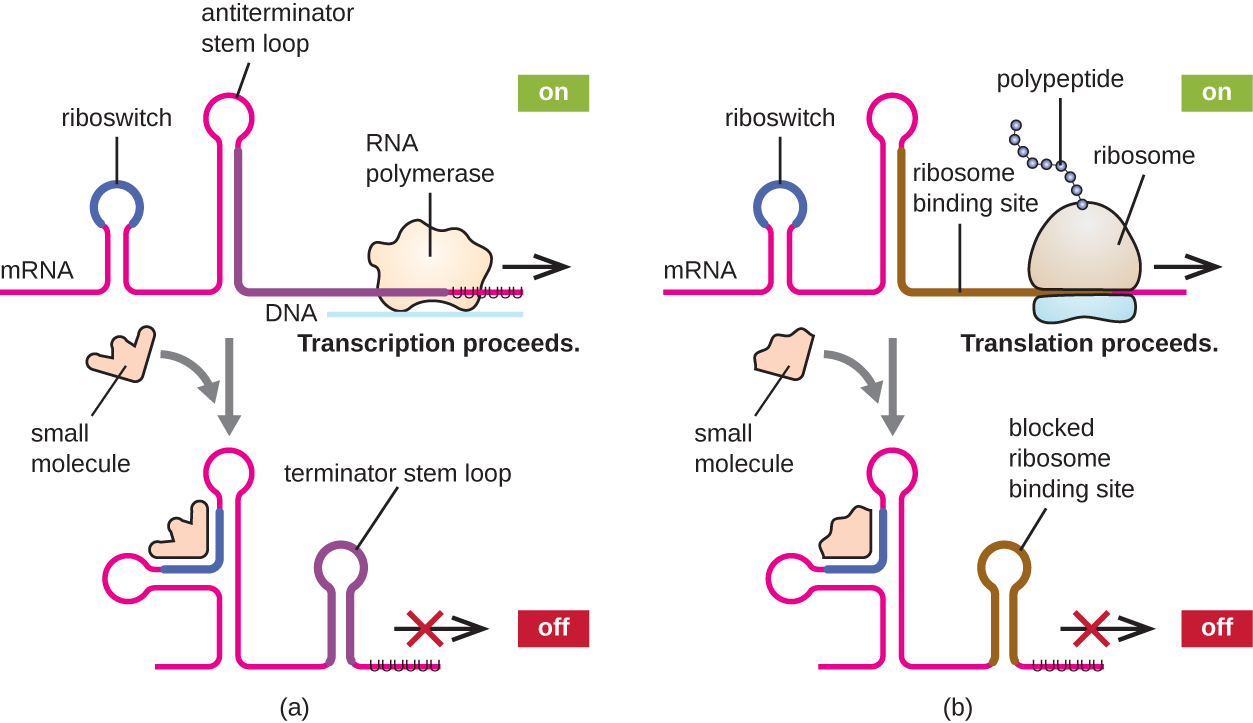
Пов'язаним механізмом одночасної регуляції транскрипції та трансляції у прокаріотів є використання рибоперемикача, невеликої області некодуючої РНК, знайденої в межах 5' кінця деяких молекул прокаріотичної мРНК (рис.\(\PageIndex{8}\)). Рибоперемикач може зв'язуватися з невеликою внутрішньоклітинною молекулою для стабілізації певних вторинних структур молекули мРНК. Зв'язування малої молекули визначає, яка структура стовбурової петлі утворюється, впливаючи тим самим на завершення синтезу мРНК і синтезу білка.
Інші фактори, що впливають на експресію генів у прокаріотів та еукаріотів
Хоча акцент на нашому обговоренні транскрипційного контролю використовував прокаріотичні оперони як приклади, еукаріотичний транскрипційний контроль багато в чому схожий. Як і у прокаріотів, еукаріотичну транскрипцію можна контролювати за допомогою зв'язування факторів транскрипції, включаючи репресори та активатори. Цікаво, що на еукаріотичну транскрипцію може впливати зв'язування білків з областями ДНК, званими підсилювачами, досить далеко від гена, через зациклювання ДНК, полегшене між енхансером і промотором (рис.\(\PageIndex{9}\)). Загалом, регулювання транскрипції є високоефективним способом контролю експресії генів як у прокаріотів, так і у еукаріотів. Однак контроль експресії генів у еукаріотів у відповідь на екологічні та клітинні стреси може здійснюватися додатковими способами без прив'язки факторів транскрипції до регуляторних областей.
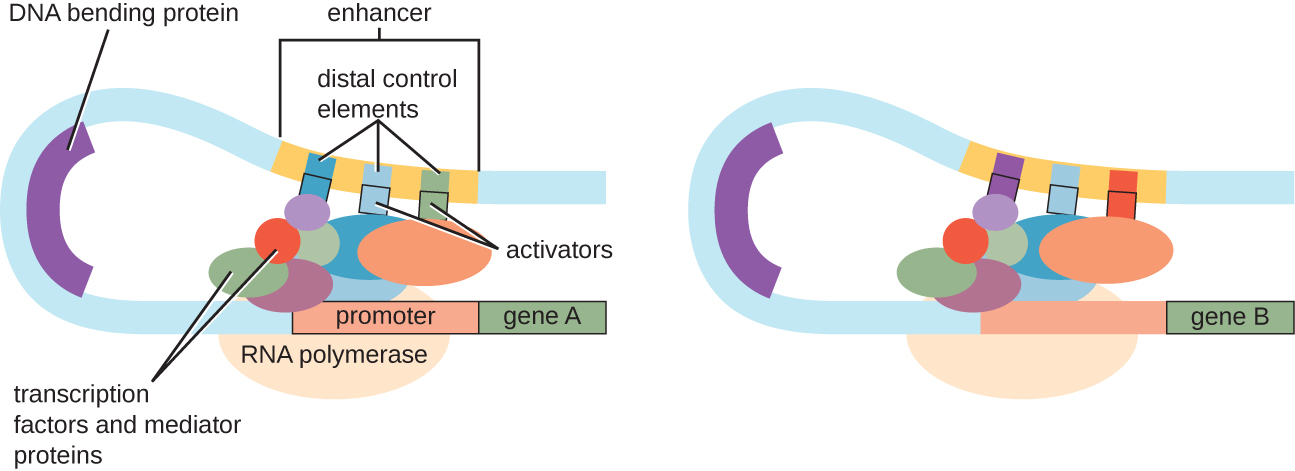
Контроль рівня ДНК
У еукаріотів молекули ДНК або асоційовані гістони можуть бути хімічно модифіковані таким чином, щоб впливати на транскрипцію; це називається епігенетичною регуляцією. Показано, що метилювання деяких нуклеотидів цитозину в ДНК у відповідь на фактори навколишнього середовища впливає на використання такої ДНК для транскрипції, причому метилювання ДНК зазвичай корелює зі зниженим рівнем експресії генів. Крім того, у відповідь на фактори навколишнього середовища білки гістону для упаковки ДНК також можуть бути хімічно модифіковані різними способами, включаючи ацетилювання та деацетилювання, впливаючи на стан упаковки ДНК і тим самим впливаючи на доступність нещільно раної ДНК для транскрипції. Ці хімічні модифікації іноді можуть підтримуватися за допомогою декількох раундів поділу клітин, що робить принаймні деякі з цих епігенетичних змін спадковими.
Це відео описує, як епігенетична регуляція контролює експресію генів.
Вправа\(\PageIndex{}\)
- Що зупиняє або дозволяє транскрипції продовжувати, коли діє загасання?
- Від чого залежить стан рибоперемикача?
- Опишіть функцію енхансера.
- Охарактеризуйте два механізми епігенетичної регуляції у еукаріотів.
Клінічна спрямованість: Дозвіл
Хоча Марк пережив свій бій з некротизуючим фасціїтом, тепер йому доведеться пройти операцію з пластики шкіри з подальшою тривалою фізичною терапією. Виходячи з кількості м'язової маси, яку він втратив, навряд чи його нога повернеться до повної сили, але його фізіотерапевт оптимістичний, що він поверне певну користь від ноги.
Лабораторне дослідження виявило збудником інфекції Марка був штам стрептокока групи А (стрептокок групи А). Як того вимагає закон, справа Марка була доведена до державного департаменту охорони здоров'я та, зрештою, до Центрів контролю та профілактики захворювань (CDC). На CDC штам стрептопу групи А, виділений від Марка, був проаналізований більш ретельно на стійкість до метициліну.
Резистентність до метициліну генетично кодується і стає все більш поширеним у стрептовій групі А через горизонтальний перенесення генів. При некротизуючому фасциїті приплив крові до інфікованої області зазвичай обмежений через дію різних генетично закодованих бактеріальних токсинів. Ось чому, як правило, мало кровотечі в результаті тесту на розріз. На жаль, ці бактеріальні токсини обмежують ефективність внутрішньовенних антибіотиків для очищення інфекції від шкіри та підлеглих тканин, а це означає, що сама по собі стійкість до антибіотиків не пояснює неефективності лікування Марка. Тим не менш, внутрішньовенна антибіотикотерапія була виправдана, щоб допомогти мінімізувати можливий результат сепсису, який є поширеним результатом некротизуючого фасціїту. Завдяки геномному аналізу CDC штаму, виділеного від Марка, було показано, що кілька важливих генів вірулентності кодуються на пророцтвах, що вказує на те, що трансдукція важлива для горизонтального перенесення генів цих генів від однієї бактеріальної клітини до іншої.
Ключові поняття та резюме
- Експресія генів - це жорстко регламентований процес.
- Експресія генів у прокаріотів значною мірою регулюється в точці транскрипції. Експресія генів у еукаріотів додатково регулюється після транскрипції.
- Прокаріотичні структурні гени спорідненої функції часто організовані в оперони, всі контролюються транскрипцією з одного промотора. Регуляторна область оперону включає сам промотор та область, що оточує промотор, до якої фактори транскрипції можуть зв'язуватися, щоб впливати на транскрипцію.
- Хоча деякі оперони виражені конституційно, більшість підлягають регулюванню за допомогою факторів транскрипції (репресорів і активаторів). Репресор зв'язується з оператором, послідовністю ДНК в межах регуляторної області між ділянкою зв'язування РНК полімерази в промоторі і першим структурним геном, тим самим фізично блокуючи транскрипцію цих оперонів. Активатор зв'язується в межах регуляторної області оперона, допомагаючи РНК-полімеразі зв'язуватися з промотором, тим самим посилюючи транскрипцію цього оперона. Індуктор впливає на транскрипцію через взаємодію з репресором або активатором.
- Trp operon - класичний приклад репресивного оперона. Коли триптофан накопичується, триптофан зв'язується з репресором, який потім зв'язується з оператором, перешкоджаючи подальшій транскрипції.
- Лак оперон - класичний приклад індукованого оперона. Коли лактоза присутня в клітині, вона перетворюється в алолактозу. Алолактоза діє як індуктор, зв'язуючись з репресором і перешкоджаючи зв'язуванню репресора з оператором. Це дозволяє транскрипцію структурних генів.
- Лак-оперон також підлягає активації. Коли рівень глюкози виснажується, деякі клітинні АТФ перетворюються в цАМФ, який зв'язується з білком катаболіт-активатора (CAP). Комплекс Camp-cap активує транскрипцію лак-оперона. Коли рівень глюкози високий, її наявність перешкоджає транскрипції лак-оперона та інших оперонів шляхом репресії катаболітів.
- Невеликі внутрішньоклітинні молекули, звані алармонами, виготовляються у відповідь на різні стреси навколишнього середовища, дозволяючи бактеріям контролювати транскрипцію групи оперонів, званої регулоном.
- Бактерії мають здатність змінювати, який σ фактор РНК-полімерази вони використовують у відповідь на умови навколишнього середовища, щоб швидко та глобально змінити, які регулятори транскрибуються.
- Прокаріоти мають регуляторні механізми, включаючи загасання та використання рибоперемикачів, для одночасного контролю завершення транскрипції та перекладу з цієї стенограми. Ці механізми працюють через формування стовбурових петель в 5' кінці молекули мРНК, що синтезується в даний час.
- Існують додаткові точки регуляції експресії генів у прокаріотів і еукаріот. У еукаріотів епігенетична регуляція шляхом хімічної модифікації ДНК або гістонів, а також регуляція обробки РНК є двома методами.
