2.2: Вода
- Page ID
- 1431
Навички для розвитку
- Опишіть властивості води, які мають вирішальне значення для підтримки життя
- Поясніть, чому вода є відмінним розчинником
- Наведіть приклади когезійних та адгезійних властивостей води
- Обговоріть роль кислот, основ та буферів у гомеостазі
Навіщо вчені витрачають час на пошуки води на інших планетах? Чому вода так важлива? Це тому, що вода важлива для життя, як ми її знаємо. Вода є однією з найбагатших молекул і найбільш критичною для життя на Землі. Приблизно 60-70 відсотків людського тіла складається з води. Без нього життя, як ми його знаємо, просто не існувало б.
Полярність молекули води і утворюється нею водневий зв'язок роблять воду унікальною речовиною з особливими властивостями, які тісно пов'язані з процесами життєдіяльності. Життя спочатку еволюціонувало у водянистому середовищі, і більша частина клітинної хімії та метаболізму організму відбувається всередині водянистого вмісту цитоплазми клітини. Особливими властивостями води є її висока теплоємність і теплота випаровування, здатність розчиняти полярні молекули, її когезійні та адгезійні властивості, а також її дисоціація на іони, що призводить до утворення рН. Розуміння цих характеристик води допомагає з'ясувати її важливість у підтримці життя.
Полярність води
Однією з важливих властивостей води є те, що вона складається з полярних молекул: водень і кисень у молекулах води (H 2 O) утворюють полярні ковалентні зв'язки. Поки немає чистого заряду молекули води, полярність води створює трохи позитивний заряд на водні і трохи негативний заряд на кисень, сприяючи властивостям тяжіння води. Заряди води генеруються тому, що кисень є більш електронегативним, ніж водень, що робить більш імовірним, що спільний електрон буде знайдений поблизу ядра кисню, ніж водневе ядро, таким чином генеруючи частковий негативний заряд поблизу кисню.
В результаті полярності води кожна молекула води притягує інші молекули води через протилежних зарядів між молекулами води, утворюючи водневі зв'язки. Вода також притягує або притягується до інших полярних молекул і іонів. Полярна речовина, яка легко взаємодіє з водою або розчиняється у воді, називається гідрофільним (гідро- = «вода»; -фільний = «люблячий»). Навпаки, неполярні молекули, такі як олії та жири, погано взаємодіють з водою, як показано на малюнку,\(\PageIndex{1}\) і відокремлюються від неї, а не розчиняються в ній, як ми бачимо в заправках для салатів, що містять олію та оцет (кислий водний розчин). Ці неполярні сполуки називаються гідрофобними (гідро- = «вода»; -фобні = «боязнь»).

Стани води: газ, рідина та тверда речовина
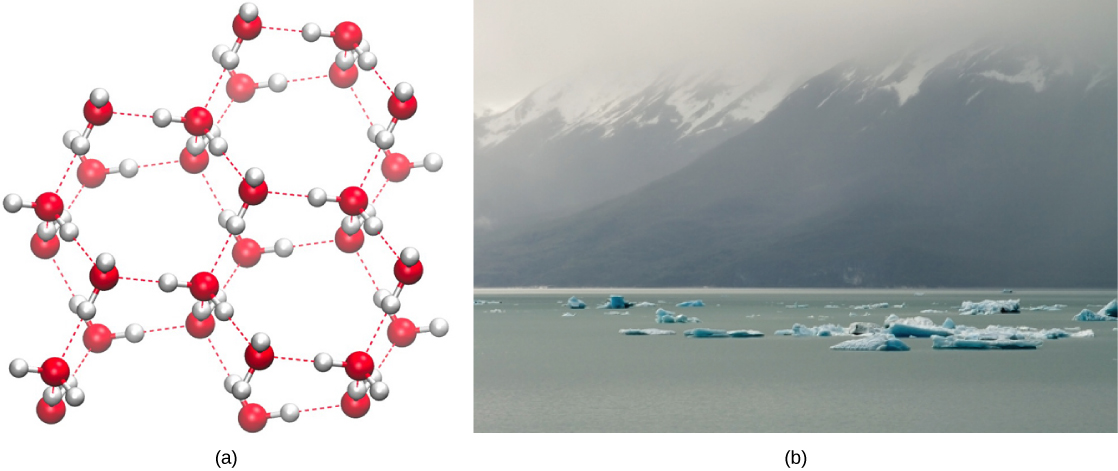
Освіта водневих зв'язків є важливою якістю рідкої води, яка має вирішальне значення для життя, як ми її знаємо. Оскільки молекули води утворюють водневі зв'язки між собою, вода набуває деяких унікальних хімічних характеристик порівняно з іншими рідинами, і, оскільки живі істоти мають високий вміст води, розуміння цих хімічних особливостей є ключовим для розуміння життя. У рідкій воді водневі зв'язки постійно утворюються і порушуються, коли молекули води ковзають один за одного. Розрив цих зв'язків викликається рухом (кінетичною енергією) молекул води за рахунок тепла, що міститься в системі. Коли тепло піднімається під час кипіння води, вища кінетична енергія молекул води призводить до повного розриву водневих зв'язків і дозволяє молекулам води виходити в повітря як газ (пара або водяна пара). З іншого боку, коли температура води знижується і вода замерзає, молекули води утворюють кристалічну структуру, що підтримується водневим зв'язком (недостатньо енергії для розриву водневих зв'язків), що робить лід менш щільним, ніж рідка вода, явище не спостерігається при затвердінні інших рідини.
Більш низька щільність води в її твердій формі обумовлена тим, як водневі зв'язки орієнтуються під час замерзання: молекули води розсуваються далі в порівнянні з рідкою водою. З більшістю інших рідин затвердіння при перепадах температури включає зниження кінетичної енергії між молекулами, що дозволяє їм упаковувати ще щільніше, ніж в рідкому вигляді, і надання твердому речовині більшої щільності, ніж рідина.
Менша щільність льоду, проілюстрована та зображена на малюнку\(\PageIndex{2}\), аномалія, змушує його плавати біля поверхні рідкої води, наприклад, в айсберзі або в кубиках льоду в склянці крижаної води. В озерах і ставках на поверхні води буде утворюватися лід, створюючи ізоляційний бар'єр, який захищає тваринний і рослинний світ у ставку від замерзання. Без цього шару ізолюючого льоду рослини і тварини, що живуть у ставку, замерзли б у твердій брилі льоду і не змогли б вижити. Згубний вплив заморожування на живі організми викликається розширенням льоду щодо рідкої води. Кристали льоду, що утворюються при заморожуванні, розривають делікатні мембрани, необхідні для функціонування живих клітин, необоротно пошкоджуючи їх. Клітини можуть пережити замерзання лише в тому випадку, якщо вода в них тимчасово замінена іншою рідиною на кшталт гліцерину.
Посилання на навчання

Відео: Натисніть тут, щоб побачити 3-D анімацію структури крижаної решітки. (Кредит зображення: Джейн Уїтні. Зображення створено за допомогою програмного забезпечення Visual Molecular Dynamics 2)
Висока теплоємність води
Висока теплоємність води - це властивість, спричинена зв'язком водню між молекулами води. Вода має найвищу питому теплоємність з будь-яких рідин. Питома теплота визначається як кількість тепла, який один грам речовини повинен поглинати або втратити, щоб змінити свою температуру на один градус Цельсія. Для води ця кількість становить одну калорію. Тому вода довго нагрівається і довго охолоджується. Насправді питома теплоємність води приблизно в п'ять разів більше, ніж у піску. Це пояснює, чому суша остигає швидше, ніж море. Завдяки високій теплоємності вода використовується теплокровними тваринами для більш рівномірного розсіювання тепла в їх тілах: вона діє аналогічно системі охолодження автомобіля, транспортуючи тепло з теплих місць в прохолодні місця, змушуючи організм підтримувати більш рівномірну температуру.
Теплота випаровування води
Вода також має високу теплоту випаровування, кількість енергії, необхідної для зміни одного грама рідкої речовини на газ. Для здійснення цієї зміни води потрібно значна кількість теплової енергії (586 кал). Цей процес відбувається на поверхні води. У міру нагрівання рідкої води водневий зв'язок ускладнює відокремлення молекул рідкої води один від одного, що потрібно для того, щоб вона увійшла в свою газоподібну фазу (пар). Як результат, вода діє як радіатор або тепловий резервуар і вимагає набагато більше тепла для кипіння, ніж рідина, така як етанол (зерновий спирт), водневий зв'язок з іншими молекулами етанолу слабкіший, ніж водневий зв'язок води. Зрештою, коли вода досягає температури кипіння 100° Цельсія (212° за Фаренгейтом), тепло здатне розірвати водневі зв'язки між молекулами води, а кінетична енергія (рух) між молекулами води дозволяє їм виходити з рідини як газ. Навіть коли нижче температури кипіння, окремі молекули води отримують достатньо енергії від інших молекул води, так що деякі молекули поверхневої води можуть виходити і випаровуватися: цей процес відомий як випаровування.
Той факт, що водневі зв'язки потрібно розірвати, щоб вода випарувалася, означає, що в процесі використовується значна кількість енергії. У міру випаровування води енергія забирається процесом, охолоджуючи середовище, де відбувається випаровування. У багатьох живих організмах, в тому числі і у людини, випаровування поту, що становить 90 відсотків води, дозволяє організму охолодитися, щоб можна було підтримувати гомеостаз температури тіла.
Властивості розчинника води
Оскільки вода є полярною молекулою зі злегка позитивними і трохи негативними зарядами, в ній легко можуть розчинятися іони і полярні молекули. Тому воду називають розчинником, речовиною, здатною розчиняти інші полярні молекули і іонні сполуки. Заряди, пов'язані з цими молекулами, будуть утворювати водневі зв'язки з водою, оточуючи частинку молекулами води. Це називається сферою гідратації, або оболонкою гідратації, як показано на малюнку
Перегляньте це відео для простого пояснення рН та його логарифмічної шкали.
То як організми, чиї тіла потребують майже нейтрального рН, можуть проковтнути кислі та основні речовини (наприклад, людина, яка п'є апельсиновий сік) і вижити? Буфери - це ключ. Буфери легко поглинають надлишок H + або OH - зберігаючи рН тіла ретельно підтримується у вузькому діапазоні, необхідному для виживання. Підтримка постійного рН крові має вирішальне значення для самопочуття людини. Буфер, що підтримує рН крові людини, включає вугільну кислоту (H 2 CO 3), іон бікарбонату (HCO 3 -) та вуглекислий газ (CO 2). Коли бікарбонатні іони з'єднуються з вільними іонами водню і стають вугільною кислотою, іони водню видаляються, помірковуючи зміни рН. Аналогічно, як показано на малюнку\(\PageIndex{8}\), надлишок вугільної кислоти може перетворитися на вуглекислий газ і видихатися через легені. Це запобігає накопиченню занадто великої кількості вільних іонів водню в крові та небезпечному зниженню рН крові. Так само, якщо занадто багато OH — введено в систему, вугільна кислота буде поєднуватися з нею, щоб створити бікарбонат, знижуючи рН. Без цієї буферної системи рН організму коливався б достатньо, щоб поставити виживання під загрозу.
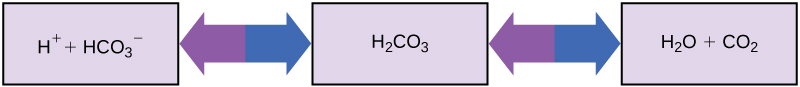
Інші приклади буферів - антациди, що використовуються для боротьби з надлишком шлункової кислоти. Багато з цих ліків без рецепта працюють так само, як і буфери крові, як правило, з принаймні одним іоном, здатним поглинати водень і помірковувати рН, приносячи полегшення тим, хто страждає «печією» після їжі. Унікальні властивості води, які сприяють цій здатності збалансувати рН, а також інші характеристики води - мають важливе значення для підтримки життя на Землі.
Посилання на навчання

Щоб дізнатися більше про воду. Відвідайте США Геологічна служба водних наук для шкіл Все про воду! сайт.
Резюме
Вода має багато властивостей, які мають вирішальне значення для підтримки життя. Це полярна молекула, що дозволяє утворювати водневі зв'язки. Водневі зв'язки дозволяють іонам та іншим полярним молекулам розчинятися у воді. Тому вода є відмінним розчинником. Водневі зв'язки між молекулами води призводять до того, що вода має високу теплоємність, тобто для підвищення її температури потрібно багато доданого тепла. При підвищенні температури водневі зв'язки між водою постійно розриваються і утворюються заново. Це дозволяє загальній температурі залишатися стабільною, хоча в систему додається енергія. Вода також демонструє високу теплоту випаровування, що є ключовим для того, як організми охолоджуються випаровуванням поту. Зчеплення сили води дозволяють забезпечити властивість поверхневого натягу, тоді як її адгезійні властивості розглядаються, коли вода піднімається всередині капілярних трубок. Значення рН є мірою концентрації іонів водню в розчині і є однією з багатьох хімічних характеристик, яка високо регулюється в живих організмах за допомогою гомеостазу. Кислоти та основи можуть змінювати значення рН, але буфери, як правило, помірковують зміни, які вони викликають. Ці властивості води тісно пов'язані з біохімічними та фізичними процесами, що здійснюються живими організмами, і життя було б дуже іншим, якби ці властивості були змінені, якби воно взагалі могло існувати.
Виноски
- 1 В. Хамфрі В., Далке, і К. Шультен, «VMD - візуальна молекулярна динаміка», Журнал молекулярної графіки 14 (1996): 33-38.
- 2 В. Хамфрі В., Далке, і К. Шультен, «VMD - візуальна молекулярна динаміка», Журнал молекулярної графіки 14 (1996): 33-38.
Глосарій
- кислота
- молекула, яка дарує іони водню і збільшує концентрацію іонів водню в розчині
- адгезії
- тяжіння між молекулами води та іншими молекулами
- база
- молекула, яка дарує гідроксидні іони або іншим чином пов'язує надлишкові іони водню і зменшує концентрацію іонів водню в розчині
- буфер
- речовина, що запобігає зміні рН шляхом поглинання або виділення водню або гідроксиду іонів
- калорійність
- кількість тепла, необхідного для зміни температури одного грама води на один градус Цельсія
- капілярна дія
- відбувається тому, що молекули води притягуються до зарядів на внутрішніх поверхнях вузьких трубчастих структур, таких як скляні трубки, витягуючи молекули води до боків трубок
- згуртованості
- міжмолекулярні сили між молекулами води, викликані полярною природою води; відповідають за поверхневий натяг
- дисоціація
- вивільнення іона з молекули такий, що вихідна молекула тепер складається з іона і заряджених залишків оригіналу, наприклад, коли вода дисоціюється на H + і OH -
- випаровування
- відділення окремих молекул від поверхні водойми, листя рослини або шкіри організму
- теплота випаровування води
- велика кількість енергії, необхідної для того, щоб рідка вода перетворилася на водяну пару
- гідрофільний
- описує іони або полярні молекули, які добре взаємодіють з іншими полярними молекулами, наприклад водою
- гідрофобних
- описує незаряджені неполярні молекули, які погано взаємодіють з полярними молекулами, такими як вода
- лакмусовий папір
- (також, pH папір) фільтрувальний папір, який був оброблений природним водорозчинним барвником, який змінює свій колір у міру зміни рН навколишнього середовища, тому його можна використовувати як показник рН
- pH папір
- см лакмусовий папір
- шкала рН
- шкала в діапазоні від нуля до 14, що обернено пропорційна концентрації іонів водню в розчині
- розчинник
- речовина, здатне розчиняти іншу речовину
- питома теплоємність
- кількість тепла один грам речовини повинен поглинути або втратити, щоб змінити його температуру на один градус Цельсія
- сфера гідратації
- коли полярна молекула води оточує заряджені або полярні молекули, таким чином зберігаючи їх розчиненими і в розчині
- поверхневий натяг
- натяг на поверхні тіла рідини, що перешкоджає відділенню молекул; створюється привабливими силами зчеплення між молекулами рідини
