4.1: Ферменти
- Page ID
- 5454
Ферменти є каталізаторами. Більшість - це білки. (Було виявлено кілька ферментів рибонуклеопротеїну, і для деяких з них каталітична активність знаходиться в частині РНК, а не в білковій частині. Посилання на обговорення цих рибозимів). Ферменти тимчасово зв'язуються з одним або декількома реагентами - субстратом (ами) - реакції, яку вони каталізують. При цьому вони знижують необхідну кількість енергії активації і тим самим прискорюють реакцію.

Приклади:
- Каталаза каталізує розкладання перекису водню на воду і кисень. \[2H_2O_2 \rightarrow 2H_2O + O_2\]Одна молекула каталази може розбивати 40 мільйонів молекул пероксиду водню кожну секунду.
- Карбоангідрази він міститься в еритроцитах, де він каталізує реакцію. \[CO_2 + H_2O \rightleftharpoons H^+ + HCO_3^−\]Це дозволяє еритроцитам транспортувати вуглекислий газ з тканин до легенів. Одна молекула карбоангідрази може переробляти по одному мільйону молекул СО 2 кожну секунду.
- Ацетилхолінестераза каталізує розпад нейромедіатора ацетилхоліну при декількох типах синапсів, а також на нервово-м'язовому з'єднанні — спеціалізованому синапсі, який запускає скорочення скелетних м'язів. Одна молекула ацетилхолінестерази розщеплює 25000 молекул ацетилхоліну кожну секунду. Така швидкість робить можливим швидке «скидання» синапсу для передачі іншого нервового імпульсу.
Активність ферментів може бути проаналізована кількісно. Щоб виконати свою роботу, фермент повинен об'єднатися - навіть якщо коли-небудь так коротко - принаймні з одним з реагентів. У більшості випадків сили, які утримують субстрат в активній ділянці ферменту, є нековалентними, асортиментом водневих зв'язків, іонними взаємодіями та гідрофобними взаємодіями.
Більшість цих взаємодій слабкі, і особливо якщо залучені атоми знаходяться далі, ніж приблизно один ангстрем один від одного. Так успішне зв'язування субстрату в активній ділянці ферменту вимагає, щоб дві молекули змогли наблизитися один до одного впритул по досить широкій поверхні. Таким чином, аналогія, що молекула субстрату зв'язує свій фермент, як ключ у замок. Ця вимога комплементарності в конфігурації субстрату і ферменту пояснює чудову специфічність більшості ферментів. Як правило, даний фермент здатний каталізувати лише одну хімічну реакцію або, щонайбільше, кілька реакцій за участю субстратів, що мають однакову загальну структуру.
Конкурентне гальмування
Необхідність тісного, якщо короткого, прилягання між ферментом і субстратом пояснює явище конкурентного гальмування. Одним з ферментів, необхідних для виділення енергії всередині клітини, є бурштинова дегідрогеназа. Він каталізує окислення (шляхом видалення двох атомів водню) бурштинової кислоти. Якщо додати малонову кислоту до клітин, або в пробірку суміш бурштинової кислоти і ферменту, дія ферменту сильно пригнічується. Це пояснюється тим, що структура малонової кислоти дозволяє їй зв'язуватися з одним і тим же ділянкою на ферменті. Але немає окислення, тому не відбувається якнайшвидшого виділення продуктів. Інгібування називають конкурентним, тому що якщо збільшити співвідношення бурштинової до малонової кислоти в суміші, ви поступово відновите швидкість каталізу. При співвідношенні 50:1 дві молекули конкурують приблизно на рівних умовах за зв'язування (= каталітичний) сайт на ферменті.
ферментні кофактори
Багато ферменти вимагають наявності додаткового небілка - кофактора.
- Деякі з них - іони металів, такі як Zn 2+ (кофактор вуглеангідрази), Cu 2+, Mn 2+, K + та Na +.
- Деякі кофактори - це невеликі органічні молекули, які називаються коферментами. Вітаміни групи В тіамін (В1), рибофлавін (В2) і нікотинамід
є попередниками коферментів.
Коензими можуть бути ковалентно пов'язані з білковою частиною (званої апоферментом) ферментів як протезної групи. Інші зв'язуються більш вільно і, по суті, можуть зв'язуватися лише тимчасово з ферментом, коли він виконує свій каталітичний акт.
У природі зустрічається ряд лізоцимів; у людських сльозах та яєчному білку, наприклад. Фермент є антибактеріальним, оскільки він руйнує полісахарид, який міститься в клітинних стінках багатьох бактерій. Він робить це, каталізуючи введення молекули води при формуванні глікозидного зв'язку. Цей гідроліз розриває ланцюг в цей момент.
Бактеріальний полісахарид складається з довгих ланцюгів чергуються аміноцукрів:
- N-ацетилглюкозамін (NAG)
- N-ацетилмурамінова кислота (NAM)
Ці гексозні одиниці нагадують глюкозу за винятком наявності бічних ланцюгів, що містять аміногрупи.
Лізоцим - кулястий білок з глибокою щілиною поперек його поверхні. У цю щілину укладається шість гексоз субстрату. З такою кількістю атомів кисню в цукрах, цілих 14 водневих зв'язків утворюються між шістьма аміноцукрами та певними амінокислотними R групами, такими як Arg-114, Asn-37, Asn-44, Trp-62, Trp-63 та Asp-101. Деякі водневі зв'язки також утворюються з групами C = O декількох пептидних зв'язків. Крім того, гідрофобні взаємодії можуть допомогти утримувати субстрат в положенні.
Рентгенівська кристалографія показала, що в міру об'єднання лізоциму і його субстрату кожен трохи деформується. Четверта гексоза в ланцюжку (кільце #4) стає викрученою зі свого нормального положення. Це накладає навантаження на зв'язок С-О на кільцево-4 стороні кисневого моста між кільцями 4 і 5. Саме в цей момент полісахарид порушується. Між цими двома гексозами вставляється молекула води, яка розриває ланцюг. Ось, отже, структурний погляд на те, що означає знизити енергію активації. Енергія, необхідна для розриву цього ковалентного зв'язку, нижча тепер, коли атоми, з'єднані зв'язком, були спотворені зі свого нормального положення.
Що стосується самого лізоциму, зв'язування субстрату викликає невеликий (~ 0,75Å) рух певних залишків амінокислот, тому щілина трохи закривається над його субстратом. Таким чином, «замок», а також «ключ» змінює форму, коли вони об'єднуються. (Це іноді називають «індукованим приляганням».)
Залишки амінокислот в околицях кілець 4 і 5 забезпечують правдоподібний механізм завершення каталітичного акту. Залишок 35, глутамінова кислота (Glu-35), становить близько 3Å від -O- моста, який повинен бути розбитий. Вільна карбоксильна група глутамінової кислоти є донором іонів водню і доступна для перенесення Н + до атома кисню. Це порушить вже напружений зв'язок між атомом кисню і атомом вуглецю кільця 4.
Тепер втративши електрон, атом вуглецю набуває позитивний заряд. Іонізований вуглець, як правило, дуже нестабільний, але тяжіння негативно зарядженого карбоксильного іона Asp-52 може стабілізувати його досить довго, щоб іон -OH (від спонтанно дисоційованої молекули води) об'єднався з вуглецем. Навіть при рН 7 вода мимовільно дисоціює з утворенням Н + і ОН - іонів. Іон водню (H +), що залишився, може замінити втрачений Glu-35. У будь-якому випадку ланцюг розривається, два фрагменти відокремлюються від ферменту, і фермент може вільно прикріпитися до нового місця на клітинній стінці бактерії і продовжувати свою роботу по її перетравленню.
Фактори, що впливають на дію ферменту
На активність ферментів сильно впливають зміни рН і температури. Кожен фермент найкраще працює при певному рН (лівому графіку) і температурі (правий графік), його активність зменшується при значеннях вище і нижче цієї точки. Це не дивно, враховуючи важливість третинної структури (тобто форми) у функції ферментів та нековалентних сил, наприклад, іонних взаємодій та водневих зв'язків, при визначенні цієї форми. Приклади:
- протеаза пепсин найкраще працює як рН 1—2 (міститься в шлунку)
- протеаза трипсин неактивна при такому низькому рН, але дуже активна при рН 8 (міститься в тонкому кишечнику, оскільки бікарбонат підшлункової рідини нейтралізує надходить вміст шлунка).
Зміни рН змінюють стан іонізації заряджених амінокислот (наприклад, Asp, Lys), які можуть відігравати вирішальну роль у зв'язуванні субстрату та/або самій каталітичній дії. Без уніонізованої групи -COOH Glu-35 та іонізованого -COO - Asp-52 каталітична дія лізоциму припинилася б. Водневі зв'язки легко порушуються при підвищенні температури. Це, в свою чергу, може порушити форму ферменту, так що його спорідненість до його субстрату зменшується.
Регуляція активності ферментів
Кілька механізмів працюють, щоб зробити активність ферментів всередині клітини ефективною та злагодженою.
Анкерні ферменти в мембранах
Багато ферментів вставляються в клітинні мембрани, наприклад,
- плазматична мембрана
- мембрани мітохондрій і хлоропластів
- ендоплазматичний ретикулум
- ядерна оболонка
Вони заблоковані в просторові відносини, які дозволяють їм ефективно взаємодіяти.
неактивні попередники
Ферменти, такі як протеази, які можуть атакувати саму клітину, гальмуються, перебуваючи всередині клітини, яка їх синтезує. Наприклад, пепсин синтезується всередині головних клітин (в шлункових залозах) як неактивний попередник пепсиноген. Тільки при впливі низького pH поза клітиною інгібуюча частина молекули видаляється і виробляється активний пепсин.
Інгібування зворотного зв'язку

Якщо продукт ряду ферментативних реакцій, наприклад, амінокислота, починає накопичуватися всередині клітини, вона може спеціально пригнічувати дію першого ферменту, що бере участь в її синтезі (червоний бар). Таким чином подальше виробництво ферменту припиняється.
Активація попередника
Накопичення речовини всередині клітини може спеціально активувати (синя стрілка) фермент, який приводить в рух послідовність реакцій, для яких ця речовина є вихідним субстратом. Це знижує концентрацію вихідного субстрату.
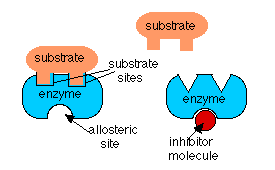
У разі інгібування зворотного зв'язку та активації попередника активність ферменту регулюється молекулою, яка не є його субстратом. У цих випадках молекула регулятора зв'язується з ферментом на іншому місці, ніж той, з яким зв'язується субстрат. Коли регулятор зв'язується зі своїм місцем, він змінює форму ферменту так, що його активність змінюється. Це називається аллостеричним ефектом. При інгібуванні зворотного зв'язку аллостеричний ефект знижує спорідненість ферменту до свого субстрату, а при активації попередника молекула регулятора збільшує спорідненість ферменту в ряді до свого субстрату.
Регуляція синтезу ферментів
Чотири описані вище механізми регулюють активність ферментів, вже присутніх всередині клітини. А як щодо ферментів, які не потрібні або потрібні, але не присутні? Тут теж працюють механізми управління, які регулюють швидкість синтезу нових ферментів. Більшість з цих елементів управління працюють шляхом включення або виключення - транскрипції генів.
Якщо, наприклад, достатня кількість амінокислоти вже доступні клітині з її позаклітинної рідини, синтез ферментів, які дозволили б клітині виробляти цю амінокислоту для себе, припиняється. І навпаки, якщо новий субстрат стає доступним для клітини, це може викликати синтез ферментів, необхідних для боротьби з ним. Дріжджові клітини, наприклад, зазвичай не метаболізують лактозу, і в них не може бути виявлено жодної лактази. Однак, якщо вирощувати в середовищі, що містить лактозу, вони незабаром починають синтезувати лактазу - шляхом транскрибування та перекладу необхідного гена (ів) - і тому можуть почати метаболізувати цукор. E. coli також має механізм, який регулює синтез ферментів, контролюючи трансляцію необхідної РНК месенджера.
