4.7: Химотрипсин
- Page ID
- 4285
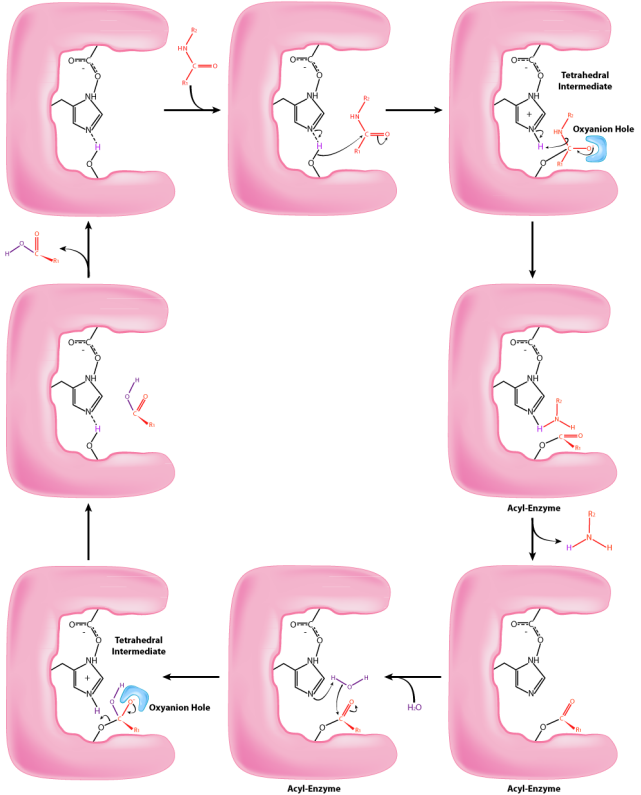
Процес починається з прив'язки підкладки в кишені S1. Кишеня S1 в хімотрипсині має гідрофобний отвір, в якому пов'язаний субстрат. Переважні субстрати будуть включати бічні ланцюги амінокислот, які є гідрофобними, як фенілаланін. Якщо іонізована бічна ланцюг, подібна до глутамінової кислоти, зв'язується в кишені S1, він швидко вийде, так само, як вода уникнула б маслянистого інтер'єру. Коли належний субстрат зв'язується, він залишається, і його присутність викликає все так незначний зрушення форми ферменту. Ця тонка зміна форми при зв'язуванні належного субстрату запускає етапи каталізу і є причиною того, що фермент проявляє специфічність для різання при певних позиціях ферменту в цільовому білку. Тільки амінокислоти з бічними ланцюгами, які добре взаємодіють з кишенею S1, починають поворот каталітичних коліс.
Незначні зміни форми ферменту при зв'язуванні належного субстрату викликають зміни в позиціонуванні трьох амінокислот (аспарагінової кислоти, гістидину та серину) в активному місці, відомому як каталітична тріада, під час другого етапу каталітичної дії. Зсув негативно зарядженої аспарагінової кислоти до багатого електронами гістидинового кільця сприяє абстрагуванню протона гістидином з гідроксильної групи на бічному ланцюзі серину, що призводить до вироблення дуже реактивного іона алкоксиду в активній ділянці. Оскільки активний сайт в цій точці також містить поліпептидний ланцюг, позиціонується з боковим ланцюгом фенілаланіну, вбудованим в кишеню S1, іон алкоксиду здійснює нуклеофільну атаку на пептидний зв'язок на карбоксильній стороні фенілаланіну, що сидить в активній ділянці. Ця реакція, яка є третім кроком каталізу, розриває зв'язок і спричиняє дві речі. Спочатку звільняється один кінець вихідного поліпептиду і виходить з активної ділянки. Друга полягає в тому, що кінець, що містить фенілаланін, ковалентно пов'язаний з киснем серінового бічного ланцюга. На цьому етапі ми завершили першу (швидку) фазу каталізу.
Друга фаза каталізу хімотрипсином протікає повільніше. Це вимагає, щоб ковалентний зв'язок між фенілаланіном і киснем серину був порушений, щоб пептид міг бути вивільнений і фермент може повернутися до початкового стану. Процес починається з надходження води в активну ділянку. На воду нападають подібно до серин-бічного ланцюга в першій фазі, створюючи реактивну гідроксильну групу, яка здійснює нуклеофільну атаку на фенілаланін-серіновий зв'язок, випускаючи її та замінюючи протон на серин. Другий пептид вивільняється в процесі, і реакція завершується з ферментом назад в початковому стані.
