5.5: Гелевий електрофорез білків
- Page ID
- 7517
Гелевий електрофорез використовується для характеристики одного з найголовніших властивостей - молекулярної маси - як полінуклеотидів, так і поліпептидів. Тут мова піде виключно на гелевому електрофорезі білків.
Гелевий електрофорез може використовуватися для визначення:
- чистота зразка білка
- неоднорідність і ступінь деградації зразка білка
- субодиничний склад зразка білка
Як це працює?
Основоположним принципом електрофорезу є міграційна властивість заряджених видів всередині електричного поля. Таким чином, саме проста поведінка протилежних звинувачень залучає. Електричне поле встановлюється поперек електродів джерела живлення, і заряджені іони рухаються в цьому електричному полі. Відзначимо, що в такому апараті слово «АНОД» відноситься до позитивно зарядженому електроду (АНОД притягує АНІОНИ), а слово «КАТОД» відноситься до негативно зарядженому електроду (КАТОД притягує КАТІОНИ). Катод і анодний терміни узгоджуються з їх визначеннями окислювально-відновної реакції в тому, що відновлення згодом відбувається на катоді, а окислення відбувається на аноді:
.png)
Малюнок 5.5.1: Анод і катод
Попередження: читайте наступну примітку, лише якщо вам цікаво акумулятори та маркування електродів, інакше не турбуйтеся (це може бути лише заплутаним).
Примітка
Окислювально-відновна хімія всередині зовнішнього джерела живлення керує окислювально-відновною реакцією на електродах. Зверніть увагу, що електрони від анода йдуть на клему «+» акумулятора. Зменшення при цьому електрода акумулятора повинно відбуватися і є приводом до окислення на аноді зовнішніх електродів. Якщо ця клема акумулятора зменшується, то вона повинна бути катодом в окислювально-відновної реакції всередині батареї. Таким чином, акумулятори мають свій катод, позначений як «+», а анод позначений як «-». У мене знадобилися години, щоб розібратися в цьому.
Білки складаються з 20 загальних амінокислот, які включають як негативно заряджені (тобто кислі) бічні ланцюги (наприклад, аспарагінова кислота, глутамінова кислота), так і позитивно заряджені (тобто основні) бічні ланцюги (наприклад, гістидин, лізин і аргінін). Таким чином, білки можуть заряджатися, і будуть мігрувати в електричному полі.
На цьому етапі слід врахувати кілька речей:
1) Будь-яке таке поділ є нерівноважним процесом. Під цим ми маємо на увазі, що якщо ми дозволимо процесу продовжити до тих пір, поки не буде виконана умова рівноваги, всі аніони будуть на одному електроді, а всі катіони будуть на іншому. Краще було б зупинити процес поділу в якийсь проміжний момент часу, щоб дозволити досягти поділу:
.png)
Малюнок 5.5.2: Процес поділу
2) Інша проблема полягає в тому, що як тільки електричне поле буде вимкнено, дифузія призведе до переміщення відокремлених іонів (тобто ми втратимо поділ, який ми намагалися досягти). Для вирішення цієї задачі поділ виконується не в розв'язку, а всередині матриці (тобто молекулярної сітки або мережі). Матриця забезпечує фрикційну складову, яка чинить опір дифузії. Крім того, тертя матриці є важливим фактором швидкості міграції іонів.
3) Відзначимо також, що поділ досягається початковим нанесенням зразка в межах вузької зони (смуги). Якщо зразок спочатку диспергований, хоча іони будуть рухатися, вони не будуть акуратно відокремлені.
Фактори, що впливають на швидкість міграції електрофорезу (R f)
На швидкість міграції впливають три фактори:
· Напруженість електричного поля, Е (прямо пропорційна швидкості міграції)
· Заряд на іонних видах, q (прямо пропорційний швидкості міграції)
· Коефіцієнт тертя опорної матриці, f (обернено пропорційний швидкості міграції)
R ф α кЕ/ф
Ці фактори можна варіювати наступним чином:
· Напруженість поля є функцією напруги джерела живлення. Таким чином, ми можемо змінювати напругу безпосередньо. У відповідному питанні напруга пропорційна опору на електродах. Тут також грає струм, але коротше кажучи, важко досягти високої напруги на електродах, якщо опір низький. Опір розчину обернено пропорційно іонній силі (тобто концентрації іонів). Таким чином, при високих концентраціях солі опір низький, важко досягти високої напруги, а швидкість міграції знизиться.
· Заряд на іонній молекулі є функцією pI молекули і рН розчину
Якщо pI> pH молекула є катіонною
(мігрує в бік катода)
Якщо pI < pH, молекула аніонна
(мігрує в бік анода)
Якщо pI = pH, молекула нейтральна
(немає міграції в електричному полі)
Тому ми можемо змінити швидкість міграції (і, можливо, напрямок міграції) шляхом зміни рН розчину
· Коефіцієнт тертя матриці потенційно може бути змінений. Матриця зазвичай являє собою полімерну мережу (див. Нижче), іменовану гелем, а коефіцієнт тертя можна збільшити за рахунок збільшення концентрації полімеру
Гелева матриця для гелевого електрофорезу білків
Гелевий електрофорез білків практично виключно використовує поліакриламід. Це полімер, що складається з двох ковалентно пов'язаних компонентів:
- акриламіду
- біс акриламід.
Біс акриламід по суті є зшивальним компонентом акриламідного полімеру. Типове значення для акриламіда:bisratio становить 19:1 і загальна концентрація акриламіду в гелі впливає на міграцію білків через матрицю (тобто визначає коефіцієнт тертя).
- Високомолекулярні білки відокремлюють за допомогою низького коефіцієнта тертя (тобто низьких концентрацій) поліакриламіду.
- Низькомолекулярні білки відокремлюють за допомогою високого коефіцієнта тертя (тобто високих концентрацій) поліакриламіду.
- Хоча зараз у нас є все на місці для проведення експерименту з електрофорезу гелю для поділу білків, є ще одне міркування, яке часто є небажаним (хоча іноді корисним). Така ситуація полягає в тому, що різні білки мають різні заряди при заданому значенні рН. Таким чином, білки будуть мігрувати як в залежності від їх маси (великі рухаються повільно), так і їх загального чистого заряду.
- Якби існував якийсь спосіб змусити кожен білок мати однакове співвідношення заряду до маси, ми могли б відокремити суміш білків, засновану лише на масових ефектах.
Роль миючого засобу додецилсульфату натрію в електрофорезі поліакриламідного гелю
Додецилсульфат натрію (SDS; також відомий як «лавровий сульфат») - це іонний миючий засіб з наступною структурою:
Малюнок 5.5.3: Структура сульфату лаврового натрію
- SDS зв'язується, за допомогою гідрофобних взаємодій, з білками в стехіометрії, приблизно пропорційно розміру білка (тобто невеликий білок зв'яже кілька молекул, а великий білок зв'яже багато молекул SDS)
- Завдяки зарядженій природі молекули SDS, білки, таким чином, матимуть приблизне постійне відношення заряду до маси за рахунок заряду, передбаченого SDS, і будуть мігрувати через гель зі швидкістю, пропорційною їх молекулярній масі.
- Білки мігрують до анода, оскільки заряд на SDS є негативним за всіх умов рН, крім висококислотних.
Білкові гелі зазвичай виконуються в денатуруючих умовах, тобто підготовка зразків передбачає нагрівання білка в присутності SDS для повного розгортання білка і дозволу зв'язування SDS по всій довжині поліпептиду. Після того, як SDS був пов'язаний, характерні значення pI білків вже не актуальні; білок бере на себе негативний заряд, і кожен білок має по суті однакове співвідношення заряду до маси.
Швидкість міграції, білкова маса та% акриламіду в гелі
Чим більший відсоток акриламіду в гелевій підтримці, тим більший коефіцієнт тертя і тим повільніше швидкість міграції. Якщо білки, що підлягають відділенню, мають високу молекулярну масу, а якщо% гелю високий, білки можуть навіть не потрапити в гель (через переважне тертя). Таким чином, важливо співставити% гелю з масою білків, що відокремлюються. У наступній таблиці наведено загальні рекомендації:
|
акриламід |
Діапазон поділу поліпептидів (довжина в амінокислотах) |
|
8% |
25-200 кДа |
|
10% |
15-100 кДа |
|
12,5% |
10-70 кДа |
|
15% |
6-60 кДа |
|
20% |
4-40 кДа |
При налаштуванні SDS PAGE (натрію додецилсульфат поліакриламід гель електрофорез) ми повинні знати, коли припинити експеримент (оскільки це не рівноважний процес). Це дещо важко визначити, оскільки білки (навіть із зв'язаними SDS) не поглинаються у видимому спектрі (тобто ми не можемо просто подивитися на гель, щоб визначити, коли білки були відокремлені). Тому прийнято включати в зразок білка невелику молекулу аніонного барвника (наприклад, бромфенол синій):
- Розмір молекули барвника вибирається дуже маленьким, так що коефіцієнт тертя з гелем по суті відсутній.
- Барвник вибирається аніонним, так що він буде мігрувати в тому ж напрямку, що і комплекси білків/SDS (тобто до анода)
- Оскільки барвник аніонний, і невеликий, він буде мігрувати найшвидше з будь-якого компонента в суміші, що розділяється
- Молекула барвника також вибирається таким чином, щоб поглинати видимий спектр (і, отже, бути візуально помітним під час роботи гелю)
- Суміш білка/SDS/барвника завантажується на верхню частину гелю (тобто катодна сторона), і коли молекула барвника («фронт барвника») досягає дна гелю, живлення вимикається і експеримент припиняється
Візуалізація відокремлених білків
Хоча гелева опора забезпечує деяке тертя молекулярних рухів, як тільки харчування буде вимкнено, відокремлені білкові смуги почнуть дифузно (вони вільно розчиняються у водному розчині). Щоб цього не допустити, гель обробляють оцтовою кислотою і розчином метанолу, через що майже всі білки випадають в осад (стають нерозчинними). Це називається «фіксацією» гелю. Тепер відокремлені білки не будуть розсіюватися.
Однак фіксовані білки все ще невидимі і їх потрібно візуалізувати фарбуванням. Поширеним білковим плямою є Coomassie Brilliant Blue R-250 (пов'язаний з барвником, використовуваним раніше в аналізі Бредфорда). Фіксований гель інкубують в розчині «Кумассіестін» і потім пляма вимивають з гелю шляхом інкубації в слабкому розчині оцтової кислоти і метанолу. Пляма не буде зв'язуватися з акриламідом, а вимиється (залишивши прозорий гель). Однак він залишається сильно пов'язаним з білками в гелі, і вони набувають глибокого синього кольору.
Визначення молекулярної маси
При лікуванні SDS білки будуть мігрувати як функція їх молекулярної маси. Таким чином, приблизна молекулярна маса відокремлених білків є функцією їх міграційної відстані. Якщо на ідентичному гелі проаналізувати ряд білків з різними і відомими молекулярними масами, в однакових умовах, то може бути встановлена стандартна крива, яка може бути використана для визначення молекулярної маси невідомого білка. Типовий «стандарт молекулярної маси» включає в себе наступну суміш білків:
|
Протеїн |
Молекулярна маса (кДа) |
|
Фосфорилаза B |
94 |
|
Бичачий сироватковий альбумін |
67 |
|
овальбумін |
43 |
|
Вуглекислий ангідрази |
30 |
|
Соєвий інгібітор трипсину |
20.1 |
|
а - Лактальбумін |
14.4 |
Молекулярна маса кількісно визначається наступним чином:
- Виміряйте (в см) відстань міграції фронту барвника
- Виміряйте (в см) відстань міграції білка (завжди буде менше фронту барвника)
- Розділіть відстань міграції білка на відстань фронту барвника, щоб отримати значення відносної рухливості (завжди < 1)
- Побудувати значення відносної рухливості (вздовж осі x) проти журналу молекулярної маси (вздовж осі y)
- Зв'язок між відносною рухливістю і журналом молекулярної маси повинна бути лінійною функцією - таким чином, забезпечуючи стандартну криву, на основі якої молекулярну масу невідомого білка можна визначити по його відносній рухливості
Ось приклад стандарту молекулярної маси та двох невідомих зразків, проаналізованих на 10% SDS PAGE, забарвленому Coomassie:
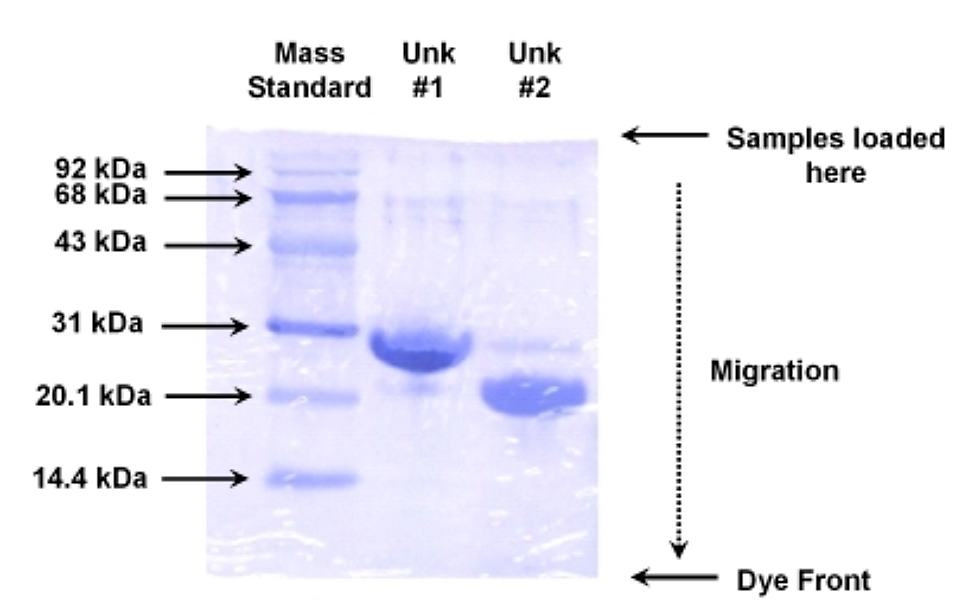.png)
Малюнок 5.5.4: Приклад гелевого електрофорезу
Розрахунок міграційних відстаней, відносної рухливості та відношення до Log молекулярної маси дає наступне:
.png)
Малюнок 5.5.5: Відносна рухливість і молекулярна маса
- Невідомий #1 має значення 1.43 для журналу молекулярної маси, або масу ~26,9 кДа
- Невідомий #2 має значення 1.33 для журналу молекулярної маси, або масу ~21,4 кДа
- Візуальна перевірка невідомих порівняно зі стандартами у вищезгаданому гелі вказує на те, що розрахунки здаються правильними.
Є й інші варіанти SDS PAGE, включаючи:
- Переривчасті гелі (тобто композит одного гелю поверх іншого) для досягнення «фокусування» білкових смуг (тобто більш гострих смуг, що дає більшу чутливість і роздільну здатність)
- Градієнтні гелі (замість того, щоб заливати одно% поліакриламідного гелю, налити градієнт з високою концентрацією внизу, а меншою концентрацією - до верху. Це дозволяє роздільну здатність більш широкого діапазону зразків молекулярної маси)
- Фарбування сріблом (більш чутливий тип плями в порівнянні з Coomassie - дозволяє виявити більш низькі концентрації білків)
- Перенесення розчинених білкових смуг на вторинну опору (наприклад, нітроцелюлозу) для зондування іншими реагентами (тобто антитілами)
- PAGE (без SDS) нативних білків (щоб дозволити виявлення нековалентних комплексів двох і більше білків - оскільки SDS порушить такі комплекси)
- SDS PAGE з додаванням відновників (наприклад, b-меркаптоетанол, дітіотреітол тощо). Ці реагенти зменшать дисульфідні зв'язки і окремі поліпептидні ланцюги, які з'єднані такими зв'язками.
Однак вищевказана інформація охоплює основи.
