5.4: Хроматографія
- Page ID
- 7491
«Хрома» відноситься до кольору, а «графіка» відноситься до письма.
Хроматографія передбачає фізичне поділ суміші сполук, де історично ідентифікація окремих сполук відбувається за їх унікальним кольором. Хроматографія може бути використана як метод очищення (препаративна шкала), а також для ідентифікації сполук на основі їх хроматографічної поведінки (аналітична шкала).
Існує багато типів хроматографії, але всі вони передбачають розчинення сполук, які потрібно розділити в рідкому розчині («рухлива» фаза), а потім проходження цього розчину через (або через) деяку тверду опору (або «матрицю»), відому як «стаціонарна» фаза. Стаціонарна фаза, як правило, являє собою суспензію твердих кульок кремнезему або полісахаридних сполук, або тверду поверхню цих сполук. Коли рухлива фаза проходить через тверду фазу або через неї, розчинені розчинені речовини взаємодіють в різному ступені зі стаціонарною фазою (тобто нековалентними силами привабливості). Чим сильніше тяжіння, тим більше молекули затримуються в порівнянні з рухомою фазою. Якщо немає тяжіння до твердої опори, то розчинені молекули рухаються разом з рухомою фазою. Різні швидкості руху для різних розчинених речовин призводить до їх відділення один від одного.
Приклад, який ви можете зробити в домашніх умовах, передбачає кавовий фільтр (стаціонарна фаза) і воду (рухлива фаза) в поділі та аналізі барвника у водорозчинному маркері (суміші з'єднань). Якщо ви намалюєте лінію фіолетовим маркером на смужці фільтрувального паперу, а дно помістити в посуд з водою, вода буде гнітом паперу, а диференціальна спорідненість фарб барвника для твердої опори (целюлози) призводить до диференціальної міграції. У наведеному нижче прикладі червоні чорнило мають деяку спорідненість до паперу, але синя чорнило не робить (і мігрує з переднім краєм рухомої фази).
.png)
Малюнок 5.4.1: Хроматографія фіолетового пера
Хроматографія в біохімії зазвичай використовує не папір, а кульки полісахариду (часто хімічно похідні), упаковані в колону, як тверду опору. Тверду опору часто називають хроматографією «смолою». Деякі поширені типи хроматографічних смол включають:
- іонний обмін
- спорідненість
- Гідрофобні
- Гелева фільтрація
Часто розчинені речовини, що підлягають розділенню, - це білки, і тому обговорення буде зосереджено на білкової хроматографії (але принципи однакові для будь-якого розчиненого речовини)
іонний обмін
Іонообмінні смоли містять заряджені групи.
- Вони можуть мати кислотну природу (в цьому випадку смола є катіонообмінником)
- або базовий (в такому випадку це аніонний обмінник).
- Катіонообмінники і аніонообмінники можуть бути розбиті далі на слабкі і сильні обмінники (відображають спорідненість зв'язування).
|
Тип теплообмінника |
Функціональна група |
Загальна назва |
|
Слабкий катіоніт |
карбоксиметил (-) |
ЦМ целюлоза/сефадекс |
|
Сильний катіонний обмінник |
сульфопропіл (-) |
SP сефадекс |
|
Слабкий аніонообмінник |
діетиламіноетил (+) |
DE целюлоза/сефадекс |
|
Міцний аніонообмінник |
четвертинний амін (+) |
Сефадекс QAE |
Зазвичай зразки завантажуються в умовах низької іонної міцності (що сприяє електростатичним взаємодіям), а зв'язаний матеріал елююється за допомогою ступеневого або градієнтного елюювання буфера з більш високою іонною силою.
- Взагалі кажучи, білок зв'яжеться з катіонообмінною смолою, якщо буферний рН нижчий, ніж ізоелектрична точка (pI) білка, і зв'яжеться з аніонообмінною смолою, якщо рН вище, ніж pI.
- Знання pI білка, отже, корисно при розробці протоколу очищення з використанням іонообмінних смол (однак, ви завжди можете просто спробувати різні смоли, щоб побачити, яка працює найкраще).
Елюція білків з іонообмінних смол
Білки, пов'язані з іонообмінними смолами, зв'язуються за допомогою нековалентних іонних (соляно-місткових) взаємодій. Ми можемо конкурувати за ці іонні місця зв'язування на смолі з іншими іонними групами, а саме солями
- Існує два загальних типи методів при елююванні сольовим розчином: 1. Градієнтне елюювання і 2. Елюція кроку
- Градієнтне елюювання відноситься до плавного переходу концентрації солі (від низької до високої) в буфері елюції. Слабко зв'язуючі білки елітуть першими, а сильніші зв'язуючі білки елутують останніми (тобто вони вимагають більш високих концентрацій солі в буфері, щоб конкурувати з ними з колони)
- Градієнтну концентрацію солі можна зробити за допомогою градієнтного виробника. У найпростішому вигляді це складається з двох ємностей (повинні бути однакової форми), з'єднаних сифоном (або трубкою внизу). Один контейнер містить буфер з низьким вмістом солі, а інший містить буфер з високим вмістом солі. Буфер вилучається з ємності з низьким вмістом солі:
.png)
Малюнок 5.4.2: Виробник градієнтів
- Це дасть лінійний градієнт від низької до високої концентрації солі над загальним об'ємом градієнта
- Якщо ми знаємо діапазон концентрацій солі, над яким буде виділятися цікавий білок, ми можемо просто елітувати буфером, що містить цю концентрацію солі. Це відоме як крок елюції.
- Ступінчасті елюції, як правило, швидше запускаються, і елітують білок в меншому загальному обсязі, ніж при градієнтних елюціях. Вони, як правило, найкраще працюють, коли забруднюючі речовини виділяють при значно іншій концентрації солі, ніж цікавить білок.
Зверніть увагу, що після іонообмінної хроматографії цікавий білок буде знаходитися в буфері з потенційно високою концентрацією солі. Це необхідно враховувати, перш ніж приступити до наступного етапу в схемі очищення.
Афінна хроматографія
Аффінна хроматографія - це загальний термін, який застосовується до широкого спектру хроматографічних носіїв. Це можна в основному розглядати як якусь інертну смолу, до якої була приєднана якась сполука, яка має специфічну спорідненість до вашого білка, що представляє інтерес.
- Таким чином, специфічне антитіло, прикріплене до інертної смоли, було б типом афінної хроматографії.
- Інші приклади можуть включати: інгібітор протеази, прикріплений до деякої матриці, призначений для зв'язування певної протеази
- кофактор, пов'язаний з деякою матрицею, призначений для зв'язування з певним ферментом
- іон металу, пов'язаний з матрицею, призначений для хелатування білка з місцем зв'язування металу, і так далі.
У кожному конкретному випадку тип використовуваних смол і спосіб кріплення можуть відрізнятися, як і метод елюації. Одне узагальнення щодо методу елюції полягає в тому, що зв'язаний ліганд може бути зрівнятий з функціональної групи колони, включивши в буфер елюції високу концентрацію вільної функціональної групи. Наприклад, якщо функціональна група колонки є кофактором, то зв'язаний білок можна змагатися з колони, пропустивши через колонку буфер, що містить високу концентрацію кофактора (або кофакторного аналога).
Інші методи елюції включають зміну буферних умов таким чином, що білок більше не перебуває в нативному стані (оскільки саме нативний стан надає структуру, необхідну для специфічної зв'язуючої взаємодії). Цього можна досягти, змінивши рН або додаючи денатуруючі агенти, такі як сечовина або гуанідин.
За допомогою афінної хроматографії, як правило, очищення, досягнуте за один крок, може бути драматичним - близько декількох тисяч разів. Одноступінчасті очищення зі специфічними стовпцями спорідненості не є нечуваними - насправді це ідеальна мета очищення - матриця, яка розпізнає тільки цікавить білок і ніхто інший.
Гідрофобні смоли
Гідрофобні смоли містять неполярну функціональну групу, таку як алкан або ароматична група.
- Багато білків здатні секвеструвати такі групи на своїй поверхні і це виключення з розчинника забезпечує основу енергії зв'язування (тобто «гідрофобний ефект»).
- Ця взаємодія посилюється за рахунок збільшення іонної сили, так що білки можуть зв'язуватися в умовах високої солі і виділятися в умовах низької солі.
- Як такі колонки можуть використовуватися не тільки для забезпечення очищення, але і для знесолення зразків (наприклад, після початкового осадження сульфату амонію).
- Зазвичай заздалегідь передбачити, яка саме смола зв'яже даний білок, як правило, не представляється можливим, це зазвичай визначається емпіричним шляхом. Однак чим довше алкан, або чим більше ароматична сполука, тим сильніше зв'язування, як правило, буде.
Завдяки природі гідрофобних взаємодій та іонної міцності гідрофобна хроматографія та іонообмінна хроматографія можуть бути зручно використані послідовно. Наприклад, після іонного обміну білок знаходиться в умовах високої солі, тому його можна завантажувати безпосередньо на гідрофобну колону. І навпаки, гідрофобна колона елююється в низькій солі, що є вимогою для зв'язування з іонообмінною смолою.
Слід зазначити різницю між гідрофобною взаємодією, хроматографією та зворотною фазовою хроматографією.
- Хроматографія гідрофобної взаємодії проводиться в умовах водного розчинника і зміни іонної міцності використовуються для елітування колони. Білок зазвичай зв'язується в нативному стані за допомогою гідрофобних груп, розташованих на поверхні білка. Рідний стан зберігається в умовах елюції.
- Хроматографія зворотної фази використовує гідрофобний розчинник (зазвичай ацетонітрил), а зв'язування ліганду є функцією фазового розподілу між гідрофобною природою розчинника та функціональною групою колони. Білки зазвичай денатуруються в таких розчинниках і зв'язуються завдяки гідрофобному характеру всієї поліпептидної послідовності. Оскільки більшість гідрофобних груп розташовані в ядрі кулястих білків, зв'язування пов'язане з денатурацією білка і доступністю цих груп до функціональних груп колони. Білки можна очистити за допомогою зворотної фазової хроматографії, але, як правило, їх потрібно певним чином перекласти, щоб відновити функціональність (тобто нативний стан)
Гелева фільтрація
Гелева фільтрація не спирається на будь-яку хімічну взаємодію з білком, скоріше вона заснована на фізичній властивості білка - це ефективний молекулярний радіус (який відноситься до маси для більшості типових кульових білків).
- Гелеву фільтраційну смолу можна розглядати як кульки, які містять пори певного діапазону розмірів.
- Великі білки, які не можуть потрапити в ці пори, проходять навколо зовнішньої сторони намистин. Тому обсяг колони здається меншим до великої молекули.
- Менші білки, які можуть потрапити в пори кульок, мають більший обсяг, який вони можуть досліджувати, таким чином обсяг колони здається більшим до невеликої молекули.
- Як великі, так і малі молекули відчувають однакову швидкість потоку рухомої фази (тобто л/хв) .Таким чином, зразок білків, що проходять через колону фільтрації гелю, буде відокремлюватися залежно від молекулярного розміру: великі вилутять першими, а найменші будуть елютувати останній (і «середній» «Білки розміром будуть елітувати посередині).
.png)
Малюнок 5.4.3: Гелева фільтрація
- Якщо ваш білок незвично «маленький» або «великий» в порівнянні з забруднюючими білками, то гелева фільтрація може працювати досить добре.
Де буде виділятися білок в експерименті з фільтрації гелю?
- У профілі розділення гелевої фільтраційної колони є дві крайності.
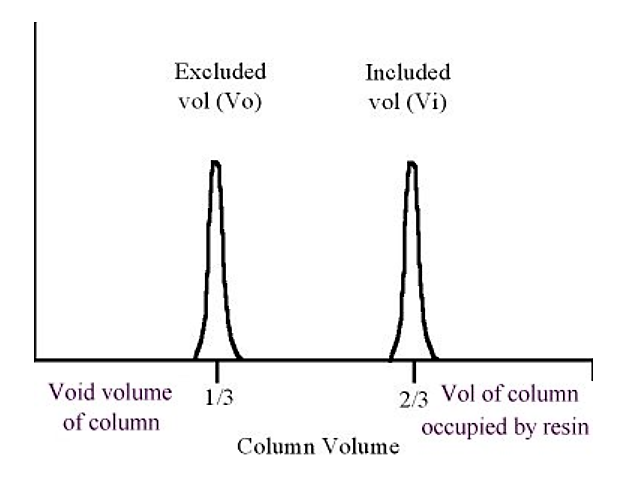
- Існує критична молекулярна маса (велика маса), яка буде повністю виключена з фільтруючих гранул гелю. Всі розчинені речовини в зразку, які рівні або більше цього критичного розміру, будуть вести себе однаково: всі вони будуть елююватися в виключеному обсязі колони
- Існує критична молекулярна маса (мала маса), яка буде повністю включена в пори фільтруючих кульок гелю. Всі розчинені речовини в зразку, які дорівнюють або менші, ніж цей критичний розмір, будуть вести себе однаково y: всі вони будуть елююватися у включеному обсязі колони
- Розчинені речовини між цими двома діапазонами молекулярної маси будуть виділятися між виключеними та включеними обсягами
.png)
Малюнок 5.4.4: Елюція білка в гелевій фільтрації
Як правило, виключений обсяг (Vo) приблизно дорівнює одній третині обсягу колони, включений обсяг приблизно дорівнює двом третинам обсягу колони («відсутню» третину займає обсяг смоляного матеріалу).
- У гелевій фільтрації роздільна здатність залежить від довжини колонки (чим довше, тим краще)
- Однак один недолік пов'язаний з максимальним обсягом зразка, який можна завантажити. Чим більше обсяг завантаженого зразка, тим більше перекриття між відокремленими вершинами. Взагалі кажучи, розмір вибірки, який можна завантажити, обмежений приблизно 3-5% від загального обсягу стовпця.
- Таким чином, гелева фільтрація найкраще зберігається для кінцевих етапів очищення, коли зразок може бути легко сконцентрований до невеликого обсягу.
- Гелева фільтрація може використовуватися і для видалення солей з зразка, завдяки своїй здатності відокремлювати «дрібні» від «великих» компонентів.
- Нарешті, гелева фільтрація може бути одним з найбільш «щадних» методів очищення через відсутність хімічної взаємодії зі смолою.
