1.4: ферменти, що модифікують ДНК
- Page ID
- 7420
метилази
Подібно до того, як дослідження бактеріальної системи рестрикції-модифікації забезпечило різноманітні специфічні ендонуклеази, також доступні різноманітні специфічні метилази ДНК.
- Послідовності розпізнавання метилаз такі ж, як і асоційовані ендонуклеази (наприклад, метилаза EcoR1 розпізнає і метилати в послідовності «GAATTC»).
- Всі метилази переносять метильну групу з S-аденозилметіоніна (SAM) до певної основи в послідовності розпізнавання, а SAM є необхідним компонентом в реакції метилювання.
- Метилювання ДНК зазвичай має ефект захисту ДНК від пов'язаної рестрикційної ендонуклеази. Однак існують метилази з мінімальною специфічністю. Наприклад, метилаза Sss I буде метилювати залишки цитозину в послідовності 5'... CG... 3'. В цьому випадку метильована ДНК буде захищена від найрізноманітніших рестрикційних ендонуклеаз.
- Деякі рестрикційні ендонуклеази розрізають ДНК лише в місцях їх розпізнавання, якщо ДНК метильована (наприклад, Dpn I).
- Ще інші ендонуклеази обмеження скоротять як метильовану, так і неметильовану ДНК при їх послідовності розпізнавання (наприклад, BamH I).
dam і dcm метилювання
- Метилаза, закодована геном греблі (метилаза дамби), переносить метильну групу з SAM в положення N 6 аденінової основи в послідовності 5'... GATC... 3'.
- Метилаза, закодована геном dcm (dcm метилаза) метилює внутрішню основу цитозину, в положенні C 5, в послідовностях 5'... CCAGG... 3' і 5'... CCTGG... 3'.
- Майже всі штами кишкової палички, які зазвичай використовуються при клонуванні, мають генотип греблі + dcm +. Справа тут не в тому, що ми особливо хочемо, щоб наша ДНК була метильованою, а в тому, щоб зробити дамм-дсм- господаря хтось повинен мутувати бактерії та ізолювати правильний мутант. Це, мабуть, не було зроблено для багатьох штамів бактерій. Ймовірно, тому, що гребля і метилювання dcm впливає лише на невелику підмножину потенційних обмежень ендонуклеаз.
ДНК, ізольована від штамів dam+dcm+, насправді не буде вирізана скромною підмножиною доступних рестрикційних ендонуклеаз:
|
|
|
|
|
|---|---|---|---|
| ТГАТЦА |
|
|
|
| GATC |
|
|
|
| АТКГАТ |
|
|
|
| ТАКТАГА |
|
|
|
| ТКГА |
|
|
|
| ГААГА |
|
|
|
| ГГТГА |
|
|
|
ДНК, можливо, доведеться готувати з штамів кишкової палички, які є dam-dcm-, щоб бути розрізані цими ферментами.
ДНК-полімерази
Широке розмаїття полімераз було охарактеризовано і є комерційно доступними. Всі ДНК-полімерази мають дві загальні характеристики:
- Вони додають нуклеотиди до 3'-OH кінця грунтовки
- Порядок нуклеотидів в зароджується полінуклеотиді шаблонно спрямований
.png)
Малюнок 1.4.1: Реплікація ДНК
На додаток до 5'->3' полімеразної активності, полімерази можуть містити екзонуклеазну активність. Ця екзонуклеазна активність може протікати або в напрямку 5'->3', або в напрямку 3'->5'.
- Екзонуклеазна активність у напрямку 3'->5' дозволяє полімеразі виправити помилку, якщо вона містить неправильний нуклеотид (так звана "активність корекції помилок «). Він також може повільно погіршити 3' кінець грунтовки.
- Екзонуклеазна активність у напрямку 5'->3' дозволить йому погіршити будь-який інший гібридизований грунт, з яким він може зіткнутися. Без активності екзонуклеази 5'->3' перешкоджаючі праймери можуть або не можуть бути фізично замінені, залежно від використовуваної полімерази.
Різні полімерази мають різну похибку дезінкорпорації та різну швидкість полімеризації.
|
|
|
|
|
|
|
|---|---|---|---|---|---|
| 5'->3' активність екзонуклеази |
|
|
|||
| 3'->5' активність екзонуклеази |
|
|
|
|
|
| Частота помилок (x10 -6) |
|
|
|
|
|
| Зсув пасма |
|
||||
| Інактивація тепла |
|
|
|
|
Використання полімераз
Різноманітна діяльність різних полімераз надає їм різноманітне застосування. Наприклад, рестрикційні ендонуклеази можуть давати фрагменти ДНК з нуклеотидними «нависами» 3' або 5'.
- У разі 5' звісів, 5'->3' активність полімерази може заповнити їх, щоб зробити тупі кінці.
- У разі 3' звісів, 3'-> 5' екзонуклеазна активність, присутня в деяких полімеразах (особливо Т4 ДНК-полімерази), може «пережовувати» ці кінці, щоб також зробити тупі фрагменти ДНК.
.png)
Малюнок 1.4.2: Полімеразна активність
«Нік-переклад»
Цей метод використовується для отримання високорадіомаркованих фрагментів однониткової ДНК, що використовує екзонуклеазну активність 5'->3', присутню в деяких полімеразах (E. coli ДНК-полімерази I, наприклад).
- У цьому методі дуплекс ДНК, що представляє інтерес, «вирізаний» (тобто одна з ниток зрізається; див. DNaSe I).
- Потім додають ДНК-пол I разом з радіомаркованими нуклеотидами. Активність екзонуклеази 5'->3' віджовує кінець 5' на місці «нік», а полімеразна активність включає радіомарковані нуклеотиди. Отриманий полінуклеотид буде сильно радіомаркований і буде гібридизуватися до послідовності ДНК, що цікавить.
.png)
Малюнок 1.4.3: Нік-переклад
- Термостабільні полімерази мають здатність залишатися функціональними в діапазонах температур, де дуплекс ДНК фактично «розплавиться» і розділяється. Це дозволило розробити методику «Полімеразна ланцюгова реакція» (ПЛР), яка зробила глибокий вплив на сучасні біотехнології. Цей спосіб ми обговоримо на більш пізньому терміні.
- Включення дідеокси-підстав (тобто відсутність гідроксильних груп ні на 2', ні 3' вуглецю рибози цукру) призводить до припинення реакції полімерази. Про це буде більш детально розказано далі. Однак припинення цього ланцюга шляхом включення дидезоксинуклеотидів є основою методу Sanger секвенування ДНК, а також методів терапії, спрямованої на пригнічення вірусної реплікації.
нуклеази
Нуклеаза БАЛ-31
- Це екзонуклеаза (починається на терміні і працює всередину), яка погіршить як 3', так і 5' терміні дволанцюгової ДНК. Це не зробить внутрішніх розщеплення («нікс»), однак, це погіршить кінці ДНК при існуючих внутрішніх «ніках» (які створюють як 3', так і 5' termini).
- Деградація терміні не узгоджується, що означає, що продукт не є 100% тупим кінцем (навіть якщо оригінальний дуплекс, можливо, був тупим закінчився).
- Такі «рвані» кінці можна зробити тупими шляхом заповнення та пережовування відповідною полімеразою (наприклад, ДНК-полімеразою Т4). Одиниця визначення 1 одиниці - це кількість ферменту, необхідного для видалення 200 пар основ з кожного кінця дуплексної ДНК за 10 хвилин при 30° C.
.png)
Малюнок 1.4.4: Діяльність нуклеази БАЛ-31
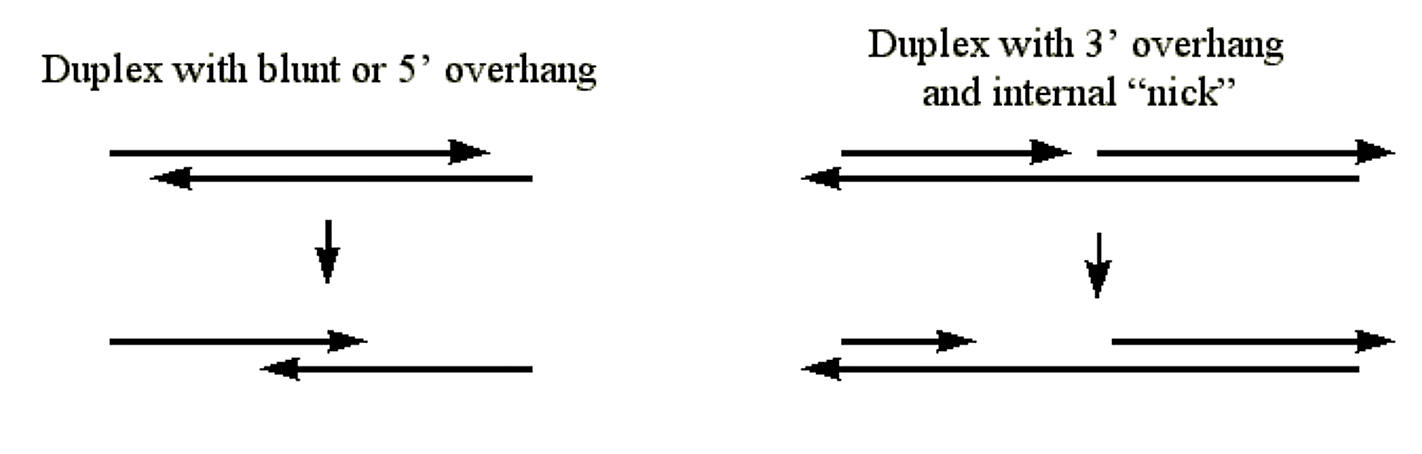
Екзонуклеаза III
- Каталізує поетапне видалення нуклеотидів з 3' гідроксильних терміні дуплексної ДНК.
- Фермент буде атакувати 3' гідроксил при дуплексної ДНК з тупими кінцями, з 5' свесами, або з внутрішніми «уколами».
- Оскільки дуплексна ДНК потрібна, фермент не перетравлює 3' кінець дуплексної ДНК, де терміни мають 3' звиси.
.png)
Малюнок 1.4.5: Активність екзонуклеази III
Mung Bean Nuclease (ізольовані від паростків квасолі мунг)
- Одна ланцюгова специфічна ДНК та РНК ендонуклеаза, яка погіршить розширення окремих ниток з кінців ДНК та РНК, залишаючи тупі кінці.
- Розширення однієї нитки можуть бути як 5 ', так і 3' розширення - обидва видаляються і тупий дуплекс залишається.
.png)
Малюнок 1.4.6: Активність нуклеази бобів мунг
Дезоксирибонуклеаза I (ДНКАза I) з бичачої панкреази
- Цей фермент гідролізує дуплексні або окремі нитки ДНК переважно в фосфодіефірних зв'язках 5' з піримідиновими нуклеотидами.
- При наявності іона Mg 2+, DNaSe I атакує кожну пасмо самостійно і виробляє уколи випадковим чином (корисно для нік-перекладу)
- При наявності Mn2+ іона dNaSe I розщеплює обидві нитки ДНК приблизно в одному положенні (але залишаючи «рвані» кінці)
Лігази
- Лігази каталізують утворення фосфодіефірного зв'язку між зіставленими 5' фосфатом і 3' гідроксильними термінами нуклеотидів (потенційно РНК або ДНК залежно від лігази).
- У певному сенсі вони протилежні рестрикційним ендонуклеазам, але, схоже, на них не впливає локальна послідовність, як така.
- Лігази вимагають або RATP, або NAD + як кофактор, і це контрастує з обмеженням ендонуклеаз.
Нижче наведені різні види лігазів і їх характеристики.
Т4 ДНК лігази
- Виділений з бактеріофага Т4.
- Буде лігувати кінці дуплексної ДНК або РНК.
- Цей фермент приєднається до тупих терміні, а також закінчується згуртованими (комплементарними) нависаючими кінцями (або 3 'або 5' комплементарними свесами).
- Цей фермент також відновлює одиночні багатониткові ніки в дуплексних дуплексах ДНК, РНК або ДНК/РНК. Потрібен АТФ як кофактор.
ДНК-лігази
- Ця лігаза буде каталізувати фосфодіефірний зв'язок між двома сусідніми олігонуклеотидами, які гібридизовані до комплементарної ланцюга ДНК:
.png)
Малюнок 1.4.7: Активність ДНК лігази Taq
- Лігування ефективно тільки в тому випадку, якщо олігонуклеотиди відмінно гібридизуються з шаблонної пасмом.
- Фермент активний при відносно високих температурах (45 - 65° C). Потрібен NAD + як кофактор.
Т4 РНК лігази
- Каталізує утворення фосфодіефірного зв'язку між олігонуклеотидами РНК/РНК, олігонуклеотидами РНК/ДНК або олігонуклеотидами ДНК/ДНК.
- Потрібен АТФ як кофактор.
- Цей фермент не вимагає шаблонної пасма.
Т4 РНК лігаза може бути використана для різних цілей, включаючи конструювання РНК/ДНК гібридних молекул.
.png)
Малюнок 1.4.8: Активність лігази РНК Т4
ДНК лігази (кишкова паличка)
- Буде каталізувати фосфодіефірний зв'язок між дуплексною ДНК, що містить когезійні кінці.
- Це не дозволить ефективно лігувати тупі закінчені фрагменти.
- Потрібен NAD + як кофактор.
.png)
Малюнок 1.4.9: ДНК-лігаза (кишкова паличка) активність
Т4 полінуклеотидкіназа
- Каталізує перенесення та обмін фосфатної групи з положення g RATP (аденінрибози трифосфатного нуклеотиду) до 5' гідроксильного кінця подвійної багатониткової та одноцепочечной ДНК або РНК та нуклеозидів 3' монофосфатів.
- Фермент також видалить 3' фосфорильні групи.
- Олігонуклеотиди, отримані з автоматизованих синтезаторів, не мають 5' фосфатної групи, і, отже, не можуть бути перев'язані до інших полінуклеотидів.
Т4 полінуклеотидкіназа може бути використана для фосфорилювання 5' кінця таких полінуклеотидів:
.png)
Малюнок 1.4.10: Активність полінуклеотидкінази T4
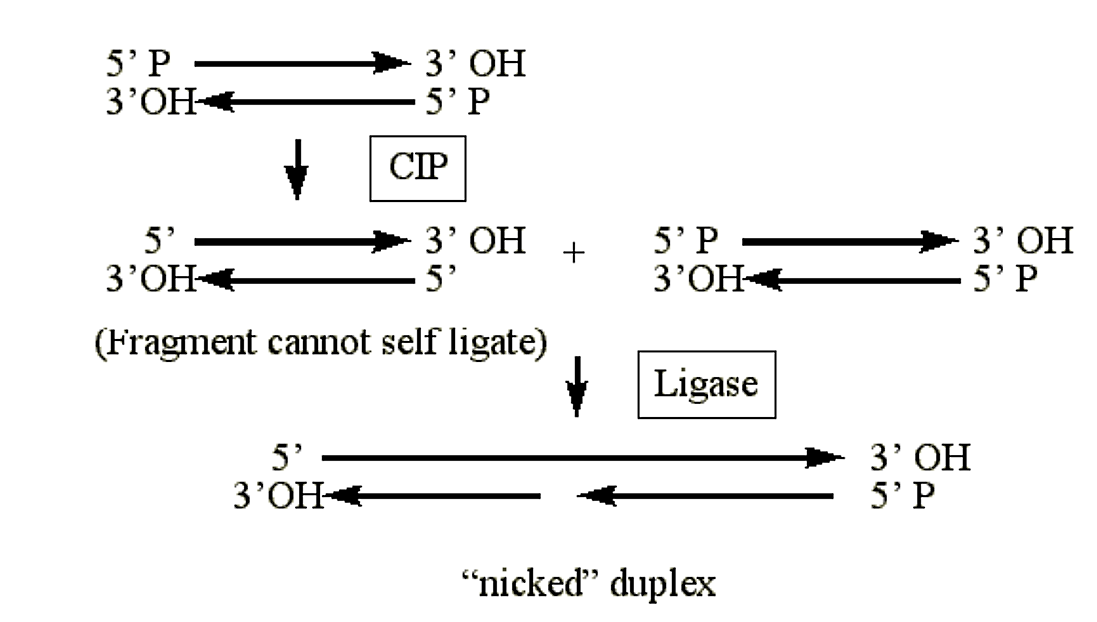
Тількова кишкова фосфатаза (CIP)
- Каталізує видалення 5' фосфатних груп з РНК, ДНК і рибо- і дезоксирибо- нуклеозидних трифосфатів (наприклад АТФ, RATP).
- Дуплексна ДНК, оброблена CIP, не може самолігуватися.
- Геміфосфорилірованние дуплекси будуть переліковані на одній пасмо (фосфорилированной пасмо) і залишаться «забиті» на іншій.
.png)
Малюнок 1.4.11: Діяльність CIP
