4: Третій закон термодинаміки
- Page ID
- 75779
Другий закон визначає ентропію за співвідношенням\(dQ = T dS\). Таким чином, ентропія визначається лише до адитивної константи. Далі він не говорить нам про поведінку\(S\) як функції\(T\) близької до абсолютного нуля. Це робиться за третім законом.
Третій закон термодинаміки
Внесок в ентропію кожним набором ступенів свободи у внутрішній термодинамічній рівновазі диференційовано прагне до нуля у міру наближення абсолютного нуля температури.
Граничне значення\(S\) не залежить від процесу, за яким\(T = 0\) наближається; неважливо, чи знаходиться система в рідкій або твердій фазі, чи знаходиться вона під тиском і т.д. далі умова диференціативності говорить,\(\bigl(\frac{∂S}{∂T}\bigr)\) що кінцева при абсолютному нулі, де похідна береться за будь-який процес.
Недосяжність абсолютного нуля
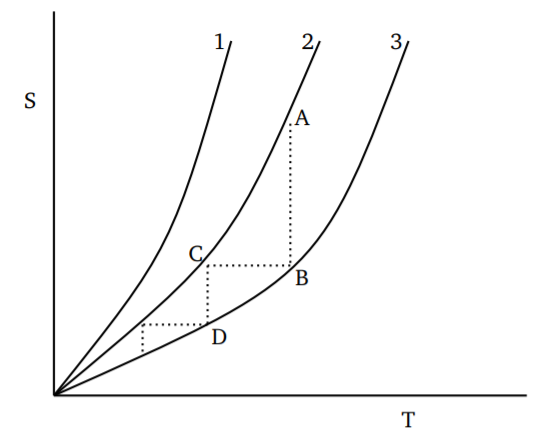
Для різних вихідних точок варіація ентропії з температурою буде такою, як показано на малюнку\(\PageIndex{1}\). Процес, що знижує температуру, можна розглядати як ізотермічне зниження ентропії від\(A\) до\(B\) з подальшим ізентропним (адіабатичним) зниженням температури вздовж\(BC\). Продовжуючи процес, можна наблизитися і ближче до абсолютного нуля. Але очевидно, що досягнуте зниження температури стане все менше і менше; після будь-якого кінцевого числа кроків все одно буде позитивна ненульова температура. Таким чином, ми робимо висновок, що для будь-якого термодинамічного процесу можливий лише асимптотичний підхід до абсолютного нуля. Оскільки будь-який термодинамічний процес охолодження може бути побудований як сума таких кроків\(ABC\), висновок тримається в загальному вигляді.
Зникнення питомих нагрівань при абсолютному нулі
Питома теплоємність для будь-якого процесу може бути записана як
\[C_R = \biggl(\frac{∂Q}{∂T}\biggr) _R = T\biggl(\frac{∂S}{∂T}\biggr)_R\]
де R вказує величину, що утримується постійною. Так як, за третім законом,\(\bigl(\frac{∂Q}{∂T}\bigr) _R\) є кінцевим як\(T → 0\), ми знаходимо\(C_R → 0\) як\(T → 0\). Зокрема, питомі нагрівання при постійному обсязі (\(C_v\)) і при постійному тиску (\(C_p\)) зникають при абсолютному нулі.
