9.4: Стійкість до хімічних зв'язків
- Page ID
- 26889
- Визначте природу енергії молекулярних орбіталів двоатомної як функції міжмолекулярної відстані
- Визначте три інтеграли, що беруть участь у обчисленні загальної молекулярної орбітальної енергії: інтеграл кулона, інтеграл обміну та інтеграл перекриття
Як було показано раніше, ми можемо побудувати дві молекулярні орбіталі для\(\ce{H_2^{+}}\) системи за допомогою наближення LCAO з базовим набором двох атомних орбіталів 1s (тобто\(1s\) орбіталів на водні\(A\) (\(1s_A\)) та водні\(B\) (\(1s_B\)):
\[| \psi _\pm\rangle = \dfrac{1}{\sqrt{2(1 \pm S )}} (1s_A \pm 1s_B) \label{9.3.7a} \]
Енергію цих двох молекулярних орбіталей можна обчислити за інтегралом очікуваного значення гамільтоніана,
\[E_{\pm} = \left \langle \psi _{\pm} | \hat {H} _{elec} | \psi _{\pm} \right \rangle \label {9.4.1} \]
які можуть бути розширені за допомогою розширеної молекулярної орбітальної хвильової функції в Рівняннях\ ref {9.3.7a} дати
\[E_{\pm} = \dfrac {1}{2(1 \pm S)} \left[ \underbrace{\left \langle 1s_A |\hat {H} _{elec} | 1s_A \right \rangle}_{H_{AA}} + \underbrace{\left \langle 1s_B |\hat {H} _{elec} | 1s_B \right \rangle }_{H_{BB}}\pm \underbrace{\left \langle 1s_A |\hat {H} _{elec} | 1s_B \right \rangle}_{H_{AB}} \pm \underbrace{\left \langle 1s_B |\hat {H} _{elec} | 1s_A \right \rangle}_{H_{BA}} \right] \label {9.4.2a} \]
де\(S\) - інтеграл перекриття між двома атомними орбіталями основи. Чотири інтеграли в Рівнянні\(\ref{9.4.2a}\) можуть бути представлені\(H_{AA}\)\(H_{BB}\),\(H_{AB}\), і\(H_{BA}\), відповідно.
\[E_{\pm} = \dfrac {1}{2(1 \pm S)} \left[ H_{AA} + H_{BB} \pm H_{AB} \pm H_{BA} \right] \label {9.4.2b} \]
Показати, що рівняння\(\ref{9.4.1}\) розширюється, щоб дати рівняння\(\ref{9.4.2a}\) в наближенні LCAO, яке використовує базовий набір лише двох атомних орбіталів 1s.
- Відповідь
-
Тут ми маємо хвильову функцію в межах наближення LCAO, яка використовує базовий набір лише двох атомних орбіталів 1s (Equation\ ref {9.3.7a}).
\[| \psi_{\pm} \rangle =\frac{1}{\sqrt{2(1 \pm S)}}\left(1_{S a} \pm 1_{S b}\right) \nonumber \]
І наше наближення LCAO еквівалентно цьому, якщо ми підключимо до хвильової функції безпосередньо.
\[E_{\pm}= \langle \psi_{\pm}|\hat{H}| \psi_{\pm} \rangle =N^{2} \langle \left(1_{S a} \pm 1_{S b}\right)|\hat{H}|\left(1_{S a}-1_{S b}\right) \rangle \nonumber \]
Ми бачимо форму вище, що константа нормалізації в квадраті призводить до:
\[N^{2}=\frac{1}{2(1 \pm S)} \nonumber \]
Тепер ми FOIL множинний (тобто, розширений термін за терміном):
\[ \langle 1_{S a}|\hat{H}| 1_{S a} \rangle + \langle1_{S b}|\hat{H}| 1_{S b} \rangle \pm \langle 1_{S a}|\hat{H}| 1_{S b} \rangle \pm \langle 1_{S b}|\hat{H}| 1_{S a} \rangle \nonumber \]
Тепер ми бачимо, що це тепер еквівалентно рівнянню\ ref {9.4.2a}, якщо рівняння вище вставлено (і додавання індексу, щоб підкреслити це стосується лише електронної хвильової функції):
\[E_{\pm} = \dfrac {1}{2(1 \pm S)} \left[ \underbrace{\left \langle 1s_A |\hat {H} _{elec} | 1s_A \right \rangle}_{H_{AA}} + \underbrace{\left \langle 1s_B |\hat {H} _{elec} | 1s_B \right \rangle }_{H_{BB}}\pm \underbrace{\left \langle 1s_A |\hat {H} _{elec} | 1s_B \right \rangle}_{H_{AB}} \pm \underbrace{\left \langle 1s_B |\hat {H} _{elec} | 1s_A \right \rangle}_{H_{BA}} \right] \nonumber \]
Зверніть увагу, що\(A\) і\(B\) з'являються еквівалентно в гамільтонівському операторі для\(\ce{H_2^{+}}\). Ця еквівалентність означає, що інтеграли за участю\(1s_A\) повинні бути такими ж, як відповідні інтеграли за участю\(1s_B\), тобто
\[ H_{AA} = H_{BB} \label {9.4.3} \]
і оскільки хвильові функції реальні
\[ | A \rangle = \langle A | \nonumber \]
тому
\[H_{AB} = H_{BA} \label {9.4.4} \]
Ці дві рівності спрощують рівняння\ ref {9.4.2b}:
\[ E_{\pm} = \dfrac {1}{1 \pm S} (H_{AA} \pm H_{AB}) \label {9.4.5} \]
Тепер вивчіть деталі\(H_{AA}\) після вставки гамільтонового оператора для\(\ce{H_2^{+}}\) (Рівняння 9.2.1):
\[H_{AA} = \underbrace{ \left \langle 1s_A \left| - \dfrac {\hbar ^2}{2m} \nabla ^2 - \dfrac {e^2}{4\pi \epsilon _0 r_A} \right| 1s_A \right \rangle }_{\color{red}{E_H}} + \dfrac {e^2}{4\pi \epsilon _0 R} \cancelto{ \color{red} {1}}{ \left \langle 1s_A | 1s_A \right \rangle} \underbrace{ - \left \langle 1s_A \left| \dfrac {e^2}{4 \pi \epsilon _0 r_B } \right| 1s_A \right \rangle}_{ \color{red} {J_{AB}}} \label {9.4.6} \]
- Перший термін - це всього лише інтеграл для енергії атома водню 1-ї орбіталі,\(E_H\).
- Другий інтеграл дорівнює 1 шляхом нормалізації; префактор - це всього лише Кулонівське відштовхування двох протонів.
- Останній інтеграл, в тому числі і знак мінус, представлений\(J\) і називається кулонівським інтегралом.
Фізично\(J_{AB}\) - це потенційна енергія взаємодії електрона, розташованого навколо протона\(A\) з протоном\(B\). Це негативно, оскільки це приваблива взаємодія. Це середня енергія взаємодії електрона, описана\(1s_A\) функцією з протоном\(B\).
Кулонівський інтеграл - потенційна енергія електростатичного відштовхування між електроном з електронною густиною в\(1S_A\) і електроном з функцією електронної густини\(1S_B\)
Тепер розглянемо\(H_{AB}\).
\[H_{AB} = \underbrace{ \left \langle 1s_A \left| - \dfrac {\hbar ^2}{2m} \nabla ^2 - \dfrac {e^2}{4\pi \epsilon _0 r_B} \right| 1s_B \right \rangle}_{\color{red}{E_HS}} + \dfrac {e^2}{4\pi \epsilon _0 R} \cancelto{\color{red}{S}}{\left \langle 1s_A | 1s_B \right \rangle} - \underbrace{ \left \langle 1s_A \left| \dfrac {e^2}{4 \pi \epsilon _0 r_A } \right| 1s_B \right \rangle }_ {\color{red} {K_{AB}}}\label {9.4.7S} \]
- У першому інтегралі ми маємо атом водню гамільтоніана та атомну функцію H 1s B. Функція 1s B є власною функцією оператора з власним значенням\(E_H\). Оскільки\(E_H\) є постійною, вона коефіцієнти виходить з інтеграла, який потім стає інтегралом перекриття,\(S\). Перший інтеграл тому зводиться до\(E_HS\).
- Другий термін - це лише кулонова енергія двох протонів, що перевищує інтеграл перекриття.
- Третій член, включаючи знак мінус, дається символом\(K\) і називається обмінним інтегралом, оскільки електрон описується орбітою 1s A з одного боку і орбітальною 1s B на іншій стороні оператора. Електрон змінює або обмінюється позицією в молекулі.
У кулонівському інтегралі електрон завжди знаходиться в одній орбіталі; тоді як в обмінному інтегралі електрон знаходиться в одній орбіталі з одного боку оператора і в іншій орбіті з іншого боку.
Використання виразів для\(H_{AA}\) (Equation\ ref {9.4.6}) і\(H_{AB}\) (Equation\ ref {9.4.7S}) і підстановки в Рівняння\(\ref{9.4.5}\) дає:
\[ \begin{align} E_{\pm} &= \dfrac {1}{1 \pm S} \left[ \left(E_H + \dfrac {e^2}{4\pi \epsilon_0 R}\right) (1 \pm S ) + J \pm K \right] \label {9.4.8} \\[4pt] &= E_H + \dfrac {e^2}{4\pi \epsilon _0 R} + \dfrac {J \pm K}{1 \pm S} \label {9.4.9} \end{align} \]
Рівняння\(\ref{9.4.9}\) говорить нам, що енергія\(\ce{H_2^+}\) молекули - це енергія атома водню плюс енергія відштовхування двох протонів плюс деякі додаткові електростатичні взаємодії електрона з протонами. Ці додаткові взаємодії даються останнім терміном
\[ \dfrac {J \pm K}{1 \pm S} \nonumber. \nonumber \]
Якщо протони нескінченно далеко один від одного,\(E_H\) то тільки ненуль, який ми можемо встановити на нуль, віднімаючи від:
\[ \begin{align} \Delta E_{\pm} &= E_{\pm} - E_H \\[4pt] &= \dfrac {e^2}{4\pi \epsilon _0 R} + \dfrac {J \pm K}{1 \pm S} \label {9.4.10} \end{align} \]
Для отримання хімічного зв'язку і стабільної\(\ce{H_2^+}\) молекули\(\Delta E_{\pm}\) повинні бути менше нуля і мати мінімум, тобто\( \dfrac {J \pm K}{1 \pm S}\) повинні бути досить негативними, щоб подолати позитивну енергію відштовхування двох протонів\(\dfrac {e^2}{4 \pi \epsilon _0R }\) для деякого значення\(R\). Для великих\(R\) ці терміни дорівнюють нулю, а для малих\(R\) кулонівське відштовхування протонів піднімається до нескінченності.
Покажіть, що рівняння 9.2.1 випливає з рівняння\(\ref{9.4.5}\)
Кулонові та біржові інтеграли
Ми розглянемо більш уважно, як термін відштовхування Кулона і інтеграли\(J\)\(K\), і\(S\) залежать від поділу протонів, але спочатку ми хочемо обговорити фізичне значення\(J\), інтеграл Кулона, і\(K\), обмінний інтеграл. \(J\)і\(K\) були визначені як
\[ J_{AB} = \left \langle 1s_A \left| \dfrac {-e^2}{4 \pi \epsilon _0 r_B } \right|1s_A \right \rangle = - \int \varphi ^*_{1s_A} (r) \varphi _{1s_A} (r) \dfrac {e^2}{4 \pi \epsilon _0 r_B } d\tau \label {9.4.11} \]
\[ K_{AB} = \left \langle 1s_A \left| \dfrac {-e^2}{4 \pi \epsilon _0 r_A } \right|1s_B \right \rangle = - \int \varphi ^*_{1s_A} (r) \varphi _{1s_B} (r) \dfrac {e^2}{4 \pi \epsilon _0 r_A } d\tau \label {9.4.12} \]
Рисунок Template:index показує графіки чотирьох членів, що сприяють енергії\(\ce{H_2^{+}}\) (Рівняння\(\ref{9.4.10}\)). На малюнку Template:index ви можете бачити, що, коли міжядерна відстань\(R\) наближається до нуля,
- Кулонівське відштовхування двох протонів йде від майже нуля до великого позитивного числа,
- інтеграл перекриття йде за нуль до одиниці, а
- \(J\)і\(K\) стають все більш негативними.

Зауважте, що обидва\(J\) і\(K\) інтеграли є від'ємними, оскільки всі величини в інтегралах Equation\ ref {9.4.11} та\ ref {9.4.12} є додатними. У кулонівському інтегралі\(e \varphi ^*_{1s_A} (r) \varphi _{1a_A} (r)\) - щільність заряду електрона навколо протона А, так як r представляє координати електрона щодо протона А. Оскільки r B - відстань цього електрона до протона В, кулонівський інтеграл дає потенційну енергію заряду щільність навколо протона А, що взаємодіє з протоном B.,\(J\) може бути інтерпретована як середня потенційна енергія цієї взаємодії, оскільки\(e \varphi ^*_{1s_A} (r) \varphi _{1a_A} (r)\) є щільністю ймовірності для електрона в точці\(r\), і\(\dfrac {e^2}{4 \pi \epsilon _0 r_B }\) є потенційною енергією електрона в цій точці внаслідок взаємодії з протоном B. По суті, J припадає на залучення протона B до електронної щільності атома водню A. Коли два протони розходяться далі, цей інтеграл йде до нуля, оскільки всі значення для r B стають дуже великими, а всі значення для 1/r B стають дуже малими.
У обмінному\(K\) інтегралі добуток двох функцій є ненульовим лише в областях простору, де дві функції перекриваються. Якщо одна функція дорівнює нулю або дуже мала в якийсь момент, то твір буде нульовим або малим. Інтеграл обміну також наближається до нуля, оскільки міжядерні відстані збільшуються, оскільки і перекриття, і\(1/r\) значення стають нульовими. Виріб\(e \varphi ^*_{1s_A} (r) \varphi _{1a_B} (r)\) називається щільністю нахлеста заряду. Оскільки щільність заряду перекриття значна в області простору між двома ядрами, вона вносить важливий внесок у хімічний зв'язок. Обмінний інтеграл\(K\), - це потенційна енергія, обумовлена взаємодією щільності заряду перекриття з одним з протонів. Хоча\(J\) враховує залучення протона\(B\) до електронної щільності атома водню\(A\),\(K\) припадає на додаткове залучення протона внаслідок нарощування щільності електронного заряду між двома протонами.
Напишіть абзац, що описує своїми словами фізичне значення Кулона і обмінюйтеся інтегралами на\(\ce{H_2^{+}}\).
Рисунок Template:index показує енергію H 2 + відносно енергії відокремленого атома водню та протона, заданої рівнянням\(\ref{9.4.9}\). Для електрона в\(\psi_-\) орбіталі енергія молекули\(E_{el}(R)\), завжди більше енергії відокремленого атома і протона.
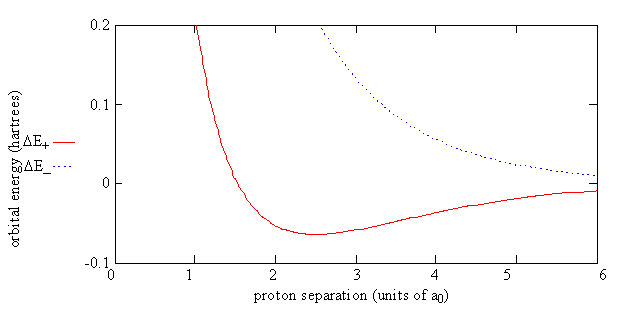
Для електрона на\(\psi _+\) орбіті ви можете бачити, що великим ефектом для енергії зв'язкової орбіти\(E_+(R)\), є баланс між відштовхуванням двох протонів\(\dfrac {e^2}{4 \pi \epsilon _0R }\) і J і K, які обидва є негативними. J і K вдається компенсувати відштовхування двох протонів до тих пір, поки їх поділ не складе менше 100 пм (тобто енергія негативна до цього моменту), а мінімум енергії виробляється в 134 вечора. Цей мінімум являє собою утворення хімічної зв'язку. Ефект S невеликий. Це лише змушує знаменник у Рівнянні\(\ref{9.4.9}\) збільшитися з 1 до 2, коли R наближається до 0.
Для антизв'язуючої орбіти\(-K\) є позитивною величиною і по суті скасовує J, тому не існує достатньої компенсації кулонівського відштовхування протонів. Ефект -K у виразі, Рівняння\(\ref{9.4.9}\), для\(E_-\) полягає в тому, щоб враховувати відсутність щільності заряду перекриття та посилене відштовхування, оскільки щільність заряду між протонами для\(\psi _-\) навіть нижча, ніж та, що дається атомними орбіталями.