2.1: Емпіричні закони газу
- Page ID
- 21045
Ряд важливих взаємозв'язків, що описують природу зразків газу, були виведені повністю емпірично (тобто засновані виключно на спостереженні, а не спробі визначити теоретичну причину цих зв'язків можуть існувати. Це емпіричні газові закони.
Закон Бойла
Однією з важливих взаємозв'язків, що регулюють зразки газу, які можна моделювати математично, є взаємозв'язок між тиском та об'ємом. Роберт Бойл (1627 — 1691) (Hunter, 2004) провів експерименти, щоб підтвердити спостереження Річарда Таунелі та Генрі Пауерса, щоб показати, що для фіксованого зразка газу при постійній температурі тиск і об'єм обернено пропорційні.
\[ pV = \text{constant}\]
або
\[p_1V_2=p_2V_2\]
Бойл використовував скляну U-трубку, яка була закрита одним кінцем і з нижньою частиною, заповненою ртуттю (захоплюючи пробу повітря в закритому кінці). Додаючи ртуть до відкритого кінця, він зміг спостерігати і кількісно оцінювати стиснення захопленого повітря.
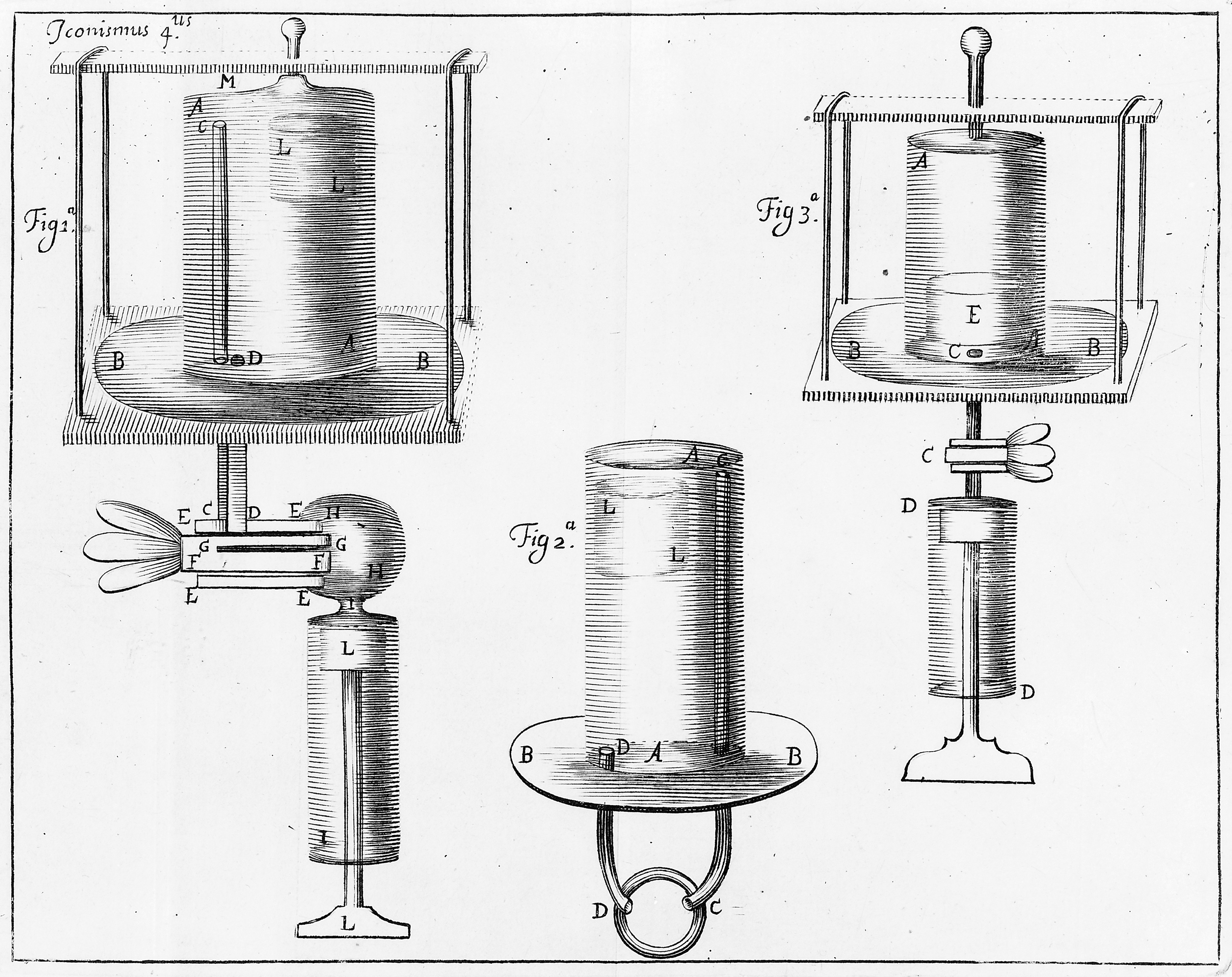
Закон Чарльза
Закон Чарльза стверджує, що обсяг фіксованого зразка газу при постійному тиску пропорційний температурі. Щоб цей закон працював, повинен бути абсолютний мінімум до температурної шкали, оскільки, безумовно, існує абсолютний мінімум до шкали обсягу!
\[\dfrac{V}{T} = \text{constant}\]
або
\[\dfrac{V_1}{T_2} = \dfrac{V_1}{T_2} \]
Другий закон термодинаміки також передбачає абсолютну мінімальну температуру, але це буде розроблено в наступному розділі.
Закон Гей-Люссака
Закон Гей-Люссака говорить, що тиск фіксованого зразка газу пропорційно температурі. Як і у випадку з законом Чарльза, це говорить про існування абсолютного мінімуму до температурної шкали, оскільки тиск ніколи не може бути негативним.
\[\dfrac{p}{T} = \text{constant}\]
або
\[\dfrac{p_1}{T_2} = \dfrac{p_1}{T_2} \]
Закон про комбінований газ
Закони Бойла, Чарльза та Гей-Люссака можна об'єднати в єдину емпіричну формулу, яка може бути корисною. Для заданої кількості газу повинна триматися наступна залежність:
\[\dfrac{pV}{T} = \text{constant}\]
або
\[\dfrac{p_1V_1}{T_1} = \dfrac{p_2V_2}{T_2}\]
Закон Авогадро
Амедео Авогадро (1776-1856) (Енциклопедія, 2016) провів велику роботу з газами в своїх дослідженнях речовини. В ході своєї роботи він відзначив важливу залежність між числом молів в пробі газу. Закон Авогадро (Avogadro, 1811) говорить, що при однаковій температурі і тиску будь-яка проба газу має однакову кількість молекул на одиницю об'єму.
\[\dfrac{n}{V} = \text{constant} \]
або
\[\dfrac{n_1}{V_1} = \dfrac{n_2}{V_2} \]

