10: Розчини електролітів
- Page ID
- 26377
Термодинамічні властивості розчинів електролітів суттєво відрізняються від властивостей сумішей неелектролітів.
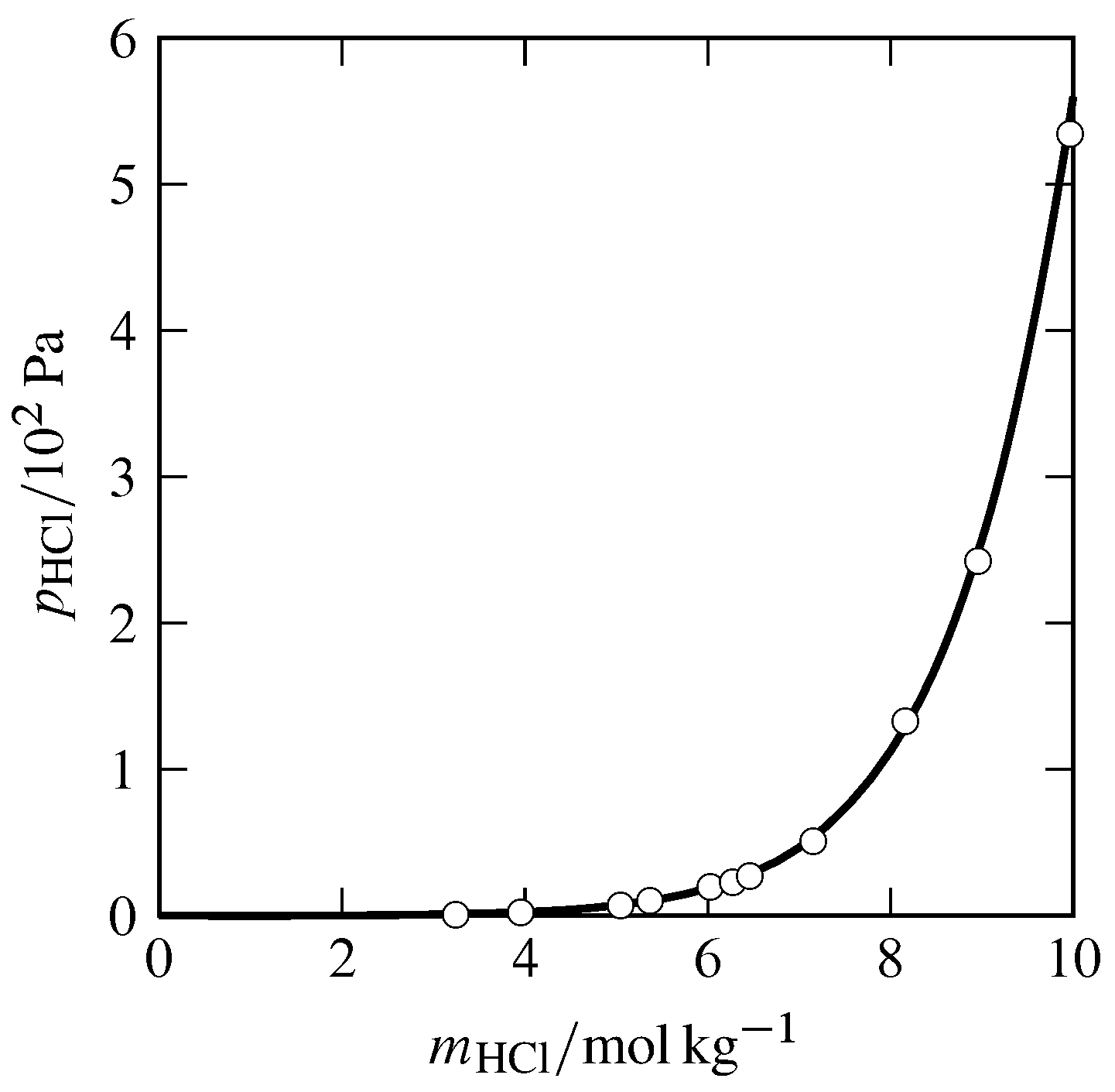
Малюнок 10.1 Парціальний тиск HCl в газовій фазі, рівноважених з водною HCl при\(25\units{\(\degC\)}\) і\(1\br\). Відкриті кола: експериментальні дані Стюарта Бейтса та Х. Дарвіна Кіршмана, Дж. Хім. Соц. , 41, 1991—2001, 1919.
Ось приклад. Чистий HCl (хлористий водень) - це газ, який добре розчинний у воді. Графік парціального тиску газоподібного HCl в рівновазі з водною HCl, як функції молярності розчину (рис. 10.1), показує, що граничний нахил при нескінченному розведенні не кінцевий, а нульовий. У чому причина такої поведінки закону, що не Генрі? Це повинно бути тому, що HCl є електролітом - він дисоціює (іонізує) у водному середовищі.
Для еталонного і стандартного станів розчинів електролітів прийнято використовувати основу молярності. Це єдина основа, яка використовується в цьому розділі, навіть якщо явно не вказано для іонів. Символ\(\mu_{+}\st\), наприклад, позначає хімічний потенціал катіона в стандартному стані на основі молярності.
Маючи справу з розчиненою речовиною електроліту, ми можемо посилатися на розчинену речовину (речовину) в цілому та до окремих заряджених іонів, які виникають внаслідок дисоціації. Ми можемо застосувати однакові загальні визначення хімічного потенціалу, коефіцієнта активності до цих різних видів, але експериментально можна оцінити лише коефіцієнт активності та активність розчиненої речовини в цілому.
