8.2: Фазові діаграми чистих речовин
- Page ID
- 26356
Фазова діаграма - це двовимірна карта, яка показує, які фази або фази здатні існувати в рівноважному стані за заданих умов. У цій главі описані фазові діаграми тиску - об'єму та тиску - температури для однієї речовини, а глава 13 описує численні типи фазових діаграм для багатокомпонентних систем.
8.2.1 Особливості фазових діаграм
Двовимірні фазові діаграми для одноречовинної системи можуть генеруватися у вигляді проекцій тривимірної поверхні в системі координат з декартовими осями\(p\)\(V/n\), і\(T\). Точка на тривимірній поверхні відповідає фізично реалізованій комбінації значень, для рівноважного стану системи, що містить загальну\(n\) кількість речовини, змінних\(p\)\(V/n\), і\(T\).
Концепції, необхідні для інтерпретації фазових діаграм з однією речовиною, будуть проілюстровані вуглекислим газом.
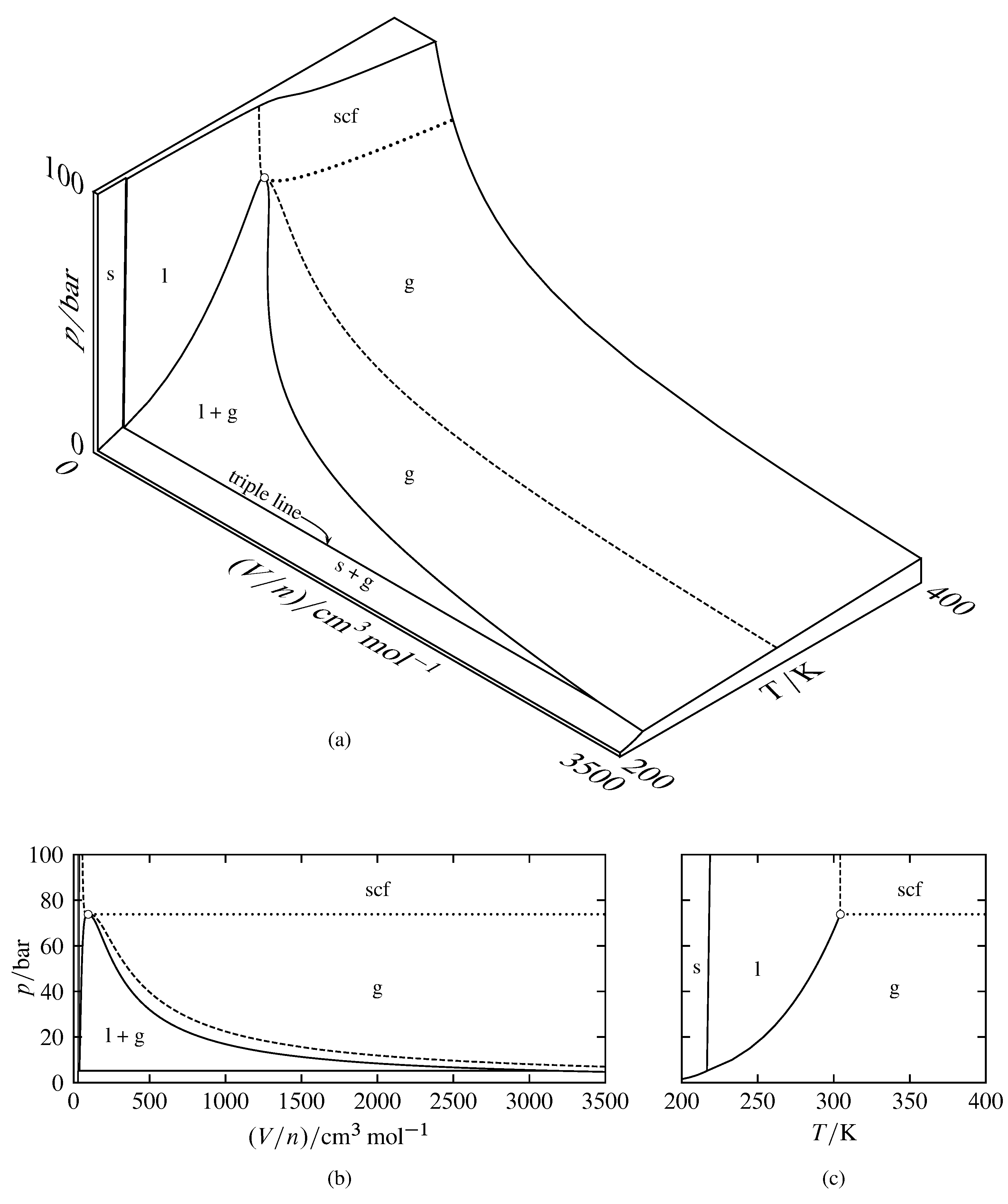
Малюнок 8.2 Відносини між\(p\)\(V/n\), і\(T\) для вуглекислого газу (на основі даних в NIST Chemistry WebBook і в S. Angus, B. Armstrong, і K.M. de Reuck, Міжнародні термодинамічні таблиці рідкого стану, Vol. 3, Діоксид вуглецю, Пергамний прес, Оксфорд, 1976). Області маркуються стабільною фазою або фазами (scf розшифровується як надкритична рідина). Розімкнуте коло вказує на критичну точку.
(а) Тривимірна\(p\)\((V/n)\) —\(T\) поверхня. Пунктирна крива є критичною ізотермою в\(T=304.21\K\), а пунктирна крива є частиною критичної ізобарі в\(p=73.8\br\).
(b) фазова діаграма тиску — об'єму (проекція поверхні на\((V/n)\) площину\(p\) —).
(c) Діаграма фази тиск-температура (проекція поверхні на\(T\) площину\(p\) —).
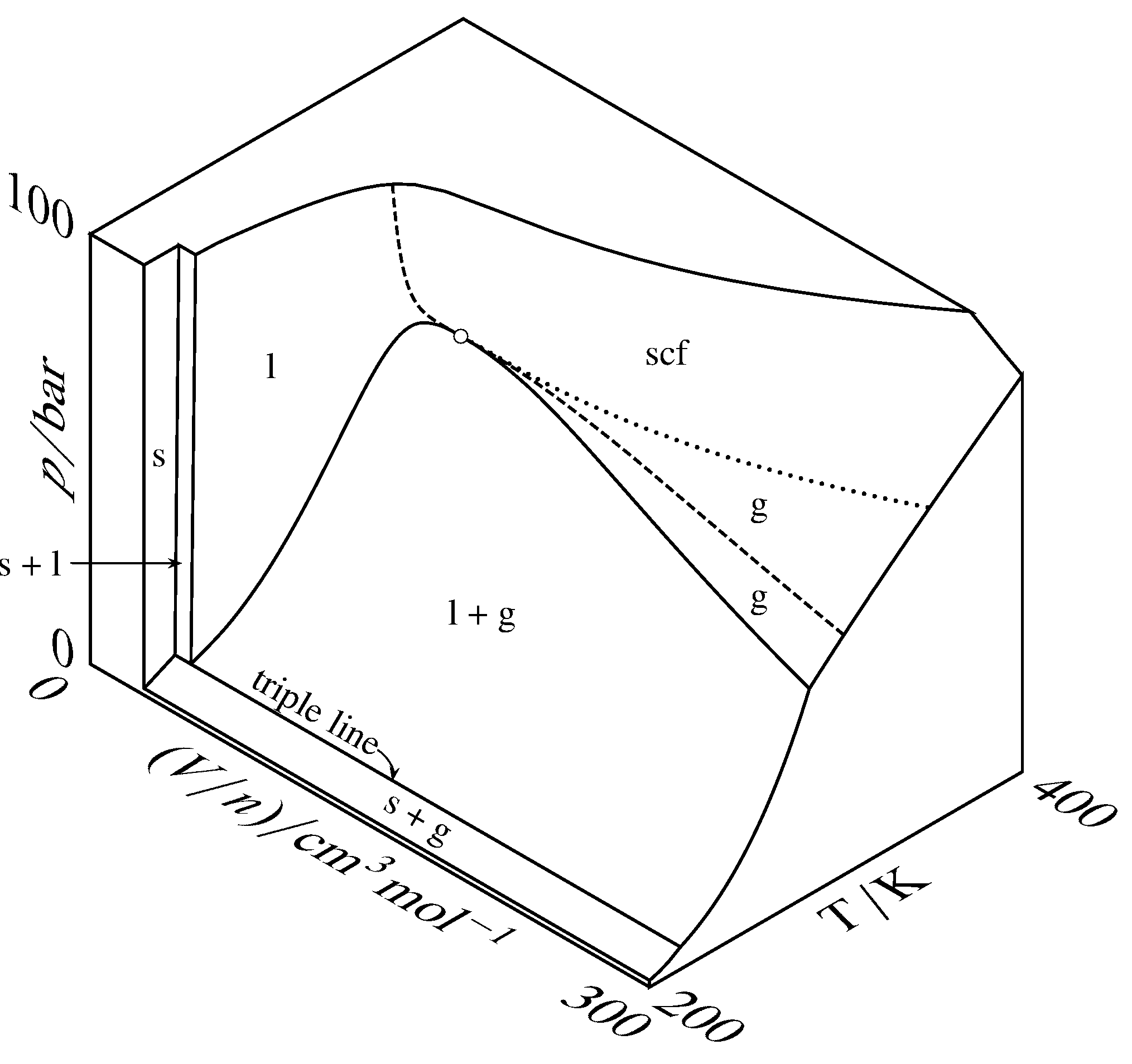
Малюнок 8.3 Тривимірна\(p\)\((V/n)\) —\(T\) поверхня для СО\(_2\), збільшена вздовж\(V/n\) осі в порівнянні з рис.8.2. Відкрите коло - критична точка, пунктирна крива - критична ізотерма, а пунктирна крива - частина критичного ізобара.
Тривимірні поверхні для вуглекислого газу показані в двох різних масштабах на рис. 8.2 і на рис.8.3. На цих малюнках деякі ділянки поверхні позначені єдиним фізичним станом: тверде, рідке, газ або надкритична рідина. Точка в одній з цих областей відповідає рівноважному стану системи, що містить одну фазу маркованого фізичного стану. Форма поверхні в цій однофазної області дає рівняння стану фази (тобто залежність однієї зі змінних від двох інших). Точка в області, позначеної двома фізичними станами, відповідає двом співіснуючим фазам. Потрійна лінія - локус точок для всіх можливих систем рівноваги трьох співіснуючих фаз, які в даному випадку є твердою, рідиною і газом. Точка на потрійній лінії також може відповідати лише одній або двом фазам.
Двовимірні проекції, показані на рис. 8.2 (b) та 8.2 (c), є діаграмами фази тиску - об'єму та тиску - температури. Оскільки всі фази багатофазної системи рівноваги мають однакову температуру і тиск (припускаючи, що немає обмежень, таких як внутрішні адіабатичні перегородки), проекція кожної двофазної області на діаграму тиску - температура - це крива, яка називається кривою співіснування або межа фази, а проекція потрійної лінії - це точка, звана потрійною точкою.
Як ми можемо використовувати фазову діаграму? Дві осі представляють значення двох незалежних змінних, таких як\(p\) і\(V/n\) або\(p\) і\(T\). Для заданих значень цих змінних ставимо точку на діаграмі на перетині відповідних координат; це системна точка. Тоді залежно від того, чи падає точка системи в області або на кривій співіснування, діаграма повідомляє нам кількість та види фаз, які можуть бути присутніми в системі рівноваги.
Якщо точка системи потрапляє в область, позначену фізичним станом однієї фази, в системі рівноваги може бути присутнім лише один вид фази. Система, що містить чисту речовину в одній фазі, є біваріантною (\(F = 3 - 1 = 2\)), тому ми можемо варіювати дві інтенсивні властивості незалежно. Тобто, системна точка може самостійно переміщатися по двом координатам (\(p\)і\(V/n\), або\(p\) і\(T\)) і все одно залишатися в однофазної області фазової діаграми. Коли\(V\) і\(n\) відносяться до однієї фази, змінною\(V/n\) є молярний об'єм\(V\m\) у фазі.
Якщо системна точка падає в області діаграми фази тиску - об'єму, позначеної символами для двох фаз, ці дві фази співіснують у рівновазі. Фази мають однаковий тиск і різні молярні обсяги. Щоб знайти молярні обсяги окремих фаз, проводимо горизонтальну лінію постійного тиску, звану лінією прив'язки, через системну точку і проходить від одного краю ділянки до іншого. Горизонтальне положення кожного кінця лінії стяжки, де вона закінчується на кордоні з однофазною площею, дає молярний обсяг в цій фазі в двофазній системі. Приклад лінії стяжки див. Рис. 8.9.
Потрійна лінія на діаграмі тиск-об'єм представляє діапазон значень,\(V/n\) в якому три фази (тверда, рідина та газ) можуть співіснувати при рівновазі.
Гелій є єдиною речовиною, яка не має потрійної лінії твердої рідини - газу. Коли система, що містить співіснуючі рідину і газ\({}^4\) Він охолоджується до\(2.17\K\), досягається потрійна точка, в якій третя фаза - рідина під назвою He-II, яка має унікальну властивість надплинності. Тільки при високих тисках (\(10\br\)або більшому) може існувати твердий гелій.
Трифазна однокомпонентна система є інваріантною (\(F = 3 - 3 = 0\)); існує лише одна температура (триточкова температура\(T\subs{tp}\)) і один тиск (потрійний тиск\(p\subs{tp}\)), при якому три фази можуть співіснувати. Значення\(T\subs{tp}\) і\(p\subs{tp}\) є унікальними для кожної речовини, і відображаються положенням потрійної точки на фазовій діаграмі тиск—температура. Молярні об'єми в трьох співіснуючих фазах задаються значеннями\(V/n\) у трьох точках діаграми тиску - об'єму, де потрійна лінія стосується однофазної області. Ці точки знаходяться на двох кінцях і проміжному положенні потрійної лінії. Якщо точка системи знаходиться на будь-якому кінці потрійної лінії,\(p\subs{tp}\) може бути присутня лише одна фаза відповідного молярного об'єму при температурі\(T\subs{tp}\) та тиску. Коли системна точка знаходиться на потрійній лінії в будь-якому місці між двома кінцями, можуть бути присутніми дві або три фази. Якщо системна точка знаходиться в положенні на потрійній лінії, що відповідає фазі проміжного молярного об'єму, може бути лише одна фаза.

Рисунок 8.4 Діаграма фази тиску високого тиску - температура H\(_2\) O (на основі даних Д. Айзенберга та В. Каузмана, Структура та властивості води, Oxford University Press, Нью-Йорк, 1969, таблиця 3.5, і Carl W.F. T. Pistorius et al, J. Chem. Фіз. , 38, 600—602, 1963). Римські цифри позначають сім форм льоду.
При високих тисках речовина може мати додаткові потрійні точки для двох твердих фаз і рідини, або для трьох твердих фаз. Це ілюструється фазовою діаграмою тиску - температура H\(_2\) O на рис. 8.4, яка поширюється на тиск до\(30\units{kbar}\). (У цьому масштабі крива співіснування рідина-газ лежить занадто близько до горизонтальної осі, щоб її було видно.) На діаграмі показано сім різних твердих фаз Н\(_2\) О, що відрізняються кристалічною структурою і позначені льодом I, лід II і так далі. Лід I - звичайна форма льоду, стійка внизу\(2\br\). На схемі чотири потрійні точки для двох твердих тіл і рідини і три потрійні точки для трьох твердих тіл. Кожна потрійна точка інваріантна. Зверніть увагу, як H\(_2\) O може існувати як твердий лід VI або лід VII вище його стандартної температури плавлення,\(273\K\) якщо тиск досить високий («гарячий лід»).
8.2.2 Двофазна рівновага
Система, що містить дві фази чистої речовини в рівновазі, є одноваріантною. Обидві фази мають однакові значення\(T\) і з\(p\), але ці значення не є незалежними через вимогу, щоб фази мали рівні хімічні потенціали. Ми можемо змінювати лише одну інтенсивну змінну чистої речовини (наприклад,\(T\) або\(p\)) незалежно, тоді як дві фази співіснують у рівновазі.
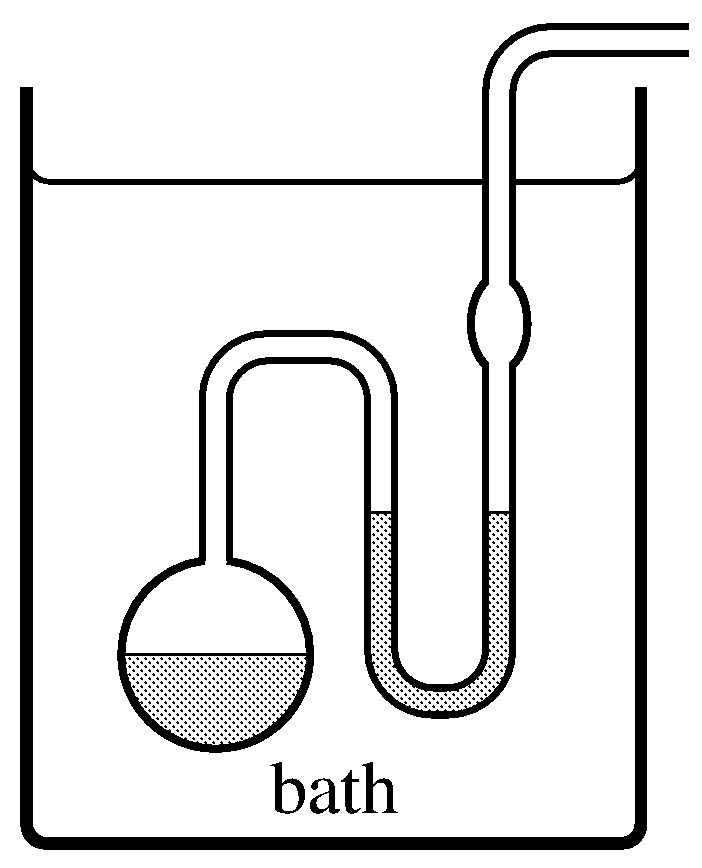
Малюнок 8.5 Ізотеніскоп. Рідина, що підлягає дослідженню, поміщається в посудину і U-трубку, про що вказує затінення, і підтримується при фіксованій температурі у ванні. Тиск в бічній трубці знижується до тих пір, поки рідина не закипить м'яко і її пар не змітає повітря. Тиск регулюється до тих пір, поки рівень рідини не буде однаковим в обох кінцівках U-трубки; тиск пари рідини тоді дорівнює тиску в бічній трубці, яке можна виміряти за допомогою манометра.
При заданій температурі тиск, при якому тверда речовина і газ або рідина і газ знаходяться в рівновазі, називається тиском пари або тиском пари насичення твердої речовини або рідини. Тиск пари твердої речовини іноді називають тиском сублімації. Ми можемо виміряти тиск пари рідини при фіксованій температурі за допомогою простого пристрою, званого ізотеніскопом (рис.8.5).
У системі з більш ніж однієї речовини тиск пари може відноситися до парціального тиску речовини в газовій суміші, врівноваженій з твердим або рідиною цієї речовини. Вплив загального тиску на тиск пари буде розглянуто в п. 12.8.1. Ця електронна книга посилається на тиск пари насичення рідини, коли необхідно вказати, що саме чиста рідка і чиста газова фази знаходяться в рівновазі при однаковому тиску.
При заданому тиску температура плавлення або температура замерзання - це температура, при якій тверда і рідина знаходяться в рівновазі, температура кипіння або температура насичення - це температура, при якій рідина і газ знаходяться в рівновазі, а сублімація температура або точка сублімації - це температура, при якій тверде тіло і газ знаходяться в рівновазі.
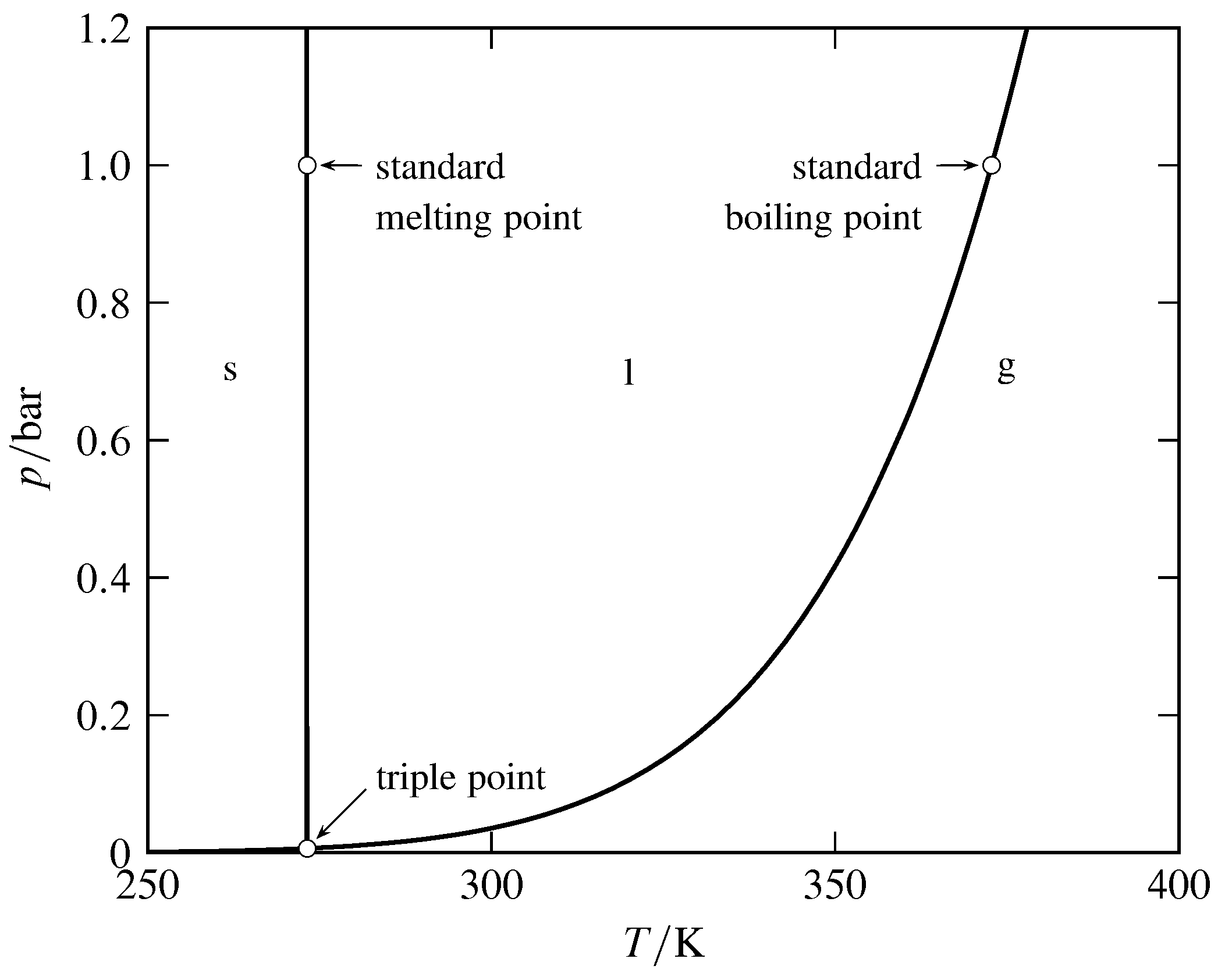
Рисунок 8.6 Діаграма фази тиску — температури H\(_2\) O. (На основі даних у веб-книзі NIST Chemistry.)
Співвідношення між температурою і тиском в системі з двома фазами в рівновазі показано кривою співіснування, що розділяє дві однофазні області на діаграмі тиск—температура (див. Рис. 8.6). Розглянемо криву рідина—газ. Якщо розглядати\(T\) як незалежну змінну, крива - це крива тиску пари, яка показує, як тиск пари рідини змінюється залежно від температури. Якщо ж\(p\) є незалежною змінною, то крива являє собою криву точки кипіння, що показує залежність температури кипіння від тиску.
Нормальна температура плавлення або температура кипіння відноситься до тиску однієї атмосфери, а стандартна температура плавлення або температура кипіння відноситься до стандартного тиску. Таким чином, нормальна температура кипіння води (\(99.97\units{\(\degC\)}\)) - це температура кипіння при\(1\units{atm}\); ця температура також відома як точка пари. Стандартна температура кипіння води (\(99.61\units{\(\degC\)}\)) - це температура кипіння при трохи нижчому тиску\(1\br\).
Криві співіснування будуть розглянуті далі в п. 8.4.
8.2.3 Критична точка
Кожна речовина має певну температуру, критичну температуру, вище якої може існувати тільки одна рідинна фаза при будь-якому обсязі і тиску (п. 2.2.3). Критичною точкою є точка на фазовій діаграмі, що відповідає співіснуванню рідина-газ при критичній температурі, а критичним тиском є тиск у цій точці.

Малюнок 8.7 Скляна колба, заповнена СО\(_2\) на величину,\(V/n\) близьку до критичного значення, розглядається при чотирьох різних температурах. Три кульки мають щільність менше, приблизно рівну і більше критичної щільності. (Фотографії з дозволу фотографа; вони з'явилися в Яна Сенгерса та Аннеке Левелт Сенгерс, Chem. англ. Новини, 10 червня, 104—118, 1968 р.)
(а) Надкритична рідина при температурі вище критичної температури.
(б) Інтенсивна опалесценція трохи вище критичної температури.
(c) Утворення меніска трохи нижче критичної температури; рідина і газ майже однакової щільності.
(d) Температура значно нижче критичної температури; рідина і газ дуже різної щільності.
Щоб спостерігати критичну точку речовини експериментально, ми можемо евакуювати скляну посудину, ввести таку кількість речовини, яка приблизно\(V/n\) дорівнює молярному об'єму в критичній точці, герметизувати посудину і підняти температуру вище критичної температури. Судно тепер містить єдину рідинну фазу. Коли речовина повільно охолоджується до температури трохи вище критичної температури, воно проявляє каламутний вигляд, явище, яке називається критичною опалесценцією (рис.8.7). Опалесценція - це розсіювання світла, викликане великими коливаннями місцевої щільності. При критичній температурі між рідкою і газовою фазами утворюється меніск практично однакової щільності. При подальшому охолодженні щільність рідини збільшується і щільність газу зменшується.
При температурах вище критичної температури і тисках вище критичного тиску одна існуюча рідинна фаза називається надкритичної рідиною. Таким чином, надкритична рідина чистої речовини - це рідина, яка не зазнає фазового переходу в іншу рідку фазу, коли ми змінюємо тиск при постійній температурі або змінюємо температуру при постійному тиску.
Якщо ж ми збільшимо\(p\) при постійному\(T\), надкритична рідина зміниться на тверду. На фазовій діаграмі Н\(_2\) О крива співіснування для льоду VII і рідини, показаної на рис. 8.4, поширюється на більш високу температуру, ніж критична температура\(647\K\). Таким чином, надкритична вода може бути перетворена в лід VII шляхом ізотермічного стиснення.
Рідина в надкритичній області може мати щільність, порівнянну з щільністю рідини, і може бути більш стисливою, ніж рідина. У надкритичних умовах речовина часто є відмінним розчинником для твердих речовин і рідин. Змінюючи тиск або температуру, розчиняючи потужність може бути змінена; зменшуючи тиск ізотермічно, речовина може бути легко видалена як газ з розчинених розчинених речовин. Ці властивості роблять надкритичні рідини корисними для хроматографії та екстракції розчинником.
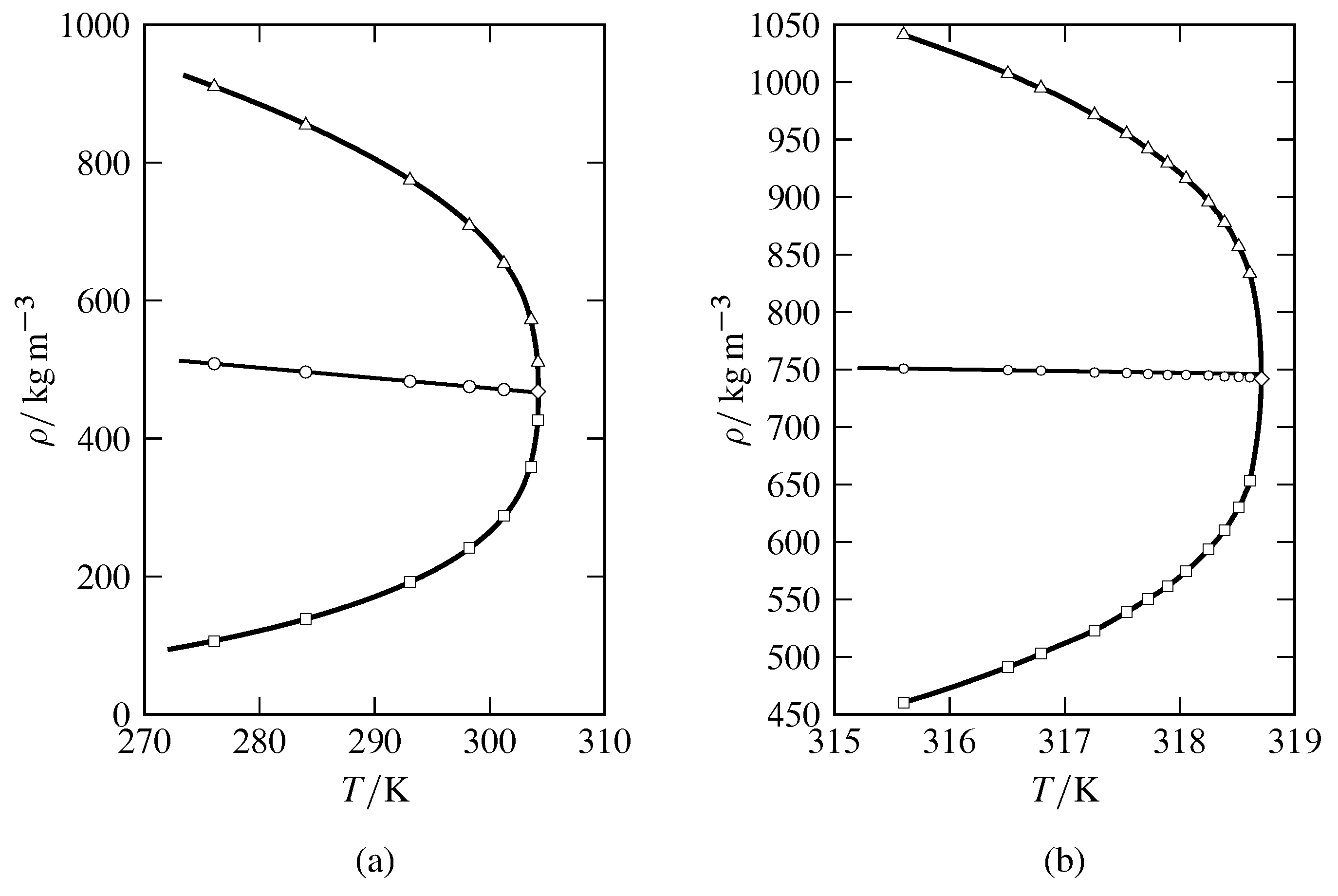
Рисунок 8.8 Щільності співіснуючих газових і рідких фаз, близьких до критичної точки, як функції температури для\(_2\) (а) СО (на основі даних А.Міхельса, Блейсса, і К. Michels, Proc. Р.Соц. Лондон, Сер. А, 160, 358—375, 1937); (б) СФ\(_6\) (дані М.В. Пестака та ін., Фіз. Преподобний Б, 36, 599—614, 1987, таблиця VII). Експериментальні щільності газу показують відкриті квадрати, а експериментальні щільності рідини - відкритими трикутниками. Середня щільність при кожній експериментальній температурі показана відкритим колом. Відкритий алмаз знаходиться при критичній температурі і критичній щільності.
Критичну температуру речовини можна виміряти досить точно, спостерігаючи за появою або зникненням меніска рідина-газ, а критичний тиск можна виміряти при цій температурі за допомогою манометра високого тиску. Для оцінки щільності в критичній точці найкраще екстраполювати середню щільність співіснуючих рідкої і газової фаз\((\rho\sups{l} +\rho\sups{g})/2\), на критичну температуру, як показано на рис. 8.8. Спостереження, що середня щільність близько наближає лінійну функцію температури, як показано на малюнку, відоме як закон прямолінійних діаметрів, або закон Кайлетета і Матіаса. Цей закон є наближенням, що видно по малому відхиленню середньої щільності СФ\(_6\) від лінійного відношення, дуже близького до критичної точки на рис. 8.8 (б). Цей збій закону прямолінійних діаметрів прогнозується останніми теоретичними методами лікування (Цзінтао Ван і Михайло Анатолійович Анісімов, Фіз. Преподобний Е, 75, 051107, 2007; Хасан Бехнежад, Ян Сенгерс, і Михайло Анісімов, в А.Р. Гудвін, Дж. Сенгерс, і К.Дж. Пітерс, редактори, Прикладна термодинаміка рідин, сторінки 321—367, Королівське товариство хімії, Кембридж, 2010).
8.2.4 Правило важеля
Розглянемо систему з однією речовиною, системна точка якої знаходиться в двофазній області фазової діаграми тиску - об'єму. Як ми можемо визначити суми на двох етапах?

Малюнок 8.9 Лінія прив'язки (пунктирна) при\(p\) постійній\(T\) та в зоні рідина-газ фазової діаграми тиску - об'єму. Точки A і B знаходяться на кінцях лінії прив'язки, а точка S - це системна точка на лінії прив'язки. \(L\sups{l}\)і\(L\sups{g}\) є довжинами AS і SB відповідно.
Як приклад, нехай система містить фіксовану кількість чистої речовини,\(n\) розділеної на рідку і газову фази, при температурі і тиску, при якому ці фази можуть співіснувати в рівновазі. При передачі тепла в систему при цьому\(T\) частина рідини випаровується фазовим переходом рідина—газ і\(V\) збільшується; відведення тепла при цьому\(T\) і\(p\) призводить до конденсації і\(V\) зменшення газу.\(p\) Молярні обсяги та інші інтенсивні властивості окремих рідких і газових фаз залишаються постійними під час цих змін при постійних\(T\) і\(p\). На фазовій діаграмі тиск-об'єм рис. 8.9 зміни гучності відповідають переміщенню точки системи вправо або вліво по лінії прив'язки АВ.
Коли в систему передається достатня кількість тепла, щоб випаровувати всю рідину в даному\(T\) і\(p\), точка системи рухається до точки B на правому кінці лінії зв'язку. \(V/n\)в цей момент повинен бути таким же, як і молярний обсяг газу,\(V\m\sups{g}\). Ми бачимо це тому, що системна точка могла переміщатися з однофазної газової зони в це положення на кордоні, не зазнаючи фазового переходу.
Коли, з іншого боку, з системи передається достатня кількість тепла, щоб конденсувати весь газ, точка системи рухається до точки А на лівому кінці лінії зв'язку. \(V/n\)в цій точці знаходиться молярний обсяг рідини,\(V\m\sups{l}\).
Коли точка системи знаходиться в положенні S на лінії прив'язки, присутні як рідина, так і газ. Їх суми повинні бути такими, щоб загальний обсяг був сумою обсягів окремих фаз, а загальна сума - сума сум в двох фазах:\ begin {рівняння} V = V\ sups {l} +V\ sups {g} = n\ sups {l} V\ m\ sups {l} +n\ sups {g} V\ m\ sups {g} 8.2.1}\ кінець {рівняння}\ почати {рівняння} n = n\ sups {l} +n\ sups {g}\ tag {8.2.2}\ end {рівняння} Значення в точці системи потім задається рівнянням\ begin {рівняння}\ frac {V} {n\ sups {l} V\ m\ sups {l} +n\ sups {g} V\ m\ sups {g}} {n\ sups {l} +n\ sups {g} ps {g}}\ tag {8.2.3}\ end {рівняння} який можна переставити на\ begin {рівняння} n\ sups {l}\ left (V\ m\ sups {l} -\ frac\(V/n\) {V} {n}\ праворуч) =n\ sups {g}\ left (\ frac {V} {n} -V\ n} -V\ m\ sups {g}\ право)\ tag {8.2.4}\ end {рівняння}\(V\m\sups{l}-V/n\) Кількості\(L\sups{l}\) і\(L\sups{g}\), відповідно, визначені на малюнку і\(V/n-V\m\sups{g}\) виміряні в одиницях\(V/n\). Це дає нам правило важеля рівноваги рідина-газ:\ begin {зібрати}\ s {n\ sups {l} L\ sups {l} = n\ sups {g} L\ sups {g}\ quad\ tx {or}\ quad\ frac {n\ sups {g}} {n\ sups {l}} =\ frac {L\ sups {l} L\ sups {g}}}\ tag {8.2.5}\ cond {(співіснуючі рідина і газ}\ nextcond {фази чистої речовини)}\ end {збирати} ( Ставлення називається правилом важеля за аналогією до нерухомого механічного важеля, кожен кінець якого має однакове значення твору прикладеної сили і відстані від точки опори.)
На рис. 8.9 точку системи S розташовують на лінії стяжки на дві третини шляху від лівого кінця, роблячи довжину в\(L\sups{l}\) два рази довше\(L\sups{g}\). Правило важеля потім дає співвідношення сум:\(n\sups{g}/n\sups{l} = L\sups{l}/L\sups{g} =2\). Третина від загальної кількості становить рідина, а дві третини - газ.
Ми не можемо застосувати правило важеля до точки на потрійній лінії, тому що нам потрібно більше, ніж значення,\(V/n\) щоб визначити відносні суми, присутні в трьох фазах.
Можна вивести більш загальний вигляд правила важеля, який знадобиться в главі 13 для фазових діаграм багатокомпонентних систем. Ця загальна форма може бути застосована до будь-якої двофазної області двовимірної фазової діаграми, в якій дійсна побудова зв'язкової лінії, при цьому положення системної точки вздовж лінії зв'язку задано змінною\ begin {рівняння} F\ defn\ frac {a} {b}\ tag {8.2.6}\ end {рівняння} де\(a\) і\(b\) великі державні функції. (На фазовій діаграмі тиску - об'єму на рис. 8.9 ці функції є\(a=V\)\(b=n\) і положення точки системи задається\(F=V/n\).) Повторюємо кроки деривації вище, позначаючи дві фази надрядками\(\pha\) і\(\phb\) замість\(l\) і\(g\). Відношення, відповідне еквалайзеру 8.2.4, дорівнює\ begin {рівняння} b\ aph (F\ apH-f) =b\ bph (F-F\ bph)\ tag {8.2.7}\ end {рівняння} Якщо\(L\aph\) і\(L\bph\) є довжинами, виміряними вздовж лінії зв'язку від точки системи до кінців лінії зв'язку на окремих фазах\(\pha\) і\(\phb\), відповідно, Eq. 8.2.7 дорівнює еквівалент загальному правилу важеля\ почати {рівняння} b\ aph L\ aph = б\ bph L\ bph\ qquad\ tx {або}\ qquad\ frac {b\ bph} {b\ aph} =\ frac {L\ aph} {L\ bph}\ тег {8.2.8}\ кінець {рівняння}
8.2.5 Властивості гучності
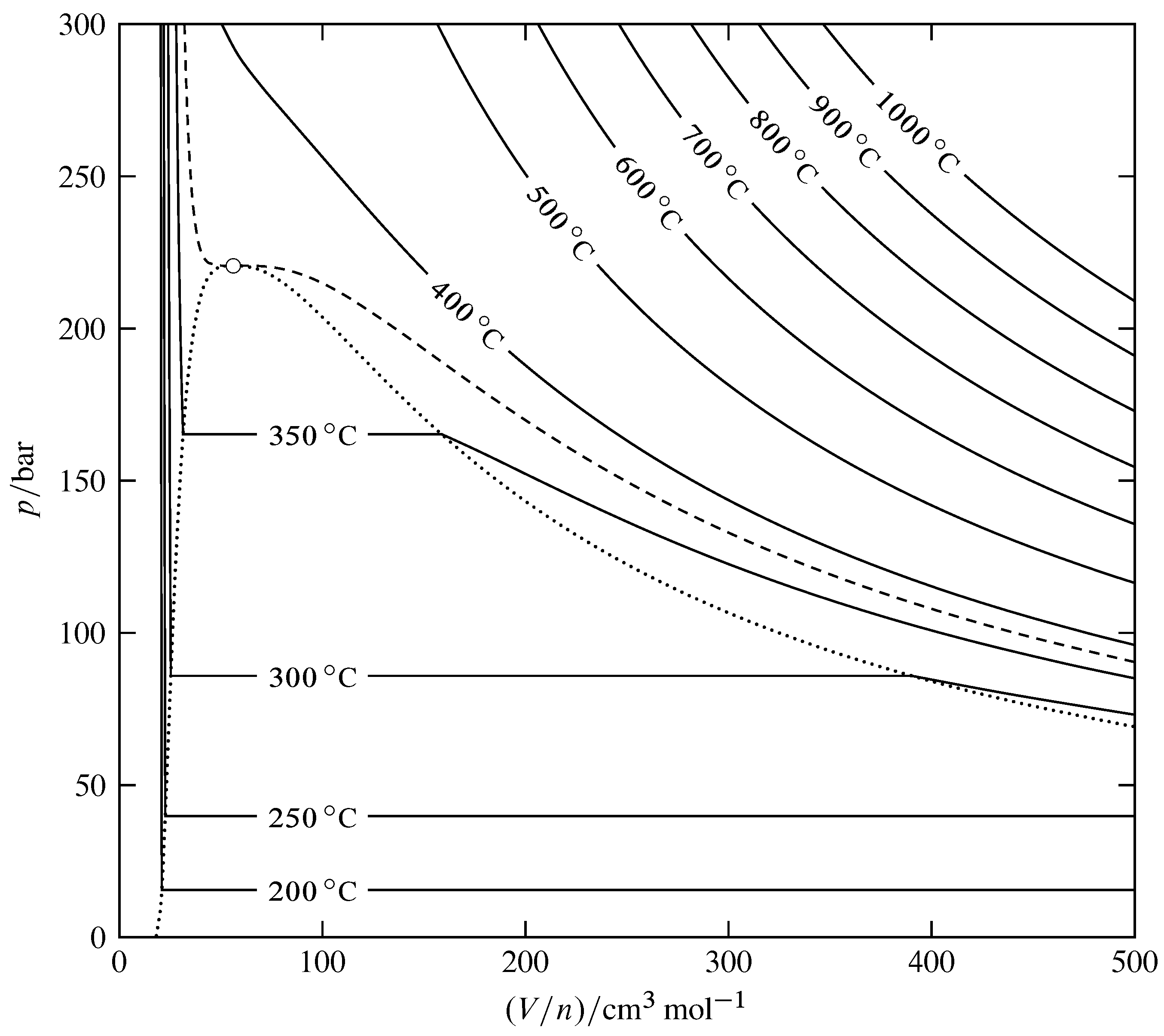
Малюнок 8.10 Ізотерми для рідких фаз H\(_2\) O (на основі даних в NIST Chemistry WebBook). Розімкнуте коло вказує на критичну точку, пунктирна крива - критична ізотерма в\(373.95\units{\(\degC\)}\), а пунктирна крива охоплює двофазну область фазової діаграми тиск - об'єм. Потрійна лінія лежить занадто близько до низу діаграми, щоб її було видно в цій шкалі.
Малюнок 8.10 являє собою фазову діаграму тиск-об'єм для Н\(_2\) О. На схемі намальовані ізотерми (криві константи\(T\)). Ці ізотерми визначають форму тривимірної\(p\)\((V/n)\) —\(T\) поверхні. Область, що містить горизонтальні сегменти ізотерми, є двофазною областю для співіснуючих рідкої та газової фаз. Межа цієї області визначається пунктирною кривою, проведеної через кінці горизонтальних відрізків. Однофазна рідинна область лежить зліва від цієї кривої, однофазна газова область лежить праворуч, а критична точка лежить вгорі.
Діаграма містить інформацію, необхідну для оцінки молярного об'єму при будь-якій температурі і тиску в однофазній області і похідні молярного об'єму по відношенню до температури і тиску. У системній точці в однофазної області нахил ізотерми, що проходить через точку, є частковою похідною\(\pd{p}{V\m}{T}\). Оскільки ізотермічна стисливість задана\(\kT = -(1/V\m)\pd{V\m}{p}{T}\), ми маємо\ begin {рівняння}\ kT = -\ frac {1} {V\ m\ times\ tx {нахил ізотерми}}\ tag {8.2.9}\ end {рівняння} Ми бачимо з рис. 8.10, що ухили ізотерм великі і негативні в рідкій області, менші і негативні в газовій і надкритичні рідинні області, і наближаються до нуля в критичній точці. Відповідно, ізотермічна стисливість газу і надкритичної рідини набагато більше, ніж у рідини, наближаючись до нескінченності в критичній точці. Критична опалесценція, показана на рис. 8.7, викликана локальними коливаннями щільності, які великі,\(\kT\) коли великі.
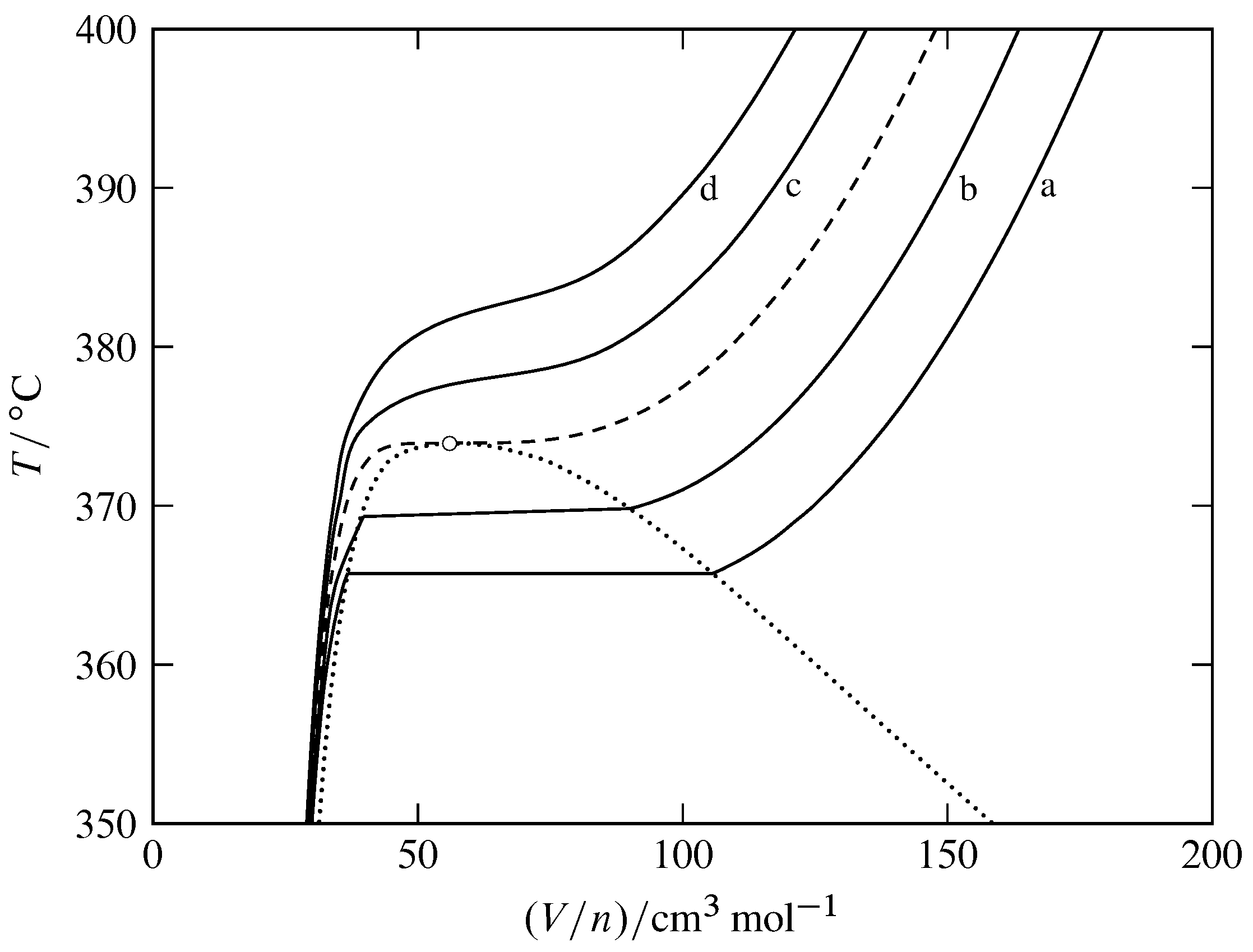
Малюнок 8.11 Ізобари для текучих фаз H\(_2\) O (на основі даних в NIST Chemistry WebBook). Відкрите коло вказує на критичну точку, пунктирна крива - критична ізобар в\(220.64\br\), а пунктирна крива охоплює двофазну область фазової діаграми температури - об'єму.
Тверді криві: a,\(p=200\br\); b,\(p=210\br\); c,\(p=230\br\); d,\(p=240\br\).
На малюнку 8.11 показані ізобари для H\(_2\) O замість ізотерм. У системній точці в однофазної області нахил ізобара, що проходить через точку, є частковою похідною\(\pd{T}{V\m}{p}\). Коефіцієнт кубічного розширення\(\alpha\) дорівнює\((1/V\m)\pd{V\m}{T}{p}\), тому ми маємо\ begin {рівняння}\ alpha =\ frac {1} {V\ m\ times\ tx {нахил ізобара}}\ tag {8.2.10}\ end {рівняння} На малюнку видно, що нахили ізобарів великі і позитивні в рідкій області, менші і негативні в газовій і надкритичні області рідини, і наближаються до нуля в критичній точці. При цьому газ і надкритична рідина мають набагато більші коефіцієнти кубічного розширення, ніж рідина. Значення\(\alpha\) наближається до нескінченності в критичній точці, що означає, що в критичній області на розподіл щільності сильно впливають температурні градієнти. Це може пояснити низьке положення середньої кулі на рис. 8.7 (б).
