16.15: Коефіцієнти активності розчинника з вимірювань депресії точки замерзання
- Page ID
- 21804
Аналіз депресії точки замерзання, який ми представляємо в Розділі 16.11, вводить ряд спрощуючих припущень. Ми зараз беремося за більш ретельний аналіз цього явища. Цей аналіз має практичне значення. Вимірювання депресії точки замерзання розчину - це один із способів визначення активності та коефіцієнта активності компонента розчинника. Як ми бачимо в розділі 16.7, якщо ми маємо коефіцієнти активності розчинника в діапазоні концентрацій розчинених речовин, ми можемо використовувати рівняння Гіббса-Дюхема, щоб знайти коефіцієнти активності для розчиненої речовини. Вимірювання депресії точки замерзання широко використовувалися для визначення коефіцієнтів активності водних розчинів шляхом вимірювання активності води в їх розчині.
Як і в нашому попередньому обговоренні депресії точки замерзання, система рівноваги - це розчин розчиненої речовини\(A\) в розчиннику\(B\), який знаходиться в фазовій рівновазі з чистим твердим розчинником\(B\). Наша сьогоднішня мета полягає у визначенні активності розчинника в його розчині при температурі плавлення чистого розчинника. Отримавши цю інформацію, ми можемо використовувати співвідношення Гіббса-Дюхема, щоб знайти активність розчиненої речовини, як функції концентрації розчиненої речовини, при температурі плавлення чистого розчинника. Після того, як ми отримаємо активність розчиненої речовини при температурі плавлення чистого розчинника, ми можемо використовувати методи, розроблені в розділі 14.14, щоб знайти активність розчиненої речовини в розчині при будь-якій більш високій температурі.
У розділі 14.14 ми знаходимо температурну залежність природного логарифма хімічної активності компонента розчину. Для конкретного вибору стандартних станів активності та еталонних станів ентальпії розроблено метод отримання експериментальних даних, необхідних для застосування цього рівняння. Для стислості, давайте звернемося до цих варіантів як до нескінченних стандартних станів розведення. Для того щоб визначити активність розчинника в його розчині при температурі плавлення чистого розчинника, корисно визначити додаткове стандартний стан для розчинника. При температурах нижче нормальної температури плавлення, яку ми знову позначаємо як\(T_F\), ми дозволяємо нормовому стану активності розчинника бути чистим твердим\(B\). Вище температури плавлення ми використовуємо нескінченний стандартний стан розведення, який ми визначаємо в розділі 14.14; тобто ми дозволяємо стандартному стану активності розчинника бути чистим рідким розчинником\(B\).
При і нижче температури плавлення\(T_F\), стандартний стан активності для розчинника\(B\), є чистим твердим речовиною\(B\). При температурі плавлення і вище, стандартним станом активності для розчинника є чиста рідина\(B\). При температурі плавлення чистий твердий розчинник знаходиться в рівновазі з чистим рідким розчинником, який також є розчинником у нескінченно розведеному розчині. При\(T_F\), активність стандартного стану хімічних потенціалів чистого твердого розчинника, чистого рідкого розчинника та розчинника в нескінченно розведеному розчині все однакові. Звідси випливає, що значення, яке ми отримуємо для активності розчинника при\(T_F\), для будь-якого конкретного розчину, буде однаковим, чи ми визначаємо його з вимірювань нижче\(T_F\) за допомогою чистого твердого стандартного стану або з вимірювань вище\(T_F\) за допомогою нескінченно розведеного розчину. стандартна держава.
Тепер розглянемо хімічний потенціал рідкого розчинника\(B\) в розчині, склад якого обумовлений молярністю розчиненої речовини\(A\)\({\underline{m}}_A\), коли активність стандартного стану є чистим твердим\(B\). Ми хочемо знайти цей хімічний потенціал при температурах в діапазоні\(T_{fp}
\[{\mu }_B\left(\mathrm{solution},\ {\underline{m}}_A,T\right)\]\[={\widetilde{\mu }}^o_B\left(\mathrm{pure\ solid},\ T\right)+RT{ \ln {\tilde{a}}_B\ }\left(\mathrm{solution},\ {\underline{m}}_A,T\right)\]
Використовуючи рівняння Гіббса-Гельмгольца, отримаємо
\[{\left(\frac{\partial { \ln {\tilde{a}}_B\ }\left(\mathrm{solution},\ {\underline{m}}_A,T\right)}{\partial T}\right)}_{P,{\underline{m}}_A}\]
\[\ \ \ \ =\frac{-{\overline{H}}_B\left(\mathrm{solution},\ {\underline{m}}_A,T\right)}{RT^2}+\frac{{\tilde{H}}^o_B\left(T\right)}{RT^2}\]\[=\frac{-\left[{\overline{H}}_B\left(\mathrm{solution},\ {\underline{m}}_A,T\right)-{\overline{H}}^{\textrm{⦁}}_B\left(\mathrm{solid},T\right)\right]}{RT^2}\]
де ми маємо\({\tilde{H}}^o_B\left(T\right)={\overline{H}}^{\textrm{⦁}}_B\left(\mathrm{solid},T\right)\), тому що чисте тверде\(B\) тіло - це стандартний стан активності. Використовуючи ідеї, розроблені в розділі 14.14, ми можемо використовувати термохімічний цикл, показаний на малюнку 10, для оцінки
\[{\overline{H}}_B\left(\mathrm{solution},\ {\underline{m}}_A,T\right)-{\overline{H}}^{\textrm{⦁}}_B\left(\mathrm{solid},T\right)\]
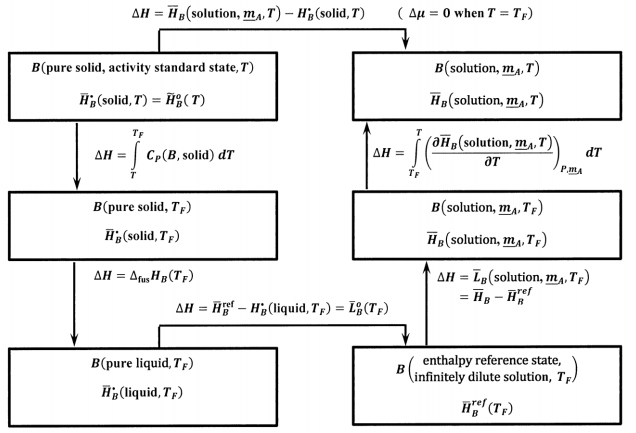
У цьому циклі\({\Delta }_{\mathrm{fus}}{\overline{H}}_B\left(T_F\right)\) відбувається молярна ентальпія плавлення чистого\(B\) при температурі плавлення,\(T_F\). \({\overline{L}}_B\left(\mathrm{solution},\ {\underline{m}}_A,T\right)\)відносна часткова молярна ентальпія\(B\) at\(T_F\) в розчині, склад якого визначається\({\underline{m}}_A\). Єдина нова кількість в цьому циклі
\[\int^T_{T_f}{{\left(\frac{\partial {\overline{H}}_B\left(\mathrm{solution},\ {\underline{m}}_A,T\right)}{\partial T}\right)}_{P,{\underline{m}}_A}dT}\]Ми можемо використовувати відносну часткову молярну ентальпію розчину, щоб знайти його. За визначенням,
\[{\overline{L}}_B\left(\mathrm{solution},\ {\underline{m}}_A,T\right)\]\[={\left(\frac{\partial H\left(\mathrm{solution},\ {\underline{m}}_A,T\right)}{\partial n_B}\right)}_{P,T,n_A}-{\overline{H}}^{\mathrm{ref}}_B\left(T\right)\]
або, скинувши інформацію в дужках,
\[{\overline{L}}_B={\overline{H}}_B-{\overline{H}}^{\mathrm{ref}}_B\left(T\right)\]
так що\[{\left(\frac{{\partial \overline{L}}_B}{\partial T}\right)}_P={\left(\frac{\partial {\overline{H}}_B}{\partial T}\right)}_P-{\left(\frac{\partial {\overline{H}}^{\mathrm{ref}}_B}{\partial T}\right)}_P\]
У Розділі 14.14 введемо відносну часткову молярну теплоємність,
\[{\overline{J}}_B\left(T\right)={\left(\frac{{\partial \overline{L}}_B}{\partial T}\right)}_P\]
Оскільки нескінченно розведений розчин є еталонним станом ентальпії для\(B\) розчину, ми очікуємо, що молярна ентальпія чистої рідини\(B\) буде хорошим наближенням до часткової молярної ентальпії рідини\(B\) в еталонному стані ентальпії. Тоді,\({\left({\partial {\overline{H}}^{\mathrm{ref}}_B}/{\partial T}\right)}_P\) це якраз молярна теплоємність чистої рідини\(B\),\(C_P\left(B,\mathrm{liquid},T\right)\). (Див. Проблема 16-11.) знаходимо
\[{\left(\frac{\partial {\overline{H}}_B}{\partial T}\right)}_P={\overline{J}}_B\left(T\right)+C_P\left(B,\mathrm{liquid},T\right)\]
Використовуючи цей результат, ентальпія змінюється навколо циклу на малюнку 10 вихід
\[{\overline{H}}_B\left(\mathrm{solution},\ {\underline{m}}_A,T\right)-{\overline{H}}^{\textrm{⦁}}_B\left(\mathrm{solid},T\right)\]
\[=\int^{T_F}_T{C_P\left(B,\mathrm{solid},T\right)}dT+{\Delta }_{\mathrm{fus}}{\overline{H}}_B\left(T_F\right)-L^o_B\left(T_F\right)+{\overline{L}}_B\left({\underline{m}}_A,T_F\right)+\int^T_{T_F}{\left[{\overline{J}}_B\left(T\right)+\mathrm{\ }C_P\left(B,\mathrm{liquid},T\right)\right]}dT\]
\[={\Delta }_{\mathrm{fus}}{\overline{H}}_B\left(T_F\right)+{\overline{L}}_B\left({\underline{m}}_A,T_F\right)-L^o_B\left(T_F\right)-\int^{T_F}_T{\left[C_P\left(B,\mathrm{liquid},T\right)-C_P\left(B,\mathrm{solid},T\right)+{\overline{J}}_B\right]}dT\]
Оскільки ми знаємо, як визначити\({\overline{J}}_B\) і теплові потужності як функції температури, ми можемо оцінити цей інтеграл, щоб отримати функцію температури. Для нинішніх цілей припустимо, що\({\overline{J}}_B\) і теплові потужності по суті постійні і введемо абревіатуру\(\Delta C_P=C_P\left(B,\mathrm{liquid},T\right)-C_P\left(B,\mathrm{solid},T\right)\), щоб\[\int^{T_F}_T{\left[C_P\left(B,\mathrm{liquid},T\right)-C_P\left(B,\mathrm{solid},T\right)+{\overline{J}}_B\right]}dT=\left(\Delta C_P+{\overline{J}}_B\right)\left(T_F-T\right)\]
Температурна похідна\({ \ln {\tilde{a}}_B\ }\left(\mathrm{solution},\ {\underline{m}}_A,T\right)\) стає
\[{\left(\frac{\partial { \ln {\tilde{a}}_B\ }\left(\mathrm{solution},\ {\underline{m}}_A,T\right)}{\partial T}\right)}_{P,{\underline{m}}_A}\]\[=\frac{-{\Delta }_{\mathrm{fus}}{\overline{H}}_B\left(T_F\right)-{\overline{L}}_B\left({\underline{m}}_A,T_F\right)+L^o_B\left(T_F\right)}{RT^2}+\frac{\left(\Delta C_P+{\overline{J}}_B\right)\left(T_F-T\right)}{RT^2}\]
\(T_{fp}\)- точка замерзання розчину, склад якого уточнюється по\({\underline{m}}_A\). При цьому\(T_{fp}\) розчинник в цьому розчині знаходиться в рівновазі з чистим твердим розчинником. Отже, хімічний потенціал розчинника розчину дорівнює потенціалу чисто-твердого розчинника. Потім, оскільки чиста тверда речовина є стандартним станом активності як для розчинника розчину, так і для чисто-твердого розчинника при\(T_{fp}\), активність розчинника розчину дорівнює активності розчинника чисто-твердого розчинника. Оскільки чиста тверда речовина є стандартним станом активності, активність розчинника є єдністю при\(T_{fp}\). Це означає, що ми можемо інтегрувати похідну від температури\(T_{fp}\)\(T_F\) до для отримання
\[\begin{aligned} \int^{T_F}_{T_{fp}} d ~ \ln \tilde{a}_B \left(\mathrm{solution},\ {\underline{m}}_A,T\right) & ~ \\ ~ & = \ln \tilde{a}_B \left(\mathrm{solution},\ {\underline{m}}_A,T_F\right) \\ ~ & = \left( \frac{\Delta _{\text{fus}} \overline{H}_B \left(T_F \right)+ \overline{L}_B \left( \underline{m}_A, T_F \right) +L^o_B\left(T_F\right)}{R} \right) \left(\frac{1}{T_F}-\frac{1}{T_{fp}}\right) -\left(\frac{\Delta C_P+ \overline{J}_B}{R}\right) \left(1-\frac{T_F}{T_{fp}}+ \ln \left(\frac{T_F}{T_{fp}} \right) \right) \end{aligned}\]
Таким чином, з виміряної температури замерзання розчину, склад якого заданий\({\underline{m}}_A\), можна обчислити активність розчинника в цьому розчині при\(T_F\).
Кілька особливостей цього результату заслуговують на згадку. Важливо пам'ятати, що ми отримали його, припускаючи, що\(\Delta C_P+{\overline{J}}_B\left(T\right)\) це константа. Це, як правило, гарне припущення. Експериментальні результати прийнято виражати як значення замерзаючої точки депресії,\(\Delta T=T_F-T_{fp}\). Рівняння активності стає
\[\begin{aligned} \ln \tilde{a}_B \left(\mathrm{solution}, \underline{m}_A,T_F\right) & ~ \\ ~ & =-\left(\frac{\Delta _{\mathrm{fus}} \overline{H}_B\left(T_F\right)+\overline{L}_B\left( \underline{m}_A,T_F\right)+L^o_B\left(T_F\right)}{RT_FT_{fp}}\right)\Delta T \\ ~ & +\left(\frac{\Delta C_P+{\overline{J}}_B}{R}\right)\left(\frac{\Delta T}{T_{fp}}-{ \ln \left(1+\frac{\Delta T}{T_{fp}}\right)\ }\right) \end{aligned}\]
Терміни\({\overline{L}}_B\), що включають\(L^o_B\)\(\Delta C_P\),, і часто\({\overline{J}}_B\) незначні, особливо коли концентрація розчиненої речовини низька. Коли\({T_F}/{T_{fp}\approx 1}\), тобто, коли депресія точки замерзання невелика, коефіцієнт\(\Delta C_P+{\overline{J}}_B\) дорівнює приблизно нулю. Коли ці наближення застосовуються, рівняння активності наближається
\[{ \ln {\tilde{a}}_B\ }\left(\mathrm{solution},\ {\underline{m}}_A,T_F\right)=-\left(\frac{{\Delta }_{\mathrm{fus}}{\overline{H}}_B\left(T_F\right)}{RT^2_F}\right)\Delta T\]
