16.12: Колігативні властивості - осмотичний тиск
- Page ID
- 21840
Явища підйому температури кипіння та депресії точки замерзання передбачають взаємозв'язок між складом і рівноважною температурою — при постійному тиску в системі. Тепер ми перейдемо до явища, осмотичного тиску, яке передбачає взаємозв'язок між складом і рівноважним тиском - при постійній температурі системи.
Для аналізу висоти точки кипіння прирівнюємо хімічний потенціал розчинника в двох підсистемах, розчині і газовій фазі над ним. Для аналізу депресії точки замерзання зрівняється хімічний потенціал розчинника в розчині та твердих підсистемах. Аналогічно, для аналізу осмотичного тиску ми прирівнюємо хімічний потенціал чистого розчинника - при одному тиску - до хімічного потенціалу розчинника в розчині - при другому тиску. Встановлено, що рівновагу можна отримати лише тоді, коли тиск в підсистемі розчину перевищує тиск в підсистемі розчинника. Різниця між цими двома тисками - осмотичний тиск.
У явищах піднесення точки кипіння та депресії точки замерзання підсистеми розділені фазовою межею. У явищі осмотичного тиску чиста фаза розчинника відокремлюється від фази розчину напівпроникною мембраною. Напівпроникна мембрана забезпечує вільний прохід молекулам розчинника; однак молекули розчинених речовин не можуть пройти через неї. На практиці напівпроникна мембрана - це матеріал, який пронизаний порами, або каналами, розміри поперечного перерізу яких майже такі ж малі, як і типові молекули розчинника. Молекули розчинника можуть дифузно крізь ці пори і переходити з одного боку мембрани на іншу. За допомогою такої мембрани ми можемо задовольнити умови осмотичного тиску, вибираючи розчинену речовину, молекули якої більше діаметрів пір, оскільки великі молекули не зможуть пройти через пори. На практиці розчиненою речовиною в експериментах з осмотичним тиском, як правило, є полімером або біологічно отриманою молекулою з високою молекулярною масою. Вимірювання осмотичного тиску були важливим джерелом даних про молярні маси таких речовин.
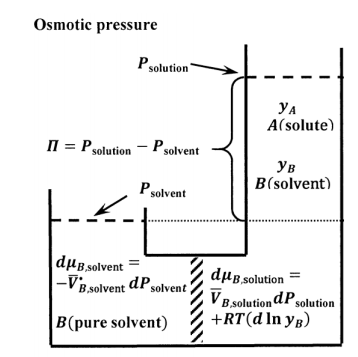
Експеримент з осмотичним тиском схематично описаний на малюнку 9. Напівпроникна мембрана повинна бути досить міцною, щоб підтримувати перепад тиску між двома підсистемами. При постійному тиску змішування двох підсистем є самовільним процесом. Якби ми видалили мембрану і падіння тиску, яке вона підтримує, підсистеми змішувалися б, утворюючи єдиний, більш розведений розчин. Тому ми бачимо, що існує тенденція чистої міграції молекул розчинника з боку розчинника мембрани на сторону розчину. Ми можемо протистояти цій тенденції, застосовуючи додатковий тиск на сторону розчину. Очевидно, що для будь-якого даного складу розчину буде застосований тиск, при якому підсистеми знаходяться в рівновазі один з одним.
Ми дозволяємо чисто-рідкому розчиннику при його рівноважному тиску пари бути стандартним станом як для чистої рідини, так і для розчинника фази розчинника (див. Розділ 16.2). Щоб дві підсистеми були в рівновазі, ми повинні мати\({\mu }_{B,\mathrm{soluton}}={\mu }_{B,\mathrm{solvent}}\). Для будь-якої зміни, яка приймає один стан рівноваги в інший, ми маємо\(d{\mu }_{B,\mathrm{soluton}}=d{\mu }_{B,\mathrm{solvent}}\). Так як підсистема чистого розчинника містить тільки\(B\), ми маємо\({\tilde{a}}_{B,\mathrm{so}\mathrm{lvent}}=\mathrm{constant}\) так, що\(d{ \ln {\tilde{a}}_{B,\mathrm{sol}\mathrm{vent}}\ }=0\). Так як температура постійна, у нас є\(dT=0\). Для підсистеми розчинника загальний вираз для\(\ d{\mu }_{B,\mathrm{solvent}}\) зводиться до
\[d{\mu }_{B,\mathrm{solvent}}={\overline{V}}^{\textrm{⦁}}_{B,\mathrm{solvent}}dP_{\mathrm{solvent}}\]
Для підсистеми рішення,\(dT=0\). Припускаючи, що розчинник у рішенні підпорядковується закону Раульта, ми маємо\({\tilde{a}}_{B,\mathrm{sol}\mathrm{ution}}=y_B\). Загальне рівняння для\(d{\mu }_{B,\mathrm{soluton}}\) зводиться до
\[d{\mu }_{B,\mathrm{soluton}}=\overline{V}_{B,\mathrm{solution}}dP_{\mathrm{solution}}+RT\left(d{ \ln y_B\ }\right)\]
\(d{ \ln y_B\ }\approx -dy_A\)Використовуючи, відносини\(d{\mu }_{B,\text{solution}}=d{\mu }_{B,\mathrm{solvent}}\) стають
\[{\overline{V}}_{B,\mathrm{solution}}dP_{\mathrm{solution}}-RTdy_A={\overline{V}}^{\textrm{⦁}}_{B,\mathrm{solvent}}dP_{\mathrm{solvent}}\]
Молярний об'єм рідини майже не залежить від тиску в системі. Оскільки розчин є майже чистим розчинником, молярний об'єм\(B\) у розчині приблизно дорівнює молярному об'єму чистого розчинника\(B\). \(\overline{V}_{B,\mathrm{solution}}=\overline{V}^{\textrm{⦁}}_{B,\mathrm{solvent}}={\overline{V}}^{\textrm{⦁}}_B\)Відпускаючи, це стає
\[dy_A=\left(\frac{\overline{V}^{\textrm{⦁}}_B}{RT}\right)\left(dP_{\mathrm{solution}}-dP_{\mathrm{solvent}}\right)=\left(\frac{\overline{V}^{\textrm{⦁}}_B}{RT}\right)\ d\left(P_{\mathrm{solution}}-P_{\mathrm{solvent}}\right)\]
Ця різниця тисків є осмотичним тиском; вона часто представлена грецьким алфавітом великої пі:\(\mathit{\Pi}=P_{\mathrm{solution}}-P_{\mathrm{solvent}}\). Осмотичний тиск чистого розчинника має дорівнювати нулю; тобто\(\mathit{\Pi}=0\) коли\(y_A=0\). Інтеграція між межами\(\left(0,0\right)\) і\(\left(y_A,\mathit{\Pi}\right)\), у нас є
\[\int^{y_A}_0{dy_A}=\frac{\overline{V}^{\textrm{⦁}}_B}{RT}\int^{\mathit{\Pi}}_0{d\mathit{\Pi}}\]
і
\[y_A=\frac{\overline{V}^{\textrm{⦁}}_B\mathit{\Pi}}{RT}\]
або
\[{\mathit{\Pi}\overline{V}}^{\textrm{⦁}}_B=y_ART\]
З цього рівняння ми бачимо, що осмотичний тиск має бути позитивним; тобто при рівновазі тиск на розчин має бути більше, ніж тиск на розчинник:\(\mathit{\Pi}=P_{\mathrm{solution}}-P_{\mathrm{solvent}}>0\).
Рівняння осмотичного тиску можна поставити в легко запам'ятовується форму. Для\(n_A\ll n_B\),\(y_A={n_A}/{\left(n_A+n_B\right)\approx {n_A}/{n_B}}\). При цьому заміщення\(\mathit{\Pi}\left(n_B{\overline{V}}^{\textrm{⦁}}_B\right)=n_ART\), але так як\({\overline{V}}^{\textrm{⦁}}_B\) є молярний обсяг чистого\(B\),\(V=n_B{\overline{V}}^{\textrm{⦁}}_B\) це якраз обсяг розчинника і по суті такий же, як і обсяг розчину. Рівняння осмотичного тиску має ту ж форму, що і ідеальне рівняння газу:
\[\mathit{\Pi}\left(n_B{\overline{V}}^{\textrm{⦁}}_B\right)=\mathit{\Pi}\ V=n_ART\]
