12.7: Фазові рівноваги - температурна залежність температури плавлення
- Page ID
- 22151
Ми також можемо представляти оборотні зміни шляхом на контурних картах. На малюнку 5 поверхня вільної енергії Гіббса представлена у вигляді контурної карти.
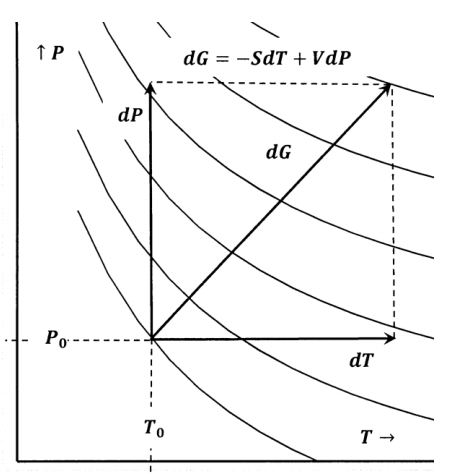
Для невеликих змін\(T\) і\(P\), ми можемо оцінити
\[dG=G\left(P_0+dP,T_0+dT\right)-G\left(P_0,T_0\right)\]
з
\[dG=-S\left(P_0,T_0\right)dT+V\left(P_0,T_0\right)dP\]
Для більших змін ми можемо інтегруватися вздовж шляхів\(P=P_0\) і\(T=T_0+\Delta T\) знайти
\[\Delta G=\int^{T_0+\Delta T}_{T_0}{-S\left(P_0,T\right)dT+}\int^{P_0+\Delta P}_{P_0}{V\left(P,T_0+\Delta T\right)dP}\]
Розрахунок\(\Delta S\) у розділі 12.5 може бути подібним чином представлений як шлях у площині температури - тиск, який з'єднує два контури постійної ентропії.
Аналіз рівноваги тверда та рідина рівноваги рідина—пара. Розглянемо ще раз рівновагу між льодом і водою. З огляду на, що лід і вода знаходяться в рівновазі при певній температурі і тиску, і припускаючи, що ми збільшуємо тиск від цього рівноваги значення, як повинна змінюватися температура для того, щоб система залишалася в рівновазі? У розділі 6.6 ми використовуємо принцип Ле Шательє, щоб якісно відповісти на це питання. Тепер ми знаходимо кількісну відповідь аргументом, який тісно паралельний тому, що в розділі 12.7.
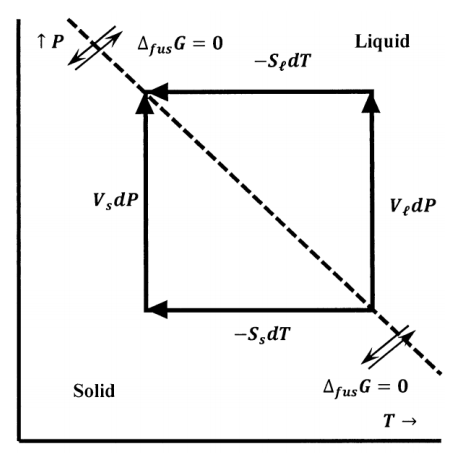
На малюнку 6 зображена лінія тисків і температур, по якій лід і вода знаходяться в рівновазі. Ми можемо розглядати це як контурну карту. При цьому контури являють\({\Delta }_{fus}\overline{G}\) собою набори тисків і температур, для яких постійна. Показаний тільки контур для\({\Delta }_{fus}\overline{G}=0\). На малюнку також зображені шляхи, по яких лід і вода можуть бути окремо взяті з їх рівноважного стану при\(P\) і\(T\) до їх рівноважного стану при\(P+dP\) і\(T+dT\). Зміна вільної енергії Гіббса для льоду повинна дорівнювати тому, що для води. Допускаючи\({\overline{G}}_{\ell }\)\({\overline{S}}_{\ell }\), і\({\overline{V}}_{\ell }\) бути вільною енергією Гіббса, ентропією і об'ємом одного моля води при температурі\(T\) і тиску\(P\), рівняння
\[d{\overline{G}}_{\ell }={\overline{V}}_{\ell }dP-{\overline{S}}_{\ell }dT\]
задає зміну вільної енергії Гіббса одного моля води при зміні тиску\(P\) на\(P+dP\) і зміні температури від\(T\) до\(T+dT\). Аналогічно, використовуючи індекс «s» для позначення льоду, ми маємо
\[d{\overline{G}}_s={\overline{V}}_sdP-{\overline{S}}_sdT\]
Оскільки ці зміни вільної енергії Гіббса пов'язують стани рівноваги льоду та води, вони повинні бути рівними, і ми маємо
\[d{\overline{G}}_{\ell }-d{\overline{G}}_s=\left({\overline{V}}_{\ell }-{\overline{V}}_s\right)dP-\left({\overline{S}}_{\ell }-{\overline{S}}_s\right)dT={\Delta }_{fus}\overline{V}dP-{\Delta }_{fus}\overline{S}dT=0\]
де ми вводимо\({\Delta }_{fus}\overline{S}\) і\({\Delta }_{fus}\overline{V}\) представляємо ентропію і зміни обсягу, які відбуваються, коли один моль льоду тане оборотно при\(P\) і\(T\). Перестановка дає
\[\frac{dP}{dT}=\frac{\Delta_{fus}\overline{S}}{\Delta_{fus}\overline{V}}\]
Так як
\[\Delta_{fus}\overline{S}={\Delta_{fus}\overline{H}}/{T},\]
рівняння Клапейрона стає
\[\frac{dP}{dT}=\frac{\Delta_{fus}\overline{H}}{T\ {\Delta }_{fus}\overline{V}}\]
При тиску в один бар і температурі 273,15 К відбувається ентальпія плавлення\(\mathrm{6010}\ \mathrm{J}\ {\mathrm{mol}}^{\mathrm{-1}}\ {\mathrm{K}}^{-1}\). Значення ентальпії змінюється лише повільно в міру зміни рівноважної температури. Обсяги одного моля льоду і одного моля води складають 19,651 і 18.019\({\mathrm{cm}}^3\) відповідно. При 273,15 К отримуємо
\[\frac{dP}{dT}=-143.7\ \mathrm{bar}\ {\mathrm{K}}^{-1}\]
Якщо тиск збільшується до 1000 бар, зміна температури плавлення становить приблизно -6,96 К, так що\(T_{mp}\left(1000\ \mathrm{bar}\right)=266.2\ \mathrm{K}\).
Знову ж таки, цей аналіз є успішним, оскільки складові є чистими фазами; властивості льоду не залежать від кількості води, і навпаки. Коли ми аналізуємо рівновагу між льодом і солоною водою, властивості солоної води залежать від виду присутньої солі та від її концентрації.
