12.6: Фазові рівноваги - температурна залежність температури кипіння
- Page ID
- 22146
У розділах 12.4 та 12.6 ми досліджуємо два підходи до використання критерію спонтанної зміни на основі ентропії. Обговорюючи танення льоду при\(\mathrm{+10}\) С, ми обчислюємо зміни ентропії як для системи, так і для оточення\(\Delta S_{universe}>0\), щоб показати це, як другий закон вимагає для спонтанного процесу. Обговорюючи залежність температури кипіння рідини від тиску в розділі 12.6, ми пов'язуємо другий критерій закону спонтанної зміни з принципом Ле Шательє. Перейдемо тепер до вказівки тиску і температур, при яких дві фази чистої речовини знаходяться в рівновазі. Коли ми вибираємо тиск і температуру як незалежні змінні, критерії вільної енергії Гіббса визначають стан рівноваги і напрямок спонтанної зміни.
Для оборотного процесу, в якому вся робота тиску - об'ємна робота і в якому тиск і температура змінюються на\(dP\) і\(dT\), зміна вільної енергії Гіббса є\(dG=VdP-SdT\). Давайте застосуємо цей зв'язок до проблеми рівноваги рідина-пара, яку ми обговорюємо в розділі 12.6. Для цього ми розглядаємо процес з дещо іншої точки зору. Ми припускаємо, що у нас дві системи. Вони ідентичні початковому і кінцевому станів системи в нашому обговоренні вище. Одна з таких систем знаходиться в рівновазі рідина-пара при певному тиску і температурі,\(\ T\).\(P\) Інший знаходиться в рівновазі рідина-пара при\(P+dP\) і\(T+dT\). Розглянуто зміну вільної енергії Гіббса моля речовини, оскільки вона оборотно проходить цикл, намальований на малюнку 4.
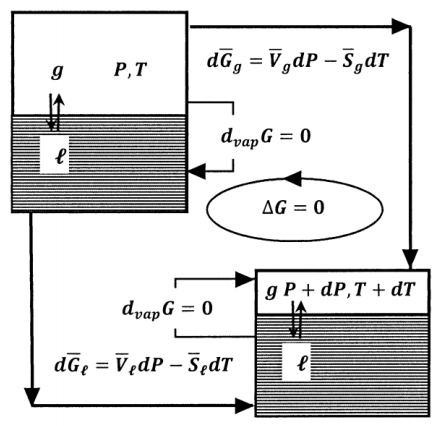
Тиск і температура постійні в кожному з двох рівноважних станів. У будь-якому з цих рівноважних станів вільна енергія Гіббса не змінюється, коли моль рідини перетворюється в її газ,\({\Delta }_{vap}G\left(P,T\right)=0\) і\({\Delta }_{vap}G\left(P+dP,T+dP\right)=0\). Коли тиск і температура одного моля рідини змінюються від\(P\) і\(T\) до\(P+dP\) і\(T+dT\), змінюється вільна енергія Гіббса\(d\overline{G}\left(\ell \right)=\overline{V}_{\ell }dP- \overline{S}_{\ell }dT\). Для моля газу ця зміна тиску і температури змінює вільну енергію Гіббса на\(d\overline{G}\left(g\right)= \overline{V}_gdP- \overline{S}_gdT\). (\(\overline{V}_{\ell }\),\(\overline{V}_g\),\(\overline{S}_{\ell }\), і\(\overline{S}_g\) оцінюються в\(P\) і\(T\). Однак, оскільки\(dP\) і\(dT\) невеликі, ці величини по суті є постійними в діапазонах тиску та температури, що беруть участь.) Для окремих кроків у цьому циклі ми маємо
\[\left(\ell ,\ P,\ T\right)\to \left(\ell ,\ P+dP,\ T+dT\right) d\overline{G}\left(\ell \right)=\overline{V}_{\ell }dP- \overline{S}_{\ell }dT\]
\[\left(\ell ,\ P+dP,\ T+dT\right)\to \left(g,\ P+dP,\ T+dT\right) {\Delta }_{vap}G\left(P+dP,T+dT\right)=0\]
\[\left(g,\ P+dP,\ T+dT\right)\to \left(g,\ P,\ T\right) -d\overline{G}\left(g\right)=-\left(\overline{V}_gdP- \overline{S}_gdT\right)\]
\[\left(g,\ P,\ T\right)\to \left(\ell ,\ P,\ T\right) -{\Delta }_{vap}G\left(P,T\right)=0\]
Так як вільна енергія Гіббса є функцією стану, то сума цих членів дорівнює нулю. У нас є
\[{\Delta }_{vap}G\left(P+dP,T+dT\right)-{\Delta }_{vap}G\left(P,T\right) +d\overline{G}\left(\ell \right)-d\overline{G}\left(g\right) =d\overline{G}\left(\ell \right) -d\overline{G}\left(g\right) =0\]
так що\(d\overline{G}\left(\ell \right)=d\overline{G}\left(g\right)\). Тобто вільна енергія Гіббса рідини змінюється на ту ж кількість, що і вільна енергія Гіббса газу, коли моль будь-якого береться з одного стану рівноваги рідина-пара в інший. Підставляючи, ми знаходимо умову, що зміни тиску та температури повинні задовольняти, коли система переходить з рівноваги рідина—пара\(\left(P,T\right)\) в стан рівноваги рідина—пара при\(\left(P+dP,T+dT\right)\):
\[\left( \overline{V}_g- \overline{V}_{\ell }\right)dP-\left(\overline{S}_g-\overline{S}_{\ell }\right)dT=0\]
Допускаємо\({\Delta }_{vap}\overline{V}= \overline{V}_g- \overline{V}_{\ell }\) і\({\Delta }_{vap}\overline{S}=\overline{S}_g-\overline{S}_{\ell }\), де\({\Delta }_{vap}\overline{V}\) і\({\Delta }_{vap}\overline{S}\) знаходяться зміни обсягу і ентропії, які супроводжують випаровування одного моля рідини при\(P\) і\(T\). \({\Delta }_{vap}\overline{V}\)і\({\Delta }_{vap}\overline{S}\) є по суті постійними в малих діапазонах тиску та температури. Підставляючи, у нас є\({\Delta }_{vap}\overline{V}dP-{\Delta }_{vap}\overline{S}dT=0\), які ми можемо переставити, щоб дати
\[\frac{dP}{dT}=\frac{\Delta _{vap}\overline{S}}{\Delta _{vap}\overline{V}}\]
Оскільки один моль рідини оборотно випаровується при\(P\) і\(T\), система приймає тепло\(q^{rev}_P=\Delta _{vap}\overline{H}\). Значить, ентропія випаровування при\(P\) і\(T\) є\({\Delta }_{vap}\overline{S}={\Delta }_{vap}\overline{H}/T\), і взаємозв'язок між\(dP\) і\(dT\) стає
\[\frac{dP}{dT}=\frac{\Delta _{vap}\overline{H}}{T \Delta _{vap}\overline{V}}\]
Нижче ми бачимо, що такий зв'язок тримається для будь-якої рівноваги між двома чистими фазами. Загальний зв'язок називається рівнянням Клапейрона.
Цей аналіз є успішним, оскільки складові є чистими фазами; властивості рідини не залежать від кількості пари, і навпаки. Коли ми аналізуємо рівновагу між рідким розчином і газом компонентів розчину, проблема є більш складною, оскільки властивості фаз залежать від їх складів.
