4.2:\(\mathrm{S}_{\mathrm{N}} 1\) Reaction
- Page ID
- 25209
Якщо ви вже пройшли лабораторний курс хімії, ви без сумніву помітили, що ви не отримуєте 100% виходу на ту чи іншу реакцію і часто утворюється більше одного продукту. Це не (як правило) випадок несправної експериментальної техніки, а скоріше відображає складність реакційних систем. Враховуючи наш досвід використання доказів для підтримки запропонованих механізмів реакції, давайте поглянемо на інший набір умов для нуклеофільних заміщень. Розглянемо реакцію:
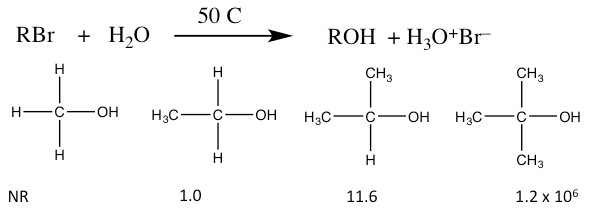
Відносні швидкості\(\mathrm{S}_{\mathrm{N}} 1\) реакцій
У цьому сценарії вода є і нуклеофілом, і розчинником. Вода не дуже сильний нуклеофіл і є протонним розчинником. У цих умовах відбувається нуклеофільна заміщення, але ця реакція відрізняється декількома емпірично спостережуваними способами від\(\mathrm{S}_{\mathrm{N}} 2\) реакцій, розглянутих раніше.
- Швидкість реакції залежить тільки від субстрату. Реактивність нуклеофіла не має значення. Рівняння швидкості для цих реакцій:\(\text { rate }=k[\mathrm{RBr}]\). Реакція першого порядку, і тому називається\(\mathrm{S}_{\mathrm{N}} 1\) реакцією (Заміна, Нуклеофільна, Перший порядок).
- Відносні швидкості реакції для субстратів зворотні від\(\mathrm{S}_{\mathrm{N}} 2\) реакції. Тобто швидкість реакції вище для третинної і найнижча для первинної форми.
- Коли хіральний центр зазнає\(\mathrm{S}_{\mathrm{N}} 1\) реакції, продукт містить суміш обох можливих енантіомерів, а не інверсії конфігурації, знайденої з\(\mathrm{S}_{\mathrm{N}} 2\) реакціями..
- Реакція прискорюється полярними протонними розчинниками (які уповільнюють\(\mathrm{S}_{\mathrm{N}} 2\) реакції).
Як ми можемо пояснити цю поведінку? Наше припущення полягає в тому, що задіяний інший механізм реакції; порівняно з\(\mathrm{S}_{\mathrm{N}} 2\) реакціями, які ми розглядали. Яким може бути цей механізм?
Враховуючи, що спостережувана швидкість реакції залежить тільки від концентрації субстрату (1), можна припустити, що в стадії визначення швидкості бере участь тільки молекула субстрату. Так як же починається реакція? Треба припустити, що реакція передбачає розрив зв'язку (оскільки немає нічого іншого, що може статися, якщо на етапі визначення швидкості є лише одна молекула. Оскільки розрив зв'язку вимагає енергії, теплові зіткнення з молекулами розчинника повинні керувати цією подією розриву зв'язку. Однак ми також знаємо, що молекула розчинника не бере участі в цьому етапі реакції (тому що вона відсутня в законі норми). Однією з можливостей є те, що зв'язок з виїзною групою розривається, в результаті чого отримується позитивно заряджений вуглець (карбокатіон) та аніон, що виходить групи\(\rightarrow\). Це перший приклад, який ми бачили карбокатіону. Освіта цього карбокатіона вимагає енергії (оскільки зв'язок розривається), і ми можемо зробити висновок, що він має високу енергію активації. Карбокатіони самі по собі є високоенергетичними видами, які дуже реактивні. Однак вони відрізняються від перехідних станів тим, що можна генерувати та виявляти карбокацію - вона зазвичай має короткий термін служби - але ми можемо виявити її присутність спектроскопічними методами. Це відрізняється від перехідного стану, який є найвищою енергією виду за профілем енергії реакції. Перехідні стани існують лише для однієї молекулярної вібрації і мають тривалість життя на порядку фемтосекунд.

Можна очікувати, що така карбокація швидко реагує з будь-яким потенційним присутнім нуклеофілом, який в даному випадку є молекулою води розчинника.
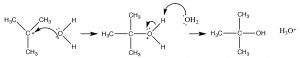
Хоча вода є поганим нуклеофілом, вона буде реагувати з високореактивним карбокатом, щоб надати проміжну протоновану форму. Далі відбувається перенесення протона в іншу молекулу води (розчинника) для утворення кінцевого продукту.
Такий механізм задовольняє наші експериментальні спостереження. Він має повільний (обмеження швидкості, висока активація, енергія вимагає) перший крок, і більш швидкий (менша енергія активації) другий крок. Через відмінності енергій активації двох ступенів, тільки перший крок бере участь у визначенні загальної швидкості реакції. Щоб з'ясувати, який крок визначення швидкості ми можемо побачити, що\(\Delta \mathrm{G}^{\dagger}\) для кроку 1 більше, ніж\(\Delta \mathrm{G}^{\dagger}\) для кроку 2.
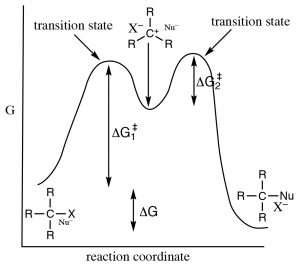
Чому структура субстрату має значення?
Освіта проміжного карбокатіона є швидковизначальним етапом в такій реакції, а тому з цього випливає, що структура карбокатіона впливає на енергію активації реакції, а значить і на її швидкість. Чим стабільніше карбокатіон, тим нижче енергія перехідного стану, що веде до карбокатіону. [3] Фактори, що стабілізують карбокацію, також стабілізують перехідний стан і знизять енергію активації.
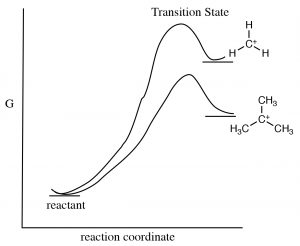
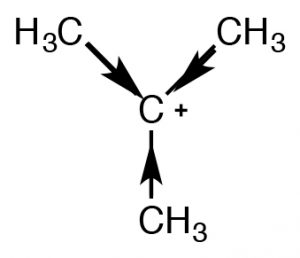
Є два механізми, які можуть стабілізувати карбокати, і обидва передбачають, що, як кількість алкільних груп, прикріплених до\(\mathrm{C+}\) збільшення, буде і його стабільність. Один механізм, з яким ми вже стикалися, - індукційний. Алкільні групи, прикріплені до центрального вуглецю, поляризуються, і їх електронна щільність притягується до позитивного заряду центрального вуглецю, таким чином делокалізуючи позитивний заряд над алкільними групами. Чим більше алкільних груп прикріплено до центрального вуглецю, тим більш виражена ця стабілізація. Другий механізм, відомий як гіперкон'югація, також делокалізує позитивний заряд. При гіперкон'югації електронна щільність з будь-якого сусіднього\(\mathrm{C-H}\) або\(\mathrm{C-C}\) зв'язку може перекриватися з порожньою орбіталою р на\(\mathrm{sp}^{2}\) гібридизованому карбокатіоні, утворюючи свого роду pi зв'язок і, знову ж таки, делокалізуючи позитивний заряд над іншою частиною молекули. Чим більше алкільних груп присутній (додається до\(\mathrm{C+}\)), тим більш вираженим буде цей ефект.
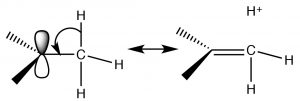
Разом як індукція, так і гіперкон'югація пояснюють, чому\(\mathrm{S}_{\mathrm{N}} 1\) реакція протікає швидше з третинними субстратами. Третинний карбокат є більш стабільним (щодо вторинних та первинних карбокатіонів), так що реакція має меншу енергію активації.
Чому хіральні центри рацемізуються?
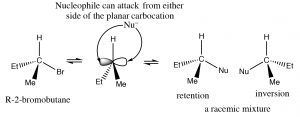
Відповідь на це питання криється в будові карбокатіона. Являє собою плоску,\(\mathrm{sp}^{2}\) гібридизовану, симетричну структуру. Після утворення він може бути атакований з обох сторін нуклеофілом; в простих сполуках, на якій стороні карбокація буде атакована, включає випадкову подію зіткнення, даючи суміш енантіомерів.
Чому\(\mathrm{S}_{\mathrm{N}} 1\) реакції прискорюються полярними протонними розчинниками?
Пам'ятайте, що полярний протичний розчинник (такий вода або етанол) містить диполь: частково позитивний і частково негативний домен.
Атака в хіральному центрі дає рацемическую суміш продуктів.
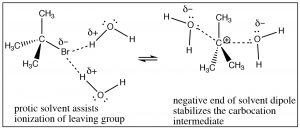
Цей диполь молекули розчинника виконує дві функції: він може сольватувати залишаючу групу, фактично допомагаючи видалити її з карбокатіону через взаємодію з позитивним кінцем розчинника диполь, і він може сольватувати карбокацію через взаємодію з негативним доменом диполя розчинника. По суті, розчинник сприяє іонізації покидає групи, і він знижує енергію проміжного карбокатіону.
\(\mathrm{S}_{\mathrm{N}} 1\)реакції в резонансно-стабілізованих системах:
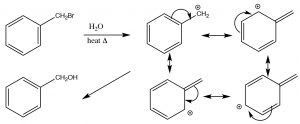
Як ми бачили,\(\mathrm{S}_{\mathrm{N}} 1\) реакції, як правило, виникають, коли може утворюватися стабілізований проміжний проміжний продукт карбокату. Крім розглянутих раніше третинних катіонів, які стабілізуються індукцією та гіперкон'югацією, бувають також випадки, коли навіть первинні карбокати можуть утворюватися, якщо є спосіб їх стабілізувати. Наприклад, будь-який первинний вуглець, який може бути сполучений з системою пі, може бути стабілізований резонансом. Наприклад, бензиловий (тобто будь-який вуглець, прикріплений до бензольного кільця) карбокатіон може бути стабілізований шляхом делокалізації позитивного заряду в бензольне кільце. Це знижує енергію активації реакції і робить можливою\(\mathrm{S}_{\mathrm{N}} 1\) реакцію.
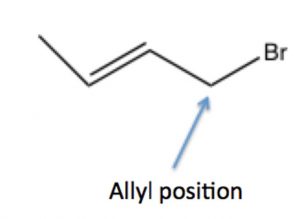
Подібне явище може статися в субстратах з виходом груп в алілічному положенні: тобто на вуглеці поруч з подвійним зв'язком, де отриманий карбокат може бути резонансом стабілізований шляхом делокалізації на pi систему подвійного зв'язку. Більш докладно про це явище ми поговоримо далі (в розділі\(7\)).
\(\mathrm{S}_{\mathrm{N}} 1\)або\(\mathrm{S}_{\mathrm{N}} 2\)?
Перш ніж рухатися далі, давайте переглянемо те, що ми знаємо про\(\mathrm{S}_{\mathrm{N}} 1\) та\(\mathrm{S}_{\mathrm{N}} 2\) реакції. Хоча це може здатися трохи заплутаним, існує ряд факторів, які можуть допомогти нам передбачити, яким може бути потенційний механізм реакції, а також передбачити продукт. Коли ми рухаємось до більш складних реакційних систем, важливо пам'ятати, що, як правило, існує більше одного шляху, який може пройти реакція, але, розуміючи, як відбуваються реакції, ми можемо налаштувати умови, щоб продукт, який ми хочемо, був основним продуктом. Наведена нижче таблиця узагальнює те, що ми обговорювали досі стосовно\(\mathrm{S}_{\mathrm{N}} 1\) та\(\mathrm{S}_{\mathrm{N}} 2\) реакцій.
| \(\mathrm{S}_{\mathrm{N}} 1\) | \(\mathrm{S}_{\mathrm{N}} 2\) | |
|---|---|---|
| Субстрат | \ (\ mathrm {S} _ {\ mathrm {N}} 1\)» style="висота: 14px; ">третинний > вторинний> бензиловий ~ алліловий
> первинний > метил |
\ (\ mathrm {S} _ {\ mathrm {N}} 2\)» стиль = «висота: 14px;" > метил> первинний> вторинний> третинний |
| Вихід з групи | \ (\ mathrm {S} _ {\ mathrm {N}} 1\)» style="height:15px; ">Хороші залишкові групи збільшують швидкість за рахунок зниження енергії TS | \ (\ mathrm {S} _ {\ mathrm {N}} 2\)» style="height:15px; ">Хороші залишкові групи збільшують швидкість за рахунок зниження енергії TS Прискорений сильними нуклеофілами |
| Нуклеофіл | \ (\ mathrm {S} _ {\ mathrm {N}} 1\)» style="висота: 15px; ">Не-( Bronsted) основні нуклеофіли, слабкі нуклеофіли (сильні основи сприяють елімінації-див. наступний розділ) | \ (\ mathrm {S} _ {\ mathrm {N}} 2\)» стиль = "висота: 15px; "> |
| Розчинник | \ (\ mathrm {S} _ {\ mathrm {N}} 1\)» style="height:15px; ">Полярний (розчиняє вуглецювання) протик (допомагає зняти групу, що залишає і вирішує її. | \ (\ mathrm {S} _ {\ mathrm {N}} 2\)» style="height:15px; ">Полярна апротика - вирішує катіон, залишаючи нуклеофіл нерозчиненим і більш реактивним. |
| Стереохімія | \ (\ mathrm {S} _ {\ mathrm {N}} 1\)» style="height:15px; ">Рацемізація є результатом атаки з обох боків планарної карбокації | \ (\ mathrm {S} _ {\ mathrm {N}} 2\)» style="height:15px; ">Інверсія конфігурації реакції відбувається в хіральному центрі |
На практиці третинні субстрати проходять лише,\(\mathrm{S}_{\mathrm{N}} 1\) а метил та первинний лише проходять\(\mathrm{S}_{\mathrm{N}} 2\), саме вторинні субстрати полягають у неоднозначності, і для цього ми повинні враховувати інші фактори, такі як міцність розчинника та нуклеофілів. Однак реакції, що генерують карбокати, можуть також пройти інші шляхи реакції, крім заміщення.
