2.5: Вуглець-13 ЯМР-спектроскопія
- Page ID
- 25061
Почнемо з розгляду використання спектроскопії\(\mathrm{C-} 13\) ЯМР, оскільки вона може забезпечити найпростіший тип спектру ЯМР. \(\mathrm{C-} 13\)є незначним ізотопом вуглецю, як правило\(\sim 1 \%\), ядер вуглецю, присутніх у зразку є\(\mathrm{C-} 13\) (більшість є\(\mathrm{C-} 12\) і дуже малий відсоток (менше 1 на мільйон\(\mathrm{C-} 14\)). У\(\mathrm{C-} 13\) спектрі кожен хімічно різний атом вуглецю призведе до сигналу або піку в спектрі. Хімічно різні, ми маємо на увазі, що вуглеці знаходяться в різних середовищах; ці середовища впливають на місцеве магнітне поле, яке буде відчувати певне ядро. Так, наприклад, хоча етан\(\mathrm{CH}_{3} \mathrm{CH}_{3}\) (очевидно) має два вуглеці, через симетрію молекули обидва ядра вуглецю відчувають однакове хімічне (і місцеве магнітне) середовище; ми очікуємо, що етан покаже єдиний пік\(\mathrm{C-} 13\) ЯМР.
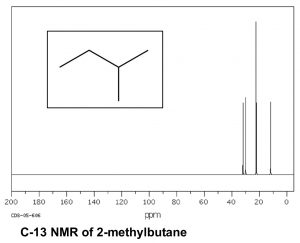
Тепер розглянемо більш складний вуглеводень, такий як 2-метилбутан (\(\beta\)), який має загалом п'ять вуглеців; з них\(\mathrm{C}1\) і\(\mathrm{C}2\) метилові вуглеці знаходяться в однакових хімічних середовищах. Молекула в цілому має чотири різних середовища, і тому в її спектрі\(\mathrm{C-} 13\) ЯМР є 4 піки.
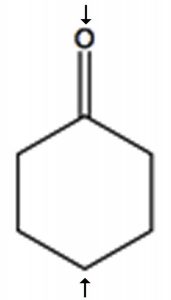
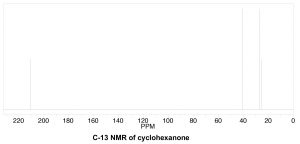
Щоб визначити кількість хімічно різних вуглеців, які присутні всередині молекули, потрібно подивитися на закономірності зв'язків всередині молекули, тобто те, з чим пов'язаний кожен вуглець. Одним з швидких способів перевірки ідентичних хімічних середовищ є пошук площин (або осей) симетрії в молекулі (ігноруючи обертання навколо\(\mathrm{C-C}\) одиночних зв'язків). Наприклад, циклогексанон (\ (\ rightarrow) має єдину вісь симетрії (позначену стрілками); результат полягає в тому, що молекула має лише 4 хімічно різних вуглецю, як показано в спектрі нижче. Тепер потрібно відповісти на питання про те, чому ці сигнали з'являються в різних місцях спектра.
Хімічний зсув
Оскільки інструменти ЯМР можуть мати різну напруженість поля, спектри ЯМР часто повідомляються з посиланням на стандартний матеріал: тетраметилсилан (TMS). ТМС має чотиригранну симетрію, тому всі вуглеці в молекулі мають ідентичне хімічне (місцеве магнітне) середовище. Тому ми можемо впевнено передбачити, що спектри\(\mathrm{C-} 13\) ЯМР для TMS мають один пік. Хімічний зсув (в\(\mathrm{ppm}\)) = зсув від частоти ТМС/загальної спектрометра. Використовуючи такий підхід, хімічний зсув не залежить від типу використовуваного інструменту. Для\(\mathrm{C-} 13\) ЯМР хімічні зрушення зазвичай варіюються від приблизно\(220\) до 0. Позначення\(0\) є де TMS насправді з'явиться, хоча цей сигнал часто видаляється зі спектру для чіткості (як у двох попередніх спектрах). Однак, якщо ви бачите спектри з піком на 0 ppm, це майже напевно пов'язано зі стандартом TMS і не повинно використовуватися при визначенні структури.
Екранування та знешкодження
Відповісти на питання про те, чому сигнали ЯМР з'являються в різних місцях, спочатку згадавши, що ми маємо справу не з ізольованими ядрами, а з молекулами, які складаються з ядерних ядер, оточених електронами, які можна охарактеризувати як займають різні молекулярні орбіталі. Електронна щільність навколо ядра має помітний вплив на локальне магнітне поле - тобто магнітне поле, яке «відчувається» кожним ядром. Електрони також «відчувають» дію магнітного поля і починають циркулювати навколо ядер, щоб викликати нове магнітне поле, яке протистоїть вихідному. Цей загальний вплив цього полягає в зменшенні ефективного ядерного поля, як показано на малюнку нижче. Тепер потрібно сильніше зовнішнє поле, щоб привести ядро до резонансу на тій же частоті (перевернути ядерний спін).
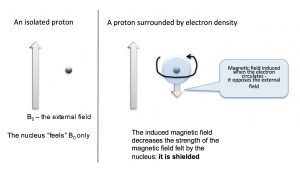
Ядра, які оточені більшою кількістю електронної щільності, як кажуть, екрановані; вони вимагають більшого магнітного поля, щоб привести до обертання фліп, ніж ядра, які деекрановані (тобто оточені меншою щільністю електронів). Поглинання екранованими ядрами, як правило, вище («вище поля») у спектрі, а деекрановані ядра з'являються вниз. Розглянемо для прикладу спектр\(\mathrm{C-} 13\) ЯМР 1-хлорпропану.
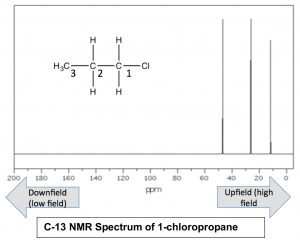
Як ми могли очікувати, в спектрі є 3 піки, але тепер ми можемо з'ясувати, що є, тому що ми можемо передбачити відносну щільність заряду на кожному вуглеці. Вуглець, прикріплений до хлору (\(\mathrm{C-} 1\)), найбільш деекранований індуктивним ефектом, і тому повинен з'являтися в найнижчому полі. Дійсно сигнал навколо\(47 \mathrm{ ppm}\) належить до\(\mathrm{C-} 1\). Ми також можемо побачити, як індуктивний ефект розсіюється з відстанню від групи відведення електронів до\(\mathrm{C-} 3\) сигналу навколо\(11 \mathrm{ ppm}\). Це є прямим доказом індуктивного ефекту відведення електронів.
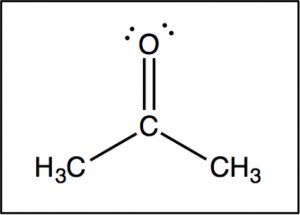
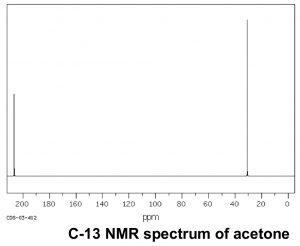
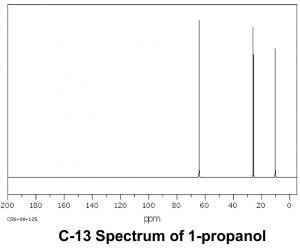
Тепер порівняємо цей спектр з спектром ацетону. Як ми могли б передбачити, цей спектр має лише два піки в ньому, оскільки ацетон має лише два типи вуглецю, але ще цікавіше те, що\(\mathrm{C=O}\) вуглець з'являється на такому низькому полі, навколо\(205 \mathrm{ ppm}\). Це означає, що\(\mathrm{C=O}\) вуглець повинен бути дуже дефіцитом електронів - набагато більше, ніж вуглець, однозв'язаний з киснем (\(\mathrm{C-O}\)) у спирті, який з'являється навколо\(64 \mathrm{ ppm}\) (як показано в спектрі 1-пропанолу). Це прямий доказ явища, яке ми будемо бачити знову і знову, а саме те, що\(\mathrm{C=O}\) вуглець сильно дефіцит електронів і дуже сприйнятливий до нуклеофільної атаки. Зверніть увагу, що спектр ацетону також показує цей високо зсунутий пік, відповідний\(\mathrm{C=O}\) вуглецю.