2.6: Н-1 (протон) ЯМР
- Page ID
- 25082
Хоча\(\mathrm{C-} 13\) ЯМР надає інформацію про те, скільки хімічно різних вуглеців є в сполуці, і щось про їх електронних середовищах, він нічого не говорить нам про те, як організовані молекули або які вуглеці пов'язані разом. [18] Для цієї інформації ми часто звертаємося до ЯМР-спектроскопії з використанням\(\mathrm{H-} 1\) ізотопу. Є ряд переваг\(\mathrm{H-} 1\) ЯМР:\(\mathrm{H-} 1\) є природним, найбільш багатим ізотопом водню, і набагато більш рясний ніж\(\mathrm{C-} 13\). Результатом є те, що концентрація\(\mathrm{H-} 1\) в пробі набагато більше, ніж концентрація\(\mathrm{C-} 13\). Тому легше отримати спектр, і можна використовувати прилади з нижчим полем. Як ми побачимо,\(\mathrm{H-} 1\) ЯМР може надати інформацію про те, які атоми пов'язані один з одним. З іншого боку, отримані\(\mathrm{H-} 1\) ЯМР спектри є більш складними.
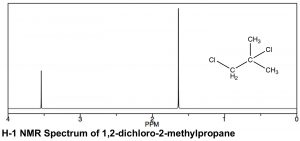
Основні теорії обох\(\mathrm{H-} 1\) і\(\mathrm{C-} 13\) ЯМР однакові і, по суті, обидва спектри можуть бути записані на одному приладі. Зразок поміщається в магнітне поле, яке розщеплює спінові стани\(\mathrm{H-} 1\) ядер; виявляється енергія, необхідна для перетворення ядер з одного спінового стану в інший, і перетворюється в спектр, такий як наведена нижче.
Є подібності і відмінності в зовнішньому вигляді\(\mathrm{H-} 1\) і\(\mathrm{C-} 13\) ЯМР спектрів. Як видно в спектрі 1,2-дихлор-2-метилпропану (\(\leftarrow\)), шкали, над якими реєструються спектри, різні. Обидва передбачають хімічний зсув від еталонного піку при 0, (TMS [тетраметилсилан] використовується в обох), але діапазон зсуву (часто згадується як\(\delta\)\(\mathrm{ppm}\), а також у протонному ЯМР) менший\(\mathrm{H-} 1\) порівняно з\(\mathrm{C-} 13\) ЯМР. Зазвичай спектр\(\mathrm{H-} 1\) ЯМР записується між\(0-10 \mathrm{ ppm}\) (на відміну від\(0-200\) for\(\mathrm{C-} 13\)), хоча в цьому випадку він усічений, оскільки між ними немає піків\(4–10 \mathrm{ ppm}\). Тим не менш, спостерігаються ті ж тенденції в хімічних зрушеннях: чим більше деекрановані атоми (в даному випадку протони), тим далі вони з'являються вниз. У спектрі 1,2-дихлор-2-метилпропану вище є два піки, відповідні двом типам хімічно відмінних воднів (тобто двох однакових\(-\mathrm{CH}_{3}\) і\(\mathrm{-CH}_{2}\) групи). Найнижче поле піку, навколо,\(3.6 \mathrm{ ppm}\) може бути віднесено до\(\mathrm{CH}_{2}\) (метиленової) групи, яка безпосередньо приєднується до електрону, що виводить атом хлору, тоді як другий пік, відповідний шести еквівалентним водням двох метильних груп, знаходиться далі вгору, навколо\(1.6 \mathrm{ ppm}\).
У протонному спектрі ЯМР площа під піком пропорційна кількості протонів, які породжують сигнал. Інтегруючи область під піком, ми генеруємо оцінку відносних чисел воднів, що породжують кожен сигнал. У спектрі 1,2-дихлор-2-метилпропану співвідношення двох пікових областей становить 1:3, тим самим підтримуючи наше призначення піку нижнього поля до піку\(\mathrm{CH}_{2}\) та піку верхнього поля до двох еквівалентних\(-\mathrm{CH}_{3}\) (шести) метилводнів. Як технічна примітка, сигнали\(\mathrm{C-} 13\) ЯМР не є надійно пропорційними кількості еквівалентних вуглецю, що беруть участь: вони залежать від кількості\(\mathrm{H}\) прикріплених до них, і тому інтеграція не може забезпечити достовірну оцінку пропорцій типів вуглецю в сполуці. [19]
Спін Спін Розщеплення
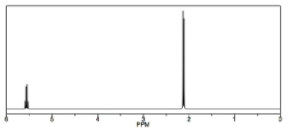
Інший спосіб, яким\(\mathrm{H-} 1\) ЯМР відрізняється від\(\mathrm{C-} 13\) ЯМР, показаний в спектрі 1,1-дихлоретан\(\rightarrow\), який має два типи еквівалентних воднів. Кожен тип породжує чіткий сигнал, але кожен з цих сигналів розділений на кілька піків. Сигнал вище поля навколо\(2 \mathrm{ ppm}\), від 3\(\mathrm{H}\) еквівалентів метильної групи, з'являється як дуплет (два окремі піки), оскільки кожен з водню в метильній групі впливає магнітне поле, що генерується можливим спіновим станом сусіднього водню, тим самим змінюючи (додавання до або віднімаючи з) локальне поле атомів. Сигнал нижнього поля навколо\(5.5 \mathrm{ ppm}\) обумовлений одним протоном\(\mathrm{C-} 1\), деекранованим через близькість електронегативного хлору, але тепер він з'являється як квартет.
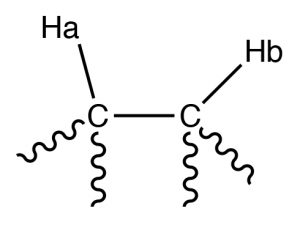
Наприклад, розглянемо молекулу, яка має два нееквівалентних протона (\(\mathrm{Ha}\) and \(\mathrm{Hb}\)) on adjacent carbons (\(\rightarrow\)). \(\mathrm{Ha}\) will experience the magnetic fields generated by \(\mathrm{Hb}\) which has two spin states, which will produce two possible electronic environments for \(\mathrm{Ha}\), resulting in two signals for \(\mathrm{Ha}\).
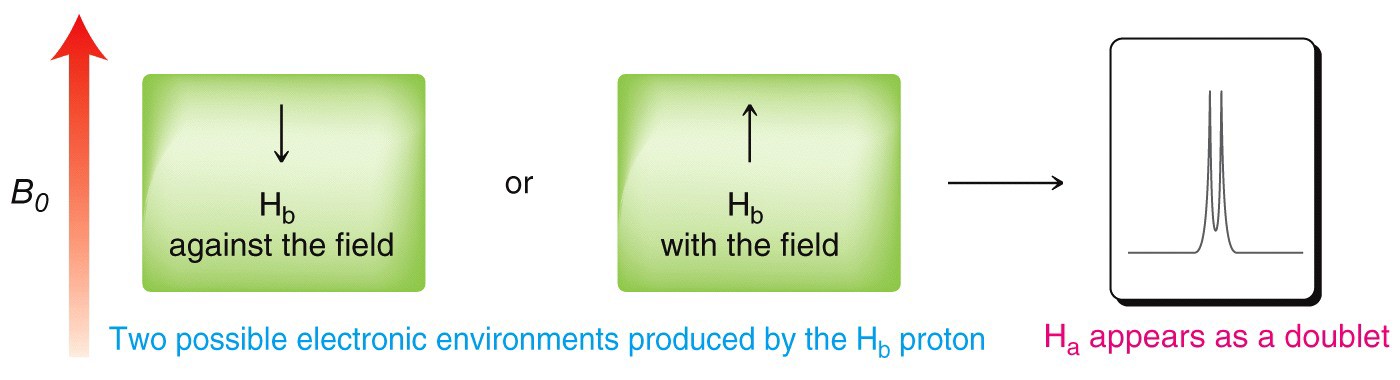
A single proton produces a doublet in the adjacent signal
The splitting effect is small and does not extend (in a significant way) beyond the protons on adjacent carbons. The local magnetic field also depends on the number of protons that do the splitting, for example if there are two protons on the adjacent carbon, the signal is split into a triplet, and for three adjacent protons the signal is a quartet. The general rule is that for \(n\) adjacent protons, the signal is split into \(n+1\) peaks.
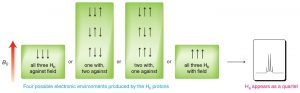
Three adjacent protons produce a quartet in the adjacent signal
The width, in \(\mathrm{Hz}\), of the splitting (that is, the distance between the split peaks) is called the coupling constant \(j\). The value of \(j\) between the protons on adjacent carbons is the same. The number of split peaks therefore allows us to determine how many hydrogens there are on adjacent carbons, which in turn allows us to determine the how the atoms are connected together in the structure. Signals that are split by more than one kind of hydrogen can get quite messy as shown in the spectrum of D-glucopyranose (\(\rightarrow\)).
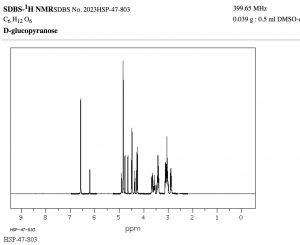
Fortunately, there are ways to simplify such spectrum by selectively irradiating particular frequencies but that is beyond the scope of this course (but something you can look forward to in the future!).
That said, this raises another question: why do \(\mathrm{C-} 13\) NMR spectra appear as single lines for each carbon? Shouldn’t the carbon signals also be split both by adjacent carbons, and by the hydrogens attached to them? There are two reasons that this does not happen. First, the abundance of \(\mathrm{C-} 13\) is so low that the probability of finding more than one \(\mathrm{C-} 13\) in a molecule is very low; in the absence of a second (or third) \(\mathrm{C-} 13\), no splitting by adjacent carbon nuclei will occur, (recall \(\mathrm{C-} 12\) does not generate a spin-based magnetic field). Second, when we originally introduced \(\mathrm{C-} 13\) NMR spectroscopy we presented a simplified model. In fact, the carbon signals are split by the adjacent protons, but this leads to a complex spectrum that is often hard to interpret. Therefore, for most purposes, the sample is irradiated with a radiofrequency that promotes all the hydrogens to the higher-energy spin state. The carbon nuclei do not experience two (or more) magnetic field environments, and therefore only one signal is produced. This technique is called broadband decoupling, and these types of spectra are the most common examples of \(\mathrm{C-} 13\) NMR.
Solvents and Acidic hydrogens in the NMR
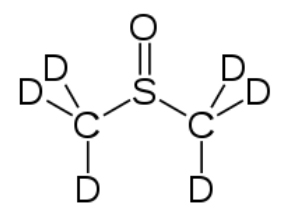
Most NMR spectra, whether \(\mathrm{C-} 13\) or \(\mathrm{H-} 1\), are recorded in solution (although it is possible to obtain spectra on solids—as evidenced by the fact that we can obtain MRI data on people, that say, people [biological systems] are mostly [\(>70 \%\)] water). However, since the solvent is usually present in much greater concentration than the actual sample, as long as we use a solvent that does not generate a strong signal the effects of the solvent can be minimized; typically this involves solvents in which the hydrogens present are replaced with deuterium (D), an isotope of hydrogen that is not NMR active. Common solvents are \(\mathrm{CDCl}_{3}\), (deuterated chloroform) and dimethylsulfoxide \(\mathrm{d-} 6\) (DMSO) (\(\rightarrow\)).
Another instance in which deuterated solvents are used is to detect the presence of potentially acidic hydrogens. Proton transfer is a rapid and reversible process, and any hydrogen attached to an electronegative element is potentially available for exchange by reacting with even very weak base such as water.In fact, by adding a drop of \(\mathrm{D}_{2} \mathrm{O}\) (“heavy” water) to the NMR sample, the signal from any \(\mathrm{O-H}\) or \(\mathrm{N-H}\) disappears as the \(\mathrm{H}\) is replaced by \(\mathrm{D}\).
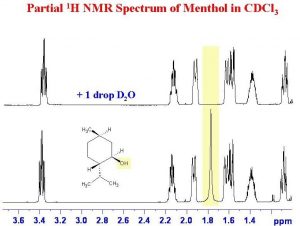
As shown here (\(\rightarrow\)), the signal from the \(\mathrm{OH}\) (shaded in yellow) disappears when the sample is shaken with \(\mathrm{D}_{2} \mathrm{O}\).
Questions to Answer:
Type your exercises here.
- Draw a diagram of an atom and use it to explain why the electron density surrounding the nucleus affects the strength of the external field required to bring the nucleus to resonance (to flip the spin state).
- Using the table below, use your diagram from above and explain a) why the signals for \(\mathrm{C-} 1\) in the three compounds are different, and b) why the signals for \(\mathrm{C-} 1\) and \(\mathrm{C-} 2\) are different (for any single compound).
|
Compound |
Signal for \(\mathrm{C-} 1\) |
Signal for \(\mathrm{C-} 1 (\mathrm{ppm})\) |
|---|---|---|
|
\(\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{F}\) |
\(\mathrm{C-} 1\)" style="padding:0pt 0pt 0pt 0pt;border:none windowtext 0pt;">
79.1 |
\(\mathrm{C-} 1 (\mathrm{ppm})\)" style="padding:0pt 0pt 0pt 0pt;border:none windowtext 0pt;">
15.4 |
| \(\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{Cl}\) | \(\mathrm{C-} 1\)" style="padding:0pt 0pt 0pt 0pt;border:none windowtext 0pt;">
40.0 |
\(\mathrm{C-} 1 (\mathrm{ppm})\)" style="padding:0pt 0pt 0pt 0pt;border:none windowtext 0pt;">
18.9 |
|
\(\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{Br}\) |
\(\mathrm{C-} 1\)" style="padding:0pt 0pt 0pt 0pt;border:none windowtext 0pt;">
27.5 |
\(\mathrm{C-} 1 (\mathrm{ppm})\)" style="padding:0pt 0pt 0pt 0pt;border:none windowtext 0pt;">
19.3 |
