2.2: УФ-спектроскопія та хромофори - або Чому морква помаранчева?
- Page ID
- 25051
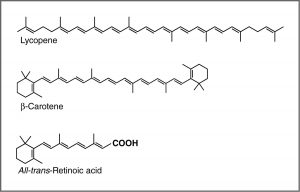
Однією з поширених рекомендацій лікарів є те, що ми їмо багато яскраво забарвлених фруктів і овочів. З'єднання, які надають цим продуктам їх сильний колір, мають ряд спільних рис. Наприклад, з'єднання, яке надає моркві і солодкій картоплі їх характерний помаранчевий колір, - це бета-каротин. Ви цілком можете помітити його схожість з сітківкою. З'єднання, яке сприяє червоному забарвленню томатів, - лікопін. Молекули цього типу відомі загалом як пігменти.
Довжини хвиль, на яких сполука поглинає світло, залежить від енергетичного розриву між орбіталями, які беруть участь у переході. Ця енергетична щілина визначається будовою молекули. Молекула з лише поодинокими зв'язками поглинає світло на більш коротких довжині хвиль (у високоенергетичному УФ), тоді як більш складні схеми зв'язку пов'язані з поглинанням видимого світла. Наприклад, наявність множинних pi зв'язків та їх взаємодія всередині молекули можуть впливати на енергетичний проміжок між молекулярними орбіталями. Нагадаємо, наше обговорення графіту. Замість того, щоб думати про графіт як аркуші сплавлених шестичленних кілець з чергуванням одинарних і подвійних зв'язків, ми можемо думати про кожен зв'язок як локалізовану сигма-зв'язок та делокалізовану пінну зв'язок. Існує величезна кількість молекулярних орбіталів пі, розкинутих по всьому аркушу атомів вуглецю. Чим більше pi MO є, тим більше зменшується енергетичний зазор між цими орбітальними; тобто тим менше енергії (довша довжина хвилі світла) потрібно для переміщення електрона з pi в pi* орбітальну. У випадку мережевих речовин, таких як графіт та метали, енергетичний розрив між орбіталями стає незначним, і ми думаємо про модель зв'язку як про смугу молекулярних орбіталей. У цих випадках багато довжин хвиль світла можуть бути поглинені, а потім повторно випромінюються, що надає графіту та металам їх характерну блиск. У таких речовині, як лікопін або\(\beta\)-carotene we also find this pattern of alternating single and double bonds. We say that compounds with this pattern of alternating single and double bonds (e.g. \(\mathrm{-C=C-C=C-}\)) are conjugated, and we can model the bonding in the same way as graphite. There are pi MO’s that can extend over the region of the molecule, and the more orbitals there are, the closer together in energy they get.
Для ізольованого\(\mathrm{C=C}\) подвійного зв'язку енергія, необхідна для просування електрона від пі до орбіталі pi, відповідає світлу в УФ-області (близько 170 нм), але оскільки кількість подвійних зв'язків, які сполучені (розділені одинарними зв'язками), збільшується енергетичний зазор між найвищими зайнятими молекулярна орбітальна (HOMO) і найнижча незайнята молекулярна орбіталь (LUMO) зменшується. Зрештою, довжина хвилі світла, необхідна для просування електрона від HOMO до LUMO, рухається у видиму область, і речовина стає кольоровою. (Зверніть увагу, що він стає не кольором світла, який поглинається, а скоріше залишився світло, який передається або відбивається). Ці кон'юговані ділянки молекул називаються хромофорами. [5] Чим довше кон'югований ділянку молекули, тим довша довжина хвилі світла, яку вона поглинає. Ви помітите, що і лікопін, і\(\beta\) -каротин містять великі хромофорні області.
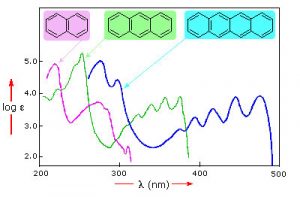
Тут показані зразки спектрів поглинання UV-VIS. Зауважимо, що на відміну від спектрів атомного поглинання, які ми бачили раніше (які складалися з гострих ліній, відповідних довжині хвилі світла, поглиненого атомами), ці спектри широкі і непрозначені. Крім того, ви можете бачити, що чим довший (більший) хромофор, тим довша довжина хвилі, яка поглинається, і кожна з цих сполук, здається, має інший колір. Той факт, що піки в цих спектрах не є гострими, означає, що UV-VIS спектроскопія зазвичай не використовується для ідентифікації сполук (див. Нижче для ІЧ- та ЯМР-спектроскопії, які можуть бути використані для цієї мети). Однак кількість світла, що поглинається, пропорційна концентрації речовини, і тому UV-VIS спектроскопія може бути використана для визначення концентрації зразків.
Питання, на які потрібно відповісти:
- Побудуйте уявлення, яке може допомогти вам пояснити, чому сполуки з довшими хромофорами поглинають фотони меншої енергії, ніж ті, у яких коротші хромофори.
- Яка сполука, на вашу думку, поглинає фотони найнижчого світла енергії? Поясніть свої міркування, використовуючи молекулярну орбітальну діаграму для ілюстрації.