1.2: Напрямок кислотно-лужної реакції та положення рівноваги
- Page ID
- 25118
Реакції кислотної основи починаються через електростатичних взаємодій, але ступінь протікання реакції залежить від відносної вільної енергії Гіббса реагентів і продуктів, тобто загальної зміни вільної енергії Гіббса (\(\Delta \mathrm{G}\)) для реакції. Це тонкий, але важливий момент: реакція не відбувається, оскільки продукти є більш стабільними, це відбувається тому, що між двома реагентами є приваблива сила, які мають полярні структури. Як ми побачимо, ми можемо передбачити відносну кількість реагентів та продуктів у суміші (при рівноваги), засновані як на розумінні молекулярних структур, так і на порівнянні їх\(\mathrm{pK}_{\mathrm{a}}\).
Кислотна сила (з використанням моделі Brønsted — Lowry):
Сила кислоти, тобто ступінь, до якої вона жертвує\(\mathrm{H}^{+}\) (або приймає електронні пари від) інших молекул, залежить від ряду факторів, включаючи, очевидно, міцність основи (тобто ступінь, до якої основа дарує електронні пари іншим молекулам), з якою вона реагує. Кислотні та базові сили зазвичай повідомляються, використовуючи воду як розчинник (тобто як основу або кислоту відповідно), так що сили кислоти можна порівняти безпосередньо. Оскільки біологічні реакції відбуваються у водному розчині, ми зможемо розширити наше розуміння простих реакцій кислотної основи на набагато більш складні, коли ми рухаємось вперед.
Реакція на будь-яку кислоту ГК така:\[\mathrm{HA}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}+\mathrm{A}^{-}\]
Оцінити ступінь реакції (тобто, наскільки далеко йде реакція, тобто концентрації реагентів і продуктів, коли реакція досягає рівноваги), визначаючи константу рівноваги\(\mathrm{K}_{\mathrm{a}}\). \[\mathrm{K}_{\mathrm{a}}=\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[\mathrm{A}^{-}\right] /[\mathrm{HA}]\]
На відміну від сильних неорганічних кислот (таких як\(\mathrm{HCl}\), або\(\mathrm{HNO}_{3}\)), константи рівноваги для багатьох органічних кислот невеликі (від 10 —1 до 10 -55) і частіше повідомляють\(\mathrm{pK}_{\mathrm{a}}\) - що, як ви пам'ятаєте, є\(=-\log \mathbf{K}_{\mathbf{a}}\). Сильна кислота, така як\(\mathrm{HCl}\) має велику\(\mathrm{K}_{\mathrm{a}}\) (насправді вона настільки велика, щоб бути безглуздою) і тому дуже маленьку (негативну)\(\mathrm{pK}_{\mathrm{a}}\).
|
Кислота |
К а |
пК а |
|---|---|---|
|
HCl (соляна кислота) |
~10 7 |
-7 |
|
CF 3 COOH (трифторуоцтова кислота) |
3,2 х 10 —1 |
0.5 |
|
HF (плавикова кислота) |
7,2 х 10 —4 |
3.14 |
|
СН 3 СООН (оцтова кислота) |
1,8 х 10 —5 |
4.8 |
|
Н 2 О |
10 -14 |
14 |
|
СН 3 СН 2 ОН (оцтова кислота) |
10 -16 |
16 |
| NH 4 + (аміак в NH 4 Cl) | 5,6 х 10 —10 | 9.25 |
| СН4 (метан) | ~10 -55 | 55 |
Це допомагає вміти інтерпретувати ці числа з точки зору ступеня пов'язаної реакції. Наприклад, вода (яка виступає і кислотою, і основою) дисоціює в дуже малій мірі. У літрі чистої води, яка містить ~ 54 молі молекул води (або молекул або\(\sim 54 \times 6.02 \times 10^{23}\)\(\sim 3.25 \times 10^{25}\) молекул),\(\sim 10^{-7}\) молі (або\(\sim 10^{-7} \times 54 \times 6.02 \times 10^{23}\) молекули або\(\sim 3.25 \times 10^{16} \mathrm{H}_{3} \mathrm{O}^{+}\) іони). Чим слабкіше кислота, тим вище\(\mathrm{pK}_{\mathrm{a}}\) (чи можете ви пояснити, чому це так і що це означає з точки зору відносних концентрацій видів при рівновазі?).
Це дуже допоможе вам, якщо ви запам'ятовуєте кілька важливих приблизних\(\mathrm{pK}_{\mathrm{a}}\) значень для загальних кислот, наприклад спирти, як правило, мають a\(\mathrm{pK}_{\mathrm{a}}\) of\(\sim 15\), тоді як аміни мають a\(\mathrm{pK}_{\mathrm{a}} \sim 33\). Як ми побачимо, різні\(\mathrm{pK}_{\mathrm{a}}\) види вуглецю дуже залежать від середовища\(\mathrm{C-H}\) зв'язку, але пам'ятати, що\(\mathrm{sp}^{3}\) вуглецево-водневі зв'язки (\(\mathrm{pK}_{\mathrm{a}} \sim 55\)) навряд чи іонізуються ні за яких обставин, корисно. Однак ще важливіше розуміти фактори, що впливають на міцність кислоти, і вміти використовувати їх для прогнозування та пояснення результатів реакцій.
Ще одна важлива ідея, яку слід пам'ятати, полягає в тому, що ступінь реакції (вимірюється її постійною рівноваги\(K\)) пов'язана зі зміною вільної енергії Гіббса (\(\Delta \mathrm{G}^{\circ}=\Delta \mathrm{H}^{\circ}-\mathrm{T} \Delta \mathrm{S}^{\circ}\)), пов'язаної з цією реакцією. Тобто, коли ми думаємо про ступінь реакції (концентрація реагентів і продуктів, коли реакція досягає рівноваги) з точки зору відносної стабільності реагентів і продуктів, нам потрібно враховувати як зміну ентальпії (\(\mathrm{H}^{\circ}\)), яка відображає зміни в зв'язку і міжмолекулярні взаємодії за участю як реагентів, так і продуктів, і зміна ентропії (\(\Delta \mathrm{S}^{\circ}\)), пов'язане з реакційною системою. Нагадаємо, що\(\Delta \mathrm{S}^{\circ}\) відображає зміну кількості можливих енергетичних станів і положень в реакційній системі. Для більшості органічних (слабких) кислот виходить, що\(\mathrm{H}^{\circ}\) реакція дисоціації у воді дорівнює приблизно нулю, тому що види зв'язків і взаємодій, які порушуються і утворюються в ході реакції, схожі. Відмінності\(\Delta \mathrm{G}\) в реакції (і тому\(\mathrm{K}_{\mathrm{a}}\) і\(\mathrm{pK}_{\mathrm{a}}\)), як правило, обумовлені відмінностями в\(\Delta \mathrm{S}\).
Питання, на які потрібно відповісти
- Поясніть, чому кислоти та основи завжди (як пари) знаходяться разом у системі.
- Що мається на увазі під термінами кон'югатна кислота або кон'югатна основа?
- У моделі Льюїса для реакції води\(\mathrm{HCl}\) + поясніть, чому ви малюєте стрілку, що вказує від\(\mathrm{O}\) до\(\mathrm{H}\).
- Завершіть ці реакції на основі кислоти та прогнозуйте відносну кількість реагентів та продуктів, коли реакція досягне рівноваги для кожної реакції. Поясніть свої прогнози, використовуючи свої знання про атомні та молекулярні структури та електронегативність. \ [\ begin {вирівняний}
&\ mathrm {CH} _ {3}\ mathrm {NH} _ {2} +\ mathrm {HCL}\ праволіві стрілки\\
&\ mathrm {CH} _ {3}\ mathrm {NH} _ {2}\ mathrm {O}\ mathrm {N}\ стрілки праворуч\\
&\ математика {CH} _ {3}\ математика {NH} ^ {-} +\ математика {H} _ {2}\ математика {O}\ стрілки праворуч\\
&\ математика {CH} _ {3}\ математика {NH} _ {3} ^ {+} +\ математика {H} _ {2}\ математика {O}\ стрілки праворуч
\ кінець {вирівняний}\]
Органічні кислоти та основи
Розглянувши кислоти і основи за допомогою досить простих молекул (\(\mathrm{HCl}\)і\(\mathrm{NH}_{3}\)), перейдемо до більш складного світу органічних кислот і підстав, як їх ідентифікувати, як визначити відносні сили, і як передбачити, що буде в будь-якій даній суміші. Почнемо з\(\mathrm{pK}_{\mathrm{a}}\) порівняння деяких органічних кислот. Почнемо з етанолу (\(\mathrm{pK}_{\mathrm{a}} \sim 16\)), молекули, яку ми зазвичай не вважаємо кислотою, і оцтової кислоти (\(\mathrm{pK}_{\mathrm{a }} 4.8\)). Існує явно величезна різниця між цими двома молекулами, питання в тому, чи можемо ми зрозуміти, чому це так?\(\mathrm{pK}_{\mathrm{a}}\)
Якщо ми витягнемо їх структури, ми побачимо, що обидва мають (як очікувалося) кислий водень, пов'язаний з електронегативним киснем. (Переконайтеся, що ви пам'ятаєте, чому водні, пов'язані з вуглецями, не такі кислі, як ті, що пов'язані з киснем). Так чому величезна різниця\(\mathrm{pK}_{\mathrm{a}}\) в? Щоб відповісти на це питання, ми повинні пам'ятати, що ступінь реакції залежить від відносної термодинамічної стійкості продуктів - тобто системи, що містить кон'югатну основу кислоти та іон гідронію. Реакції та сполучені основи двох показані тут (\(\downarrow\)). Виходячи з їх\(\mathrm{pK}_{\mathrm{a}}\) значень, ми прогнозуємо, що реакція дисоціації етанолу зустрічається рідко (утворюється мало іонів етоксиду), тоді як реакція дисоціації оцтової кислоти є більш частою. Однак врахуйте, що навіть у випадку з оцтовою кислотою лише близько 3% молекул кислоти дисоціюються в 1М розчині.
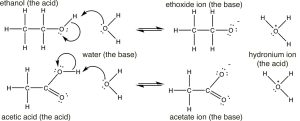
Перший крок в обох реакціях, здається, більш-менш однаковий, електронна пара з кисню у воді утворює зв'язок з електроном дефіцитним воднем, тоді як\(\mathrm{O-H}\) зв'язок кислоти розривається, а електрони, спочатку пов'язані з нею, рухаються назад до кисню. Різниця між двома реакціями полягає головним чином в тому, як поводяться негативно заряджені кон'югатні основи (етоксид і ацетат), і в способі їх розчинення розчинником (водою). Для етоксиду (кон'югатної основи етанолу) додатковий негативний заряд локалізується на кисень, що призводить до концентрації заряду. Молекули води сильно притягуються до аніону етоксиду, взаємодії, яка обмежує рухливість резонансних структур резонансних гібридних молекул води і призводить до зниження ентропії (\(\Delta \mathrm{S}\)є негативним). На відміну від цього, в ацетаті (кон'югатна основа оцтової кислоти) негативний заряд делокалізується на обидва кисень (хоча він часто малюється так, ніби він пов'язаний з одним, але не іншим). Ми можемо проілюструвати це двома способами (або більше!) малюючи стрілки, щоб вказати, як додаткова електронна пара може переміщатися від одного кисню до іншого; це виглядає так (\(\rightarrow\)).
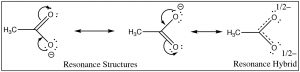
Фактична структура має частковий негативний заряд на обидва кисню. Цю пару структур часто називають резонансною структурою, і процес називається резонансом, але назва вводить в оману. Насправді фактична структура, резонансний гібрид, НЕ включає електрони (і подвійний зв'язок), що рухаються взад-вперед між двома атомами кисню. За біологічною (і не зовсім чуттєвою) аналогією ми можемо сказати, що це мул або хінні - потомство щось середнє між конем і ослом. [6] Подібно до того, як мул (або хінні) не підстрибує туди-сюди між тим, щоб бути конем і бути ослом, тому резонансний гібрид насправді існує як новий вид [7], з фактичною структурою, яка є частиною між двома (намальованими) резонансними структурами. У цьому випадку ми використовуємо дві моделі зв'язку (валентний зв'язок і делокалізована молекулярна орбітальна модель) для опису структури ацетатного аніону. Локалізована модель валентного зв'язку включає в себе сигма-єдину структуру зв'язку, яка з'єднує атоми і забезпечує молекулярну форму. Делокалізована молекулярна орбітальна модель описує pi зв'язок, який з'єднує обидва\(\mathrm{O}\) s до\(\mathrm{C}\). Ми можемо візуалізувати аніон як планарний\(\mathrm{sp}^{2}\) гібридизований вуглець, з'єднаний з метильною групою та двома киснями сигма-зв'язками разом із 3 атомом двох електронів pi зв'язку, що поширюється на\(\mathrm{O-C-O}\) каркас (\(\rightarrow\)). Результатом є те, що в ацетатному іоні негативний заряд делокалізується над двома киснем, а не концентрується лише на одному атомі, оскільки він знаходиться в іоні етоксиду. Результатом є те, що взаємодія ацетату з молекулами води розчинника не така сильна, так що молекули води не такі впорядковані, що означає, що вода не така впорядкована навколо молекули, а зміна ентропії не така негативна. Ефекти делокалізації заряду над більш ніж одним атомом відіграють важливу роль у прогнозуванні результатів широкого спектру реакцій. Зауважимо, що\(\Delta \mathrm{S}\) це все ще негативно, оскільки створення зарядженого виду все ще призводить до збільшення впорядкування молекул розчинника.
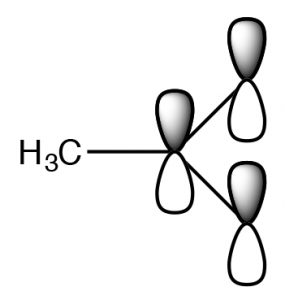
Один із способів передбачити, чи може бути делокалізований заряд, - це визначити, чи можна малювати резонансні структури для заряджених видів. Наприклад: спробуйте переконати себе, що ви не можете намалювати резонансні структури для етанолу.
Резонанс - не єдиний спосіб стабілізації заряду. Як правило, резонанс відбувається через кон'юговану систему pi зв'язку, наприклад, відбувається всередині\(-\mathrm{CO}_{2}^{-}\) частини органічної кислоти, але як ми враховуємо різницю в кислотності оцтової кислоти (\(\mathrm{pK}_{\mathrm{a }} 4.8\)) та трифторуцтової кислоти (\(\rightarrow) (\(\mathrm{pK}_{\mathrm{a }} 0.5\)), хоча вони обидва мають функціональну групу карбоксилатів? Різниця між ними полягає в тому, що заряд на трифторацетатном аніоні делокалізується двома різними механізмами. Як і в ацетаті, негативний заряд делокалізується резонансом через систему зв'язку пі; крім того, він також делокалізується на фтор тим, що високоелектронегативні атоми фтору (більш електронегативні, ніж\(\mathrm{O}\)) виводять електрони з метилвуглецю через сигма-зв'язки, який, в свою чергу, виводить електрони з наступного вуглецю, і, в свою чергу, з двох кисню (процес, відомий як «індукція»). Результатом є те, що негативний заряд «розмазується» над ще більшою кількістю атомів, що робить аніон ще менш імовірним, що спричинить впорядкування молекули розчинника (зменшуючи вплив на\(\Delta \mathrm{S}\)). Як і слід було очікувати, індуктивний ефект залежить від відстані (можливо, ви можете передбачити ефект додавання більшої\(\mathrm{CH}_{2}\) кількості груп між\(\mathrm{CF}_{3}\) і\(\mathrm{CO}_{2}\) групами).
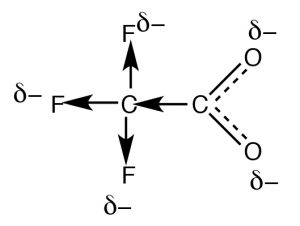
Питання, на які потрібно відповісти:
- За допомогою резонансних структур передбачають, які більш кислі:\(\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{OH}\) або\(\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{OH}\)?
- Намалюйте структури, щоб показати, як етоксид натрію та ацетат натрію розчиняються у воді, і використовуйте їх, щоб показати, чому негативна зміна ентропії для утворення ацетату натрію менша, ніж у етоксиду натрію.
- \(\mathrm{pK}_{\mathrm{a}}\)Розглянемо три хлоробутанової кислоти:\(\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{CHClCOOH}\left(\mathrm{pK}_{\mathrm{a}}\right. \text { 2.86) }\),\(\mathrm{CH}_{3} \mathrm{CHClCH}_{2} \mathrm{COOH}\left(\mathrm{pK}_{\mathrm{a}}\right. \text { 4.05) }\), і\(\mathrm{CH}_{2} \mathrm{ClCH}_{2} \mathrm{CH}_{2} \mathrm{COOH}\left(\mathrm{pK}_{\mathrm{a}}\right. \text { 4.53) }\). Намалюйте структури та використовуйте їх, щоб пояснити, чому ці карбонові кислоти мають різні\(\mathrm{pK}_{\mathrm{a}}\).
Органічні основи
Як зазначалося раніше, немає кислот без підстав, і навпаки. Навіть якщо ми обговорюємо лише\(\mathrm{H}^{+}\) (протонну) передачу, (можливо) легше думати про базу за допомогою моделі Льюїса. Тобто основа має електронну пару, доступну для пожертвування в зв'язок з кислотою. Нагадаємо, що в якості основи може виступати практично все, що має пару незв'язних електронів (іноді його називають самотньою парою). Найпоширеніші види органічних основ часто мають атом азоту десь у своїй структурі. Якщо порівняти основність\(\mathrm{O}\) і\(\mathrm{N}\), кожна з яких має самотні пари\(\mathrm{F}\), які потенційно можуть бути пожертвані, азот є найменш електронегативним і, отже, найкращим чином здатний пожертвувати свої електрони в зв'язок, оскільки його самотня пара найменше приваблює ядро. Фтор, найбільш електронегативний елемент, тримає свої електрони дуже близько до ядра, і за звичайних обставин не буде розглядатися як основа.
Кисень, оскільки він більш електронегативний, ніж азот, не є такою сильною основою, тому при змішуванні аміаку і води єдиною реакцією, яка відбувається (і що порівняно невеликою мірою) є перенесення протонів з води в аміак. \[\mathrm{NH}_{3}+\mathrm{H}_{2} \mathrm{O} \leftrightarrows \mathrm{NH}_{4}^{+}+{ }^{-} \mathrm{OH}\]
Константа рівноваги для цієї реакції є\(1.8 \times 10^{-5}\) (більшість видів в суміші при рівновазі є реагентами)
*вставити тут зображення*
Ось деякі органічні основи (\(\rightarrow\)). Відзначимо, що вони є компонентами широкого спектру біологічно активних молекул, включаючи ДНК, гормони і фармацевтичні препарати. Як ми побачимо, основний азот забезпечує важливий спосіб зрозуміти реакційну здатність конкретного виду.
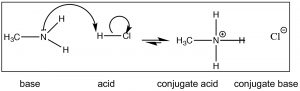
Наразі, однак, почнемо з простішої основи, такої як метиламін (\(\mathrm{CH}_{3} \mathrm{NH}_{2}\)) найпростіша азотиста органічна основа. Метиламін реагує з кислотами (\(\downarrow\)) майже так само, як це робить аміак; він буде реагувати з сильною кислотою, як\(\mathrm{HCl}(\mathrm{aq})\) виробляти хлорид метиламмонію.
Нагадаємо, що положення рівноваги можна передбачити, порівнюючи силу (\(\mathrm{pK}_{\mathrm{a}}\)і) двох кислот. \(\mathrm{HCl}\left(\mathrm{pK}_{\mathrm{a}}-7\right)\)є набагато сильнішою кислотою, ніж\(\mathrm{CH}_{3} \mathrm{NH}_{3}{ }^{+}\left(\mathrm{pK}_{\mathrm{a}} \sim 10\right)\) і тому ми прогнозуємо, що рівновага\(\mathrm{HCl}\) реакції метиламіну + буде лежати добре праворуч. Тепер розглянемо реакцію, при якій метиламін вступає в реакцію з оцтовою кислотою (\(\downarrow\)).
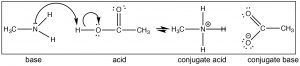
Знову ми можемо передбачити положення рівноваги шляхом порівняння\(\mathrm{pK}_{\mathrm{a}}\) кон'югатних кислот (оцтової кислоти\(4.8\) і\(\mathrm{CH}_{3} \mathrm{NH}_{3}{ }^{+} \sim 10\)). Зверніть увагу, що передбачити структуру продуктів можна просто, слідуючи за потоком електронів. Ми могли б змінити\(\mathrm{CH}_{3}\) (метильні) групи на метиламін і оцтову кислоту на широкий спектр різних груп і все ще мати можливість легко передбачити продукт, якщо ви визнаєте, що реакція, яка відбувається, є (простий) перенесення протонів (кислота-основа). Наприклад, подивіться на будову кокаїну (вище): чи можете ви передбачити, що буде, якщо його відреагували з оцтовою кислотою? Якою була б структура продукту?
Молекули, які містять як кислоту, так і основу:
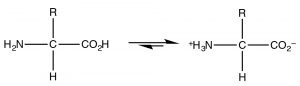
Найпоширенішим прикладом молекули, яка діє як кислота, так і основа, звичайно, вода, оскільки вона має як потенційно кислу гідрогенну, так і самотню пару, яка може прийняти протон. Однак, оскільки це органічна хімія, де вода не є настільки поширеним розчинником, розглянемо клас молекул, які мають одночасно і кислі, і основні домени. Найбільш біологічно важливими такими молекулами є амінокислоти, які мають і аміногрупу, і карбонову кислоту. Підмножина можливих амінокислот - це ті, що використовуються в біологічних системах для складання поліпептидів. Амінокислоти (а точніше\(\alpha\) -амінокислоти) містять як карбонову кислоту, так і аміногрупу, прикріплену до центрального вуглецю (\(\alpha\)-вуглецю). Загальну структуру наведено тут (\(\rightarrow\)), де R позначає широкий діапазон бічних ланцюгів. [8]\(\mathrm{pH } 7\) У амінокислота існує в тому, що відомо як цвіттеріонова форма, в якій група карбонових кислот негативно заряджена, тоді як аміногрупа позитивно заряджена. Ні в якому разі амінокислота (розчинена у воді) не існувала б в неіонізованій формі. Ми можемо передбачити, яка форма буде присутній\(\mathrm{pH}\) у різних, враховуючи\(\mathrm{pK}_{\mathrm{a}}\) види, що беруть участь.