1.3: Вплив рН на реакції кислотної основи
- Page ID
- 25106
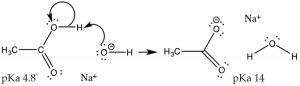
Поки ми обговорювали ситуації, коли кислоту або основу додають в розчин чистої води. Чиста вода має\(\mathrm{pH}\) 7, а\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\left[{ }^{-} \mathrm{OH}\right]\). Тепер розглянемо, що відбувається, коли ми змінюємо\(\mathrm{pH}\) рішення. Для прикладу розглянемо ситуацію, в якій ми розчиняємо просту органічну кислоту (\(\mathrm{CH}_{3}\mathrm{CO}_{2}\mathrm{H}\), оцтову кислоту) в розчині\(\mathrm{pH}>7\), який має, тобто де\(\left[{ }^{-} \mathrm{OH}\right]>\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\); в цих умовах ступінь іонізації оцтової кислоти збільшується. Нагадаємо, що в 1М оцтової кислоти тільки\(\sim 3%\) кислота іонізується при\(\mathrm{pH } 7\). Якщо ми змінимо розчин, щоб зробити його основним шляхом додавання\(\mathrm{NaOH}\), надлишок міцної основи (\({ }^{-} \mathrm{OH}\)) повністю депротонує кислоту. При рівновазі реакція тепер сприятиме продуктам над реагентами (тобто вона буде рухатися вправо). Те, що ми зробили тут, - це привести реакцію\(\leftrightarrows\) ацетату оцтової кислоти вправо, збільшуючи концентрацію ацетату, що є застосуванням принципу Ле Шательє). Зверніть увагу\(\mathrm{Na}^{+}\), що, походить від додавання\(\mathrm{NaOH}\) використовуваного для коригування\(\mathrm{pH}\), присутній, але не бере участі в реакції — з цієї причини його називають «глядацьким іоном». Інший, можливо, більш простий, спосіб передбачити результат цієї реакції полягає у використанні\(\mathrm{pK}_{\mathrm{a}}\) значень двох кислот (\(\mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}, 4.8\)і\(\mathrm{H}_{2} \mathrm{O}, 14\)), явно оцтова кислота набагато сильніше кислоти, ніж вода, і тому положення рівноваги для цієї реакції буде лежати вправо на користь найслабша кислота і найслабша основа. Те, що ми зробили тут, - це змінити оцтову кислоту, яка є полярною органічною молекулою, на ацетат, іонний вид.
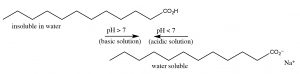
Оцтова кислота - це невелика органічна молекула; оскільки вона полярна, вона може взаємодіяти з водою (хоча міжмолекулярні сили), тому оцтова кислота дуже розчинна у воді (дійсно змішується з водою (вона має необмежену розчинність). [9] Але тепер розглянемо вплив збільшення довжини вуглеводневої групи органічної кислоти на її молекулярні властивості. Оцтова кислота має метильну (\(\mathrm{CH}_{3}-\)) групу, найменший з можливих вуглеводнів. На відміну від додеканової (лауриновой) кислоти має 12-вуглеводневу ланцюг (\(\mathrm{CH}_{3}\left[\mathrm{CH}_{2}\right] 11 -\)) і має розчинність у воді\(0.063 \mathrm{g} / \mathrm{L}(\sim 30 \mathrm{mM})\) АТ\(25^{\circ} \mathrm{C}\), що набагато менше оцтової кислоти. [10] У міру збільшення вуглеводневої (неполярної) частини молекули в довжину розчинність у воді зменшується: процес розчинення органічної кислоти у воді стає більш позитивним.\(\Delta \mathrm{G}\) Таке зниження розчинності в першу чергу обумовлено негативною зміною ентропії (\(\Delta \mathrm{S}\)), викликаної самоорганізацією молекул води навколо вуглеводневого «хвоста» молекули. Тепер розглянемо поведінку іонізованого додеканоата натрію (натрієвої солі додеканової кислоти); він, як і багато іонних видів, розчинний у воді. Хоча, як ви пам'ятаєте, це інша форма розчинності - розчинні види - це не ізольовані молекули, а, скоріше, молекулярні комплекси, відомі як міцели (\(\rightarrow\)). [11] Підсумок цього полягає в тому, що ми можемо «солюбілізувати» органічні кислоти у воді, депротонуючи їх, але якщо ми потім знизимо рН, органічна кислота знову відокремиться від розчину.

Органічні основи можна солюбілізувати аналогічним чином, за винятком того, що тепер розчин необхідно зробити кислим. Наприклад, азотиста основа з великою неполярною групою типу додециламіну (\(\mathrm{C}_{12} \mathrm{H}_{27} \mathrm{~N}\)) має розчинність близько\(3.5 \mathrm{~g} / \mathrm{L}(\sim 20 \mathrm{mM})\), але при кислотних\(\mathrm{pH}\) s вона повністю розчинна. Протиставляйте розчинність додециламіну з кадаверином (\(\mathrm{NH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{NH}_{2}\)), сполукою, яка пахне своєю назвою, яка повністю змішується з водою, оскільки має дві полярні аміногрупи. Виявляється, ми можемо передбачити рН, при якому певна кислота або основа протонує або депротонує. Ви можете згадати із загальної хімії, що рН слабких кислот та їх кон'югатних основ (як і більшість органічних видів) можна описати за допомогою рівняння Гендерсона Хассельбальха (\(rightarrow\)).
Один із способів роботи з цим рівнянням полягає в тому, щоб відзначити, що\([\text { acid }]=\left[\text { conjugate } p H=p K_{a}+\log \frac{[\text { base }]}{[\text { acid }]} \text { base }\right]\) коли система дорівнює\(\mathrm{pK}_{\mathrm{a}}\) кислоті.\(\mathrm{pH}\) \(\mathrm{pH}\)Внизу\(\mathrm{pK}_{\mathrm{a}}\)\(\text { [acid] }>\text { [conjugate base] }\), є більше кислоти, ніж основи, і навпаки для\(\mathrm{pH}>\mathrm{pK}_{\mathrm{a}}\). Тому, регулюючи,\(\mathrm{pH}\) ми можемо змінювати концентрації кон'югатної кислоти та основи відповідно до наших цілей, або ми можемо передбачити відносні концентрації при будь-якому\(\mathrm{pH}\). Наприклад, оцтова кислота з а\(\mathrm{pK}_{\mathrm{a}}\) з\(4.8\) мав би\(50 \% \mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}\), причому\(50 \% \mathrm{CH}_{3} \mathrm{CO}_{2}^{-} \mathrm{Na}^{+}\), при а\(\mathrm{pH}\) з\(4.8\). При\(\mathrm{pH}\) падінні нижче\(4.8\) концентрація протонованої кислоти збільшиться, а при її підвищенні концентрація ацетат-іона збільшиться.
Ця здатність перетворювати органічну речовину з нерозчинної (у воді) молекули в розчинний іонний вид може бути дуже корисною. Один поширений приклад випливає з того, що багато фармацевтичних препаратів є органічними речовинами, які не розчиняються у водних розчині (як цитоплазма або кров). Якби ці речовини вводилися в організм в їх неіонізованому вигляді, вони не розчинялися б, а значить, були б неактивними. Якщо ви перевірите етикетки на багатьох пляшках, що відпускаються за рецептом, ви побачите, що препарат вводять у вигляді солі. Розглянемо норадреналін (\ (правастрілка), гормон, який часто вводять внутрішньовенно для протидії наслідкам алергічних реакцій. Його вводять у вигляді солі винної кислоти, щоб переконатися, що вона розчиняється в кровотоці.
Ви можете зіткнутися з іншим прикладом цього явища (що кислоти розчинні в основному розчині, а основи розчинні в розчині кислоти), якщо ви пройдете лабораторний курс органічної хімії. Якщо ваш продукт має в своїй структурі кислий або основний фрагмент, ви можете витягти речовина у водний (кислотний або основний) розчин, змиваючи всі органічні побічні продукти органічним розчинником, а потім регенеруючи кислотне або основне речовина. Це важливий метод очищення для багатьох речовин, оскільки він дозволяє відокремити цікаву сполуку у водний розчин, а потім регенерувати, просто додаючи або віднімаючи протон.
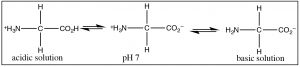
Коли ми розглядаємо біомолекули (тобто органічні молекули, знайдені в організмах), ситуація не настільки чітко виріжена; більшість біомолекул мають різноманітні кислі і основні групи в складі своєї структури. Навіть найпростіша амінокислота, гліцин (\(rightarrow\)) існує в різних протонованих і депротонованих формах в залежності від\(\mathrm{pH}\).
Одне, що стає зрозумілим, це те, що окремі амінокислоти завжди заряджаються незалежно від того\(\mathrm{pH}\), тому вони водорозчинні. Але ступінь реакцій протонації/депротонації\(\mathrm{pH}\) залежить. Як ми побачимо, це має ряд наслідків для широкого спектру біологічних молекул, оскільки вони поводитимуться дуже по-різному в різних рішеннях рН. Це одна з важливих причин, чому більшість біологічних систем буферизовані так, що вони залишаються досить постійними\(\mathrm{pH}\).
Питання, на які потрібно відповісти:
- Якщо у вас є суміш бензойної кислоти\(\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{CO}_{2} \mathrm{H}\left(\mathrm{pK}_{\mathrm{a}}\right. \text { 4.2) }\), толуолу\(\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{CH}_{3}\) та аніліну\(\mathrm{pK}_{\mathrm{a}}\) гідрохлориду (або\(\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{NH}_{3}{ }^{+} 4.6\)). Яка речовина буде розчинний у водному кислотному розчині, який буде розчинний у водному основному розчині, який не буде розчинний у воді?
- Наведіть схему поділу цих трьох речовин за допомогою їх різних розчинностей в органічних і водних розчині різних\(\mathrm{pH}\) s.
