1.1: Короткий огляд моделей кислотно-лужних реакцій.
- Page ID
- 25119
Існує ряд способів обговорення кислотно-лужних реакцій, залежно від того, які аспекти реакції ми хочемо виділити. Вони варіюються від надзвичайно спрощеної (і не корисної) моделі Арреніуса, до моделі Бронстеда - Лоурі, яку ми використовуємо лише для реакцій, в яких передаються протони, і, нарешті, до моделі Льюїса, яка може охоплювати будь-який тип кислотно-лужної реакції.
Арреній:
Модель кислотно-основи Arrhenius є, мабуть, першою кислотно-базовою моделлю, до якої ви були введені під час навчання. У цій моделі, коли кислота розчиняється у воді, вона дисоціюється, виділяючи іон водню (H +); коли основа розчиняється, вона виділяє гідроксидний іон (—OH).
Кислота:\(\mathrm{HCl}(\mathrm{g})+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{H}^{+}(\mathrm{aq})+\mathrm{Cl}^{-}(\mathrm{aq})\) (іноді пишеться як або\(\mathrm{HCl}(\mathrm{aq})\))
База:\(\mathrm{NaOH}(\mathrm{s})+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{Na}^{+}(\mathrm{aq})+{ }^{-} \mathrm{OH}(\mathrm{aq})\)
Кислотно-основна реакція:\(\mathrm{HCl}(\mathrm{aq})+\mathrm{NaOH}(\mathrm{aq}) \rightarrow \mathrm{NaCl}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O} \text { (l) }\) [2]
Хоча проста, модель Арреніуса не особливо корисна, коли мова йде про розуміння реакцій, що розглядаються в органічній хімії. Це, звичайно, викликає очевидне питання: так чому ми згадуємо про це? Відповідь дворазова: i) тому що ви можете нечітко запам'ятати її як опис поведінки на основі кислоти та ii), щоб ми могли розглянути, чому це не корисно і чому ви не повинні його використовувати. Модель Arrhenius кислота-основа застосовується лише тоді, коли вода є розчинником - оскільки ми побачимо, що багато органічних реакцій не відбуваються у воді. Модель Arrhenius також помилково передбачає, що у воді бродять вільні протони (\(\mathrm{H}^{+}\)), і це обмежує основи тими речовинами, які виділяють гідроксид-іон. Нарешті, це означає, що кислота може існувати незалежно від основи - і навпаки, що не має великого сенсу.
Бронстед-Лоурі:
Модель Brønsted—Lowry є набагато більш корисною та гнучкою моделлю для розгляду реакцій кислотної основи. У цій моделі кислота є донором протона (\(\mathrm{H}^{+}\)), а основа - протонний акцептор. У моделі Brønsted-Lowry ви не можете мати кислоту без основи, і навпаки; кислота повинна\(\mathrm{H}^{+}\) пожертвувати її чомусь (основою), і так само основа повинна прийняти її. \(\mathrm{H}^{+}\)Це не просто «скидає» —це передається. [3] У разі реакцій, які відбуваються у водному розчині, він\(\mathrm{H}^{+}\) переноситься в молекулу води для формування\(\mathrm{H}_{3} \mathrm{O}^{+}\). Розглянемо, як приклад,\(\mathrm{HCl}\); у водному розчині\(\mathrm{HCl}\) переносять\(\mathrm{H}^{+}\) групу в молекулу води. Продуктами є\(\mathrm{H}_{3} \mathrm{O}^{+}\) (кон'югатна кислота води) і\(\mathrm{Cl}^{-}\), кон'югатна основа\(\mathrm{HCl}\).
|
HCl (г) + |
Н 2 О (л) |
⇆ |
Н 3 О + (ак) |
+ |
Cl — (aq) |
|
кислота |
база |
кон'югатна кислота |
сполучена основа |
|
HCl |
+ |
NH 3 |
NH 4 + |
Cl — |
|
кислота |
база |
кон'югатна кислота |
сполучена основа |
У моделі Брёнстеда — Лоурі, як і для всіх хімічних реакцій, розглянутих на молекулярному рівні, існує можливість реакції зворотного, що позначається використанням рівноважних стрілок (\(\rightleftarrows\)).
На макроскопічному рівні ступінь протікання реакції (від реагентів зліва до продуктів справа) визначається рядом факторів. Тобто нам потрібно більше інформації для прогнозування (або розрахунку) концентрації реагентів і проектів при рівновазі. Це інформація, яка також дозволяє нам передбачити, чи буде реакція протікати в прямому напрямку (праворуч) чи ні, і як реакція може змінитися, якщо ми додамо або видаляємо реагенти (або продукти).
Ми можемо ідентифікувати потенційно кислий,\(\mathrm{H}^{+}\) оскільки він буде пов'язаний з більш електронегативним атом; результат полягає в тому, що електронна щільність в зв'язку буде лежати головним чином з більш електронегативним атомом (наприклад\(\mathrm{O}\)\(\mathrm{N}\), або\(\mathrm{Cl}\)). Результат полягає в тому, що, наприклад,\(\mathrm{H-O}\) зв'язок буде ослаблений (потрібно менше енергії для розриву); він\(\mathrm{H}\) матиме великий частковий позитивний заряд на ньому і буде сильно притягнутий до основних центрів (як описано в наступному розділі). Аналогічно прості основи можна ідентифікувати за наявністю атома (всередині молекули), який має частковий негативний заряд; цей частковий негативний заряд виникає тому, що атом (основний центр) пов'язаний з менш електронегативними атомами. Тепер ми додаємо ще один розгляд, цей базовий центр атома також повинен бути в змозі прийняти вхідні\(\mathrm{H}^{+}\). На практиці це означає, що основна молекула буде містити атом, який має одиничну (незв'язну) пару електрони, які можуть утворювати зв'язок з\(\mathrm{H}^{+}\).
Модель Бронстеда - Лоурі корисна для реакцій кислотно-основи, які передбачають перенесення протонів, але навіть при цьому вона обмежується реакціями переносу протонів. Також відзначимо тут, що розчинник, в якому відбувається перенесення протона, вплине на реакцію, і ми повернемося до цієї ідеї пізніше в курсі. Якщо ми розширимо модель Брёнстеда на інші реакції, коли основа використовує свою одиноку електронну пару для формування нового зв'язку з електропозитивним центром, ми можемо розширити клас реакцій кислотно-основи ще далі. Що підводить нас до наступної моделі хімії кислотної основи: моделі Льюїса.
Льюїс:
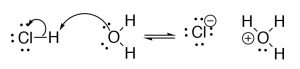
Модель Льюїса дозволяє нам описати точно такий же набір реакцій, як і модель Бронстеда - Лоурі, але з іншої точки зору, і це також дозволяє нам розширити модель. У моделі Льюїса база має можливість пожертвувати електронну пару для формування нового зв'язку з кислота, яка приймає цей новий зв'язок, часто, але не завжди з супутнім розривом зв'язку всередині молекули кислоти. Ми використовуємо те ж обґрунтування того, чому реакція відбувається між двома протилежно зарядженими центрами, але з точки зору електронів, а не з точки зору\(\mathrm{H}^{+}\). Тому основа повинна мати одиноку пару електронів, які можуть брати участь у зв'язку, тоді як кислота повинна мати атом, який може прийняти цю самотню пару електронів. Використовуючи реакцію\(\mathrm{HCl}\) і води як приклад, ми використовуємо позначення криволінійної стрілки, щоб позначити, як електрони рухаються між основою і кислотою. Нагадаємо [4], що ми використовуємо цю вигнуту стрілку позначення для позначення руху електронної пари

від джерела електронів до раковини. Тут джерелом є самотня пара на кисні, а раковина - водень (який має\(\delta^{+}\) завдяки його зв'язку з a\(\mathrm{Cl}\)) Друга стрілка рухається від джерела (зв'язок між\(\mathrm{H}\) і\(\mathrm{Cl}\), до раковини - електронегатив,\(\mathrm{Cl}\) який закінчується негативним зарядом, в той час як той\(\mathrm{O}\), що пожертвував оригінальну електронну пару, закінчується позитивним зарядом).
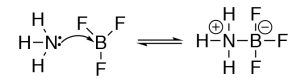
Модель Льюїса охоплює модель Бронстеда - Лоурі, тобто всі реакції на основі кислоти Бронстеда - Лоурі, які можна описати за допомогою моделі Льюїса. Однак модель Льюїса розширює діапазон типів реакцій, які можна розглядати як кислотно-лужні реакції. Візьмемо для прикладу реакцію аміаку (\(\mathrm{NH}_{3}\)) і трифториду бору (\(\mathrm{BF}_{3}\)). Ця реакція класифікується як реакція Льюїса кислота-основа, але це не реакція кислота-основа Бронстеда.
Навіщо використовувати різні моделі кислотно-лужної хімії? Хоча спочатку ідея використання різних моделей для пояснення хімії кислотно-основи може бути трохи заплутаною. Чому б не використовувати всеохоплюючу модель Льюїса для всього? Виявляється, як моделі Brønsted-Lowry, так і Lewis особливо корисні залежно від розглянутої системи. Хитрість полягає в тому, щоб визнати, що є найбільш корисним при описі, прогнозуванні та поясненні певного типу хімічної реакції. [5]
У наших дослідженнях з органічної хімії ми будемо використовувати як моделі Бронстеда - Лоурі (перенесення протонів), так і Льюїса (донорство електронної пари) для опису хімії кислота-основа, залежно від типу реакції. На практиці модель Brønsted-Lowry проста і корисна; вона розповідає вам, що відбувається (протон переноситься з кислоти на основу), але нічого про механізм, за допомогою якого\(\mathrm{H}^{+}\) рухається. Для цього ми повинні звернутися до моделі Льюїса, яка розповідає нам, як електрони переставляються під час реакції. Важливо також мати на увазі, чому ці реакції відбуваються - вони викликані електростатичною взаємодією між двома протилежно зарядженими частинами молекул:\(\delta^{-}\) притягується до\(\delta^{+}\).
Ще одне зауваження, всі реакції ініціюються випадковими зіткненнями молекул, але продуктивними є тільки зіткнення, що дозволяють відбуватися електростатична взаємодія кислоти і основи (тобто зіткнення, в яких беруть участь дві аналогічно заряджені частини молекул, не дадуть виникнення реакції. Знову нам доведеться більше сказати про це пізніше.
