ІІ. Реакції міжмолекулярного додавання
- Page ID
- 27567
A. Загальне рівняння реакції
Корисна термінологія для опису реакцій радикального додавання наведена в еквалайзері 1. Згідно з цим описом, коли радикал, орієнтований на вуглець, реагує з подвійним зв'язком вуглець - вуглець, він додає до β-атома вуглецю і створює новий радикальний центр на α-атомі вуглецю. Букви X, Y та Z в еквалайзері 1 представляють собою замінники, прикріплені до трьох атомів вуглецю, безпосередньо беруть участь у реакції.
.png)
B. Реакція на менш заміщеному атомі вуглецю
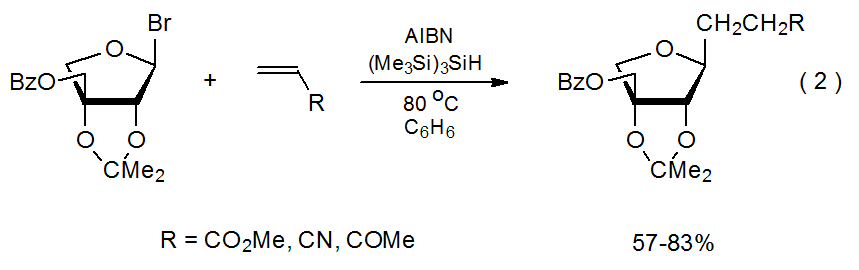
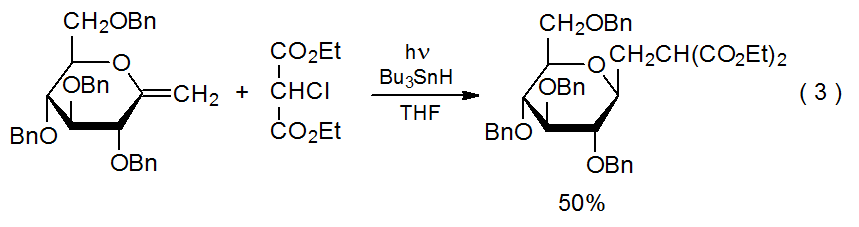
Характерною рисою реакцій радикального приєднання є те, що вуглецецентричний радикал додає регіоселективно до менш заміщеного атома в множинному зв'язку С—С. 7-10 Реакція, показана на схемі 1, дає типовий приклад. Інші реакції за участю подвійних зв'язків з різними замісниками (еквалайзер 2) 11 і подвійними зв'язками з більш ніж одним замісником (екв 3) 12.13 виявляють аналогічну регіоселективність. Пояснення регіоселективності додатково реакцій починається з того, що вони зазвичай не є оборотними; 14 отже, інформація про структури перехідного стану має вирішальне значення для розуміння селективності в цих кінетично керованих реакціях.
.png)
.png)
C. Перехідно-державна структура
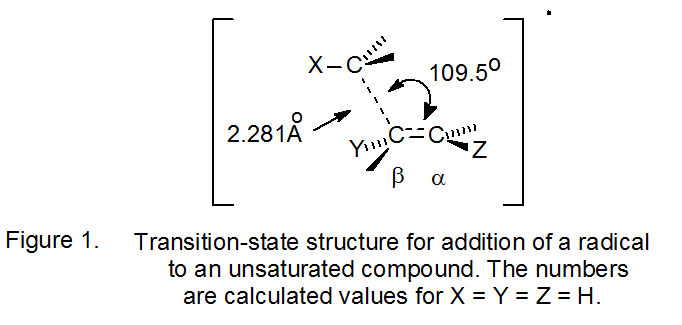
Структура перехідного стану в радикальній реакції приєднання, визначена з молекулярно-орбітальних розрахунків, показана на малюнку 1. 8 Кілька аспектів цієї структури впливають на регіоселективність реакції. Перший полягає в тому, що конструкція несиметрична. 7,8 Несиметричний перехідний стан вимагає, щоб радикальне додавання до кожного вуглецю множинного зв'язку представляло собою чіткий шлях реакції; немає загального проміжного. Крім того, часткове утворення σ‑зв'язку між α-атомом вуглецю та вхідним, центрованим на вуглеці радикалом змушує групи, прикріплені до кожного з цих атомів, приймати рішуче пірамідальне розташування; таким чином, реакція змушує групи, прикріплені до кожного центру, рухатися ближче один до одного.
Фактори, що контролюють регіоселективність
Несиметричний характер структури перехідного стану, показаної на малюнку 1, вимагає, щоб додавання до кожного атома вуглецю несиметрично заміщеного подвійного зв'язку мало різну константу швидкості реакції. Розуміння регіоселективності та додаткових реакцій залежить від правильного аналізу факторів, що контролюють ці дві константи швидкості. «Температурна залежність констант швидкості добре описується рівнянням Арренія k = A exp (- E a/R T). Таким чином, при заданій температурі коливання швидкості з радикальною заміною та підкладкою можуть бути викликані варіаціями частотного коефіцієнта (A) та/або енергії активації (E a). Для багатоатомних радикалів частотні фактори охоплюють вузький діапазон... Отже, велика зміна констант швидкості відбувається головним чином через зміни енергії активації». 8 Основні фактори, що визначають енергію активації [сили зв'язку, стеричні ефекти, стереоелектронні ефекти та полярні ефекти], є тими, які необхідно враховувати при визначенні регіоселективності реакції. 8
1. Сильні сторони облігацій
Характерною рисою багатьох реакцій, схожих за своєю природою, є те, що їх енергії активації (Е а) можна визначити за співвідношенням Еванса—Полані (ур. 4). 8,10 (Відносини Еванса—Полані обговорюються в розділі I.A. глави 7.) У таких ситуаціях розрахунок цих енергій залежить від визначення ентальпії реакції (H r) і встановлення значень для двох констант в еквалайзері 4. Для додавання вуглецецентричних радикалів до подвійних зв'язків С—С значення експериментально визначених констант складають C = 50 кДжмоль -1 і α=0,25, коли E a і H r виражаються в кДжмоль -1. 8,15 Число 0,25 для константи пропорційності α означає, що зміна ентальпії, яка залежить від різниці міцностей розриваються і утворюються зв'язків, повинна бути великою, щоб вона мала значний вплив на енергію активації реакції. Значення 0,25 для α є розумним для реакції з раннім перехідним станом.
.png)
2. Стеричні ефекти
Регібридизація β-атома вуглецю від sp 2 до sp 3 відбувається при радикальному додаванні (екв 1). Необхідне репозиціонування груп, що вимагає ця регібридизація, змушує їх зближувати (тобто викликає групове стиснення) у міру протікання реакції. Будь-який опір груповому стисненню, викликане стеричною перешкодою, підвищує енергію, необхідну для досягнення перехідного стану для реакції. 8—10 Таким чином, перехідний стан стає енергетично складнішим для досягнення, оскільки збільшується стеричний розмір будь-якої з груп, прикріплених до β-атома вуглецю. Подібне стеричне стиснення груп, прикріплених до атома вуглецю, що несуть радикальний центр в додаючому радикалі, також має місце, але ефект повинен бути меншим, оскільки типовий радикальний центр має структуру, яка вже знаходиться на проміжному етапі між sp 2 і sp 3. гібридизація. 8—10
Крім групового стиснення, стеричні взаємодії при перехідному стані виникають також між групами, прикріпленими до β-атома вуглецю, і тими, які пов'язані з додаючим радикалом (рис. 1). Експериментальна підтримка значної взаємодії походить від висновку, що константи швидкості радикального додавання до β-атома вуглецю алкену різко змінюються при введенні на цьому атомі стерильно вимогливих груп. 7,16 У реакціях, представлених в еквалайзері 5 збільшення стеричного розміру групи Y значно зменшується константа швидкості для β додавання. 7 Хоча може бути важко вирішити, наскільки постійне зниження швидкості пояснюється груповим стисненням і наскільки взаємодія між групами на β-атомі вуглецю та вхідному радикалі, константи відносної швидкості, показані в еквалайзері 5, не залишають сумнівів у тому, що стеричні ефекти відіграють важливу роль. при визначенні швидкостей реакцій радикального приєднання. 7
.png)
Оскільки поділ при перехідному стані між додаючим радикалом і α-атомом вуглецю в реакції додавання є значним (рис. 1), розумно очікувати, що будь-яка стерична перешкода за участю α-замісників повинна бути невеликою. 7,16 Константи відносної швидкості, показані в еквалайзері 6, підтримують це очікування, оскільки різка зміна стеричного розміру груп, прикріплених до α-атома вуглецю, має лише невеликий вплив на значення цих констант; найбільші та найменші відрізняються лише коефіцієнтом 4.2. 7
.png)
Стеричні ефекти відіграють більш важливу роль у визначенні регіоселективності реакції приєднання, ніж сильні сторони зв'язків, що розриваються або утворюються. Причина такої ситуації простежується в характері процесу складання. У конкуруючих реакціях, що визначають регіоселективність [тобто додавання або до α, або β атома вуглецю в множинному зв'язку ненасиченої сполуки] розривається і утворюється однакове число і типи зв'язків; отже, різниця в енергіях активації для цих двох має бути невелика. реакції, засновані на міцності зв'язків поодинці.
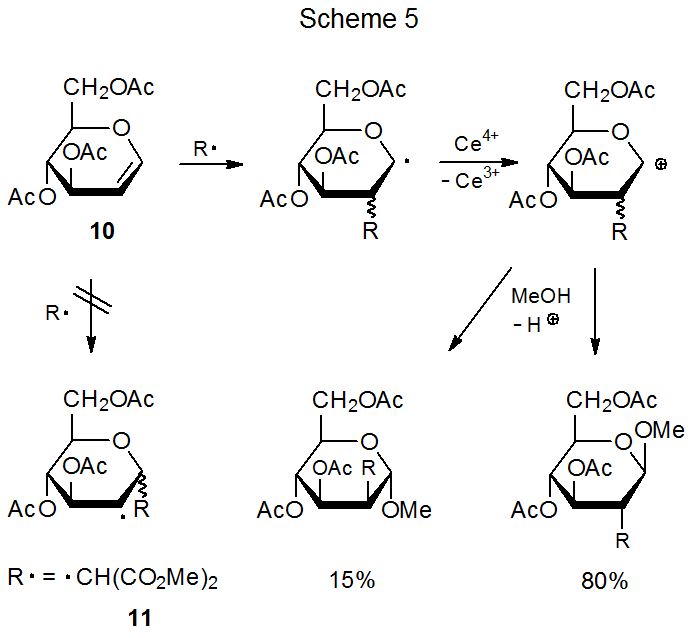
Хоча основна роль стеричних ефектів у визначенні регіоселективності в реакціях радикального приєднання очевидна, ці ефекти не завжди є єдиним визначальним фактором. Наприклад, було б важко пояснити переважне додавання до С-2 в глікалі 10 (схема 5) лише на основі стеричних ефектів, оскільки С-2, якщо що-небудь, більше перешкоджає, ніж С-1. 17-19 Зрозуміло, що інший фактор також впливає на регіоселективність в реакціях цього типу.
3. Полярні ефекти
Полярні ефекти - це вплив на реакційну здатність, викликане нерівномірним розподілом електронів всередині молекули або реактивним проміжним продуктом. У реакціях радикального додавання ці ефекти можуть виникати із замісними групами і можуть передаватися реагуючим атомам або через зв'язки, або через простір. Полярні ефекти також можуть виникати внаслідок делокалізації електронів, що виробляє нерівний розподіл електронів.
Дані, наведені в еквалайзері 7, ілюструють важливість полярних ефектів на реакції радикального приєднання. 7 Ці дані описують відносні константи швидкості додавання нуклеофільного циклогексильного радикала (C 6 H 11 ·) до заміщених α, β-ненасичених ефірів. Константа швидкості велика, коли сильно відводить електрони замісник (наприклад, CN, CO 2 Me) приєднаний до α-атома вуглецю в одному з цих ненасичених ефірів. Вилучення електронів з подвійного зв'язку або CN, або CO 2 Me обумовлено насамперед делокалізацією, яка зміщує електронну щільність до одного з цих α-замісників. У випадку, коли α‑замісник є метоксикарбонільною групою (Z = CO 2 Me), зсув щільності електронів можна побачити в сприяючих резонансних структурах, показаних на малюнку 2. Хоча описані полярні ефекти - це ті, які існують у реагентах, константи швидкості в еквалайзері 7 підтримують ідею, що ці ефекти залишаються значними при перехідному стані.
.png)
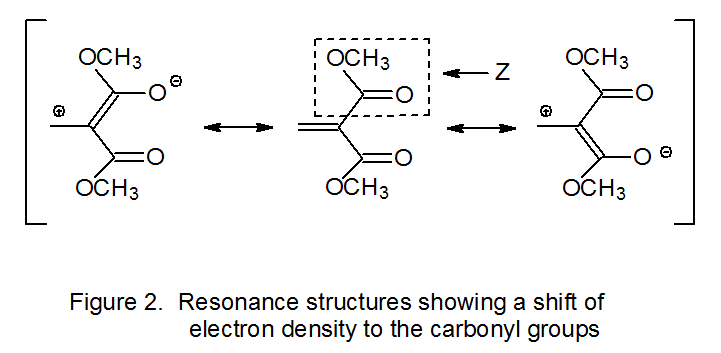
Полярні ефекти не тільки пояснюють різницю в константах швидкості для реакцій, показаних у еквалайзері 7, але й раціоналізують регіоселективність цих реакцій. Резонансний гібрид, зображений на малюнку 2, вказує на знижену електронну щільність у β-атомі вуглецю в подвійному зв'язку вуглецево-вуглецевого ефіру; отже, цей атом являє собою точку тяжіння для нуклеофільного радикала. У такій ситуації можна очікувати регіоселективного додавання β-атома вуглецю. Приклад цього типу додавання показаний на схемі 6, де нуклеофільний вуглеводний радикал 13 додає регіоселективно до β-атома вуглецю α, β-ненасиченого кетону 12. 20

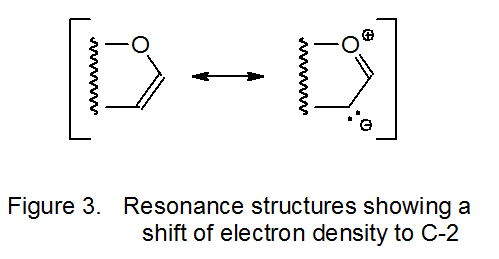
Додавання нуклеофільного радикала до багатої електронами подвійної зв'язку занадто повільне, щоб конкурувати з іншими радикальними реакціями, але якщо радикал електрофільний, відбувається додавання. Диметилмалоніловий радикал 11, наприклад, додає до багатої електронів подвійної зв'язку в D -глюкалі 10 (схема 5). 17-19 Як вказує резонансний гібрид, зображений на малюнку 3, С-2 у 10 має більшу електронну щільність, ніж C-1; таким чином, електрофільний радикал 11 не тільки додає до подвійного зв'язку в 10, але і робить це регіоселективність при С-2 (схема 5).
Оскільки стеричні та полярні ефекти часто сприяють утворенню одного і того ж продукту в реакції радикального додавання (тобто, що від додавання до найменш заміщеного атома вуглецю в подвійному зв'язку ненасиченого реагенту), іноді важко визначити відносний внесок кожного ефекту в регіоселективність реакції. Серія експериментів, призначених для перевірки цих внесків, показана в еквалайзері 8. 7 Перший експеримент передбачає додавання циклогексильного радикала до метилакрилату (екв 8, R = H). У цій реакції як стеричні, так і полярні ефекти сприяють додаванню нуклеофільного циклогексильного радикала до менш заміщеного атома вуглецю в подвійному зв'язку вуглець-вуглець, але оскільки група R стає стерично більшою, регіоселективність реакції зменшується. Для стерично найбільшої групи R сприятливий напрямок додавання фактично змінюється. Повідомлення тут полягає в тому, що стеричні ефекти можуть переповнювати полярні ефекти при встановленні регіоселективності реакції, але стерично досить вимоглива група (наприклад, т- бутилова група) необхідна для подолання сильного полярного ефекту.
.png)
Іншу вказівку на значення полярних ефектів у реакціях радикального приєднання можна побачити, повернувшись до співвідношення Еванса-Полані (ур. 4). Це відношення стосується радикальних реакцій приєднання, в яких полярні фактори не мають значення. Для реакцій, де важливі полярні фактори, енергії активації нижчі, ніж ті, що обчислюються з еквалайзера 4. У таких ситуаціях більш точним є модифіковане рівняння (eq 9), яке включає мультиплікативні члени F n і F e, що відображає нуклеофільні і електрофільні полярні ефекти відповідно. 8,15
.png)
4. Прикордонно-орбітальна взаємодія
Оскільки реакції радикального приєднання мають ранні перехідні стани, 7 прикордонно-орбітальних взаємодій здатні забезпечити альтернативний підхід для пояснення регоселективності реакції. Першим кроком у цьому підході є виявлення прикордонних орбіталів у реакції, що цікавить; наприклад, при додаванні диметилмалонільного радикала 11 до багатої електронами подвійної зв'язку в D -глюкалі 10 (схема 5) первинна взаємодія відбувається між СОМО з 11 і HOMO з 10 (рис. 10 в главі 7). Визначення прикордонно-орбітальних взаємодій у реакції само по собі не пояснює регіоселективність реакції, але орбітальна ідентифікація є найважливішим першим кроком для такого розуміння, оскільки з прикордонних орбіталів надходять атомно-орбітальні коефіцієнти, які складають основу для пояснення регіо вибірковість.
Атомно-орбітальні коефіцієнти цінні при визначенні регіоселективності реакції з раннім перехідним станом, оскільки константа швидкості зв'язоутворюючої реакції між двома атомами в такій реакції значною мірою залежить від величини коефіцієнтів в їх взаємодіючому кордоні. орбіталі. 17,18 У реакції, зображеній на схемі 5, найбільш ефективним є зв'язок між радикалом 11 і С-2 в D-глюкалі 10, оскільки атомний орбітальний коефіцієнт при С-2 для HOMO в 10 більше, ніж у C‑1 (рис. 4); 21 отже, кращим є регіоселективне додавання до С-2. 17,18
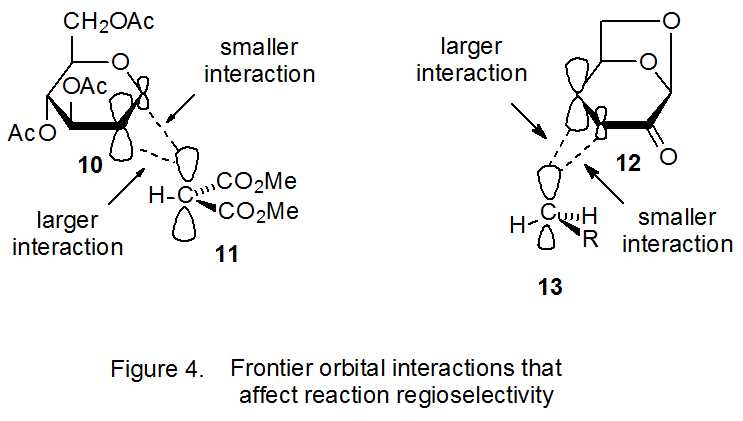
Прикордонно-орбітальні взаємодії також пояснюють регіоселективність у реакції додавання, показаній на схемі 6, де нуклеофільний радикал (13) додається до подвійного зв'язку з дефіцитом електронів. 20 Додавання радикала 13 до С‑4, а не С-3, в α, β-ненасичений кетон 12 не може бути пояснено стеричними ефектами, але прикордонно-орбітальні взаємодії дають основу для розуміння спостережуваної регіоселективності. Найважливіша взаємодія в цьому випадку - між SOMO 13 та LUMO 12. (Обґрунтування того, що це первинна, прикордонно-орбітальна взаємодія наведено в розділі IV.B.1 глави 7) Для LUMO, наприклад, що в 12 найбільший атомний орбітальний коефіцієнт пов'язаний з орбітальною p при C-4 (рис. 4); 21 отже, регіоселективний addi Цій до С-4 є прихильним. 22
5. Аддукт-радикальна стабілізація
Аддуктно-радикальна стабілізація як можливість пояснення регіоселективного приєднання вуглецецентрованого радикала до множинного зв'язку не високо оцінюється, оскільки екзотермічна природа та ймовірний ранній перехідний стан для реакцій радикального приєднання аргументують значний, перехідний стан стабілізація за рахунок розвивається радикала. Докази дослідження модельних сполук, які наводяться на підтримку цієї точки зору, є те, що циклогексильний радикал швидше додає до акролеїну та акрилонітрилу, ніж до стиролу (екв. 10), 7,23, хоча фенільна група ефективніша при стабілізації радикального центру, ніж карбонільна або ціано-група. 7,24 Ця інформація вказує на те, що аддуктно-радикальна стабілізація менш важлива, ніж полярні ефекти при перехідному стані для реакції приєднання; таким чином, полярні ефекти в першу чергу відповідають за відмінності в реактивності ненасичених сполук, відмінності, такі як показані в еквалайзері 10. 7 (Як обговорювалося в розділі II.D.2 і видно в еквалайзері 6, стерична перешкода від α замісників, що використовуються в реакціях, показаних в еквалайзері 10, повинна бути несуттєвою.) Оскільки реакції між електронно-дефіцитними алкенами та нуклеофільними радикалами стабілізуються в перехідному стані полярними ефектами, ці ефекти можуть маскувати менш важливу, аддуктно-радикальну стабілізацію. Кращим тестом важливості аддуктно-радикальної стабілізації на регіоселективному додаванні буде той, при якому полярні ефекти не можуть бути визначальним фактором.
.png)
Реакції додавання, показані в рівняннях 11 і 12, є тими, для яких полярні ефекти повинні бути мінімальними. 10 Подібність відносних швидкостей для двох реакцій вказує на те, що аддуктно-радикальна стабілізація несуттєва при перехідному стані. Ці реакції також підкреслюють складність усунення повністю впливу полярних ефектів при порівнянні радикальних реакцій. Трохи знижена швидкість реакції, показана в еквалайзері 12, порівняно з тим, що в еквалайзері 11, може бути обумовлена ефектом слабо електронно-донорської метильної групи в пропені, зменшуючи в невеликій мірі швидкість додавання нуклеофільного радикала до трохи більш багатої електронів подвійного зв'язку. (Як згадувалося в розділі 7 Розділи III.C. та III.E., немає повної згоди щодо нуклеофільності метилового радикала.)
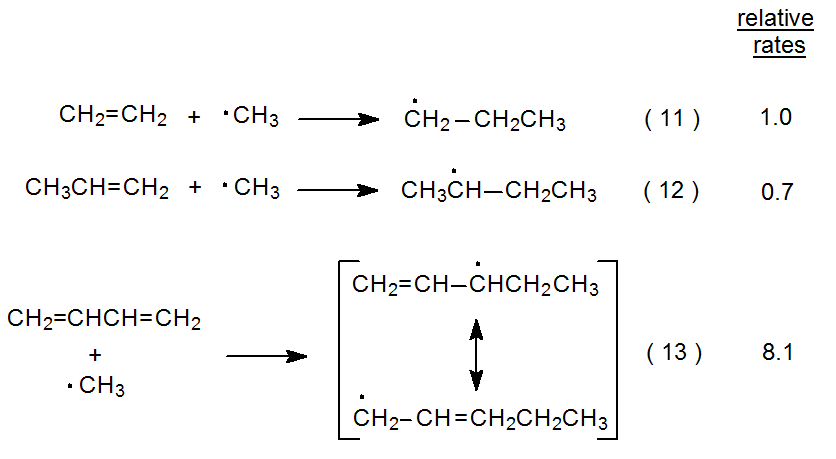-(13).png)
Реакція, показана в еквалайзері 13, підтримує думку про те, що стабільність розвивається радикала може бути фактором зниження енергії перехідного стану. 10 Більша швидкість цієї реакції, порівняно з показаними в рівняннях 11 і 12, може бути пояснена резонансною стабілізацією в розвивається радикалі, що значно сприяє стабілізації перехідного стану. Обмежені дані в рівняннях 11-13 узгоджуються з ідеєю, що аддуктно-радикальна стійкість є лише фактором реакцій радикального додавання, коли така стабілізація значна. Ще раз, однак, полярні ефекти затьмарюють цю інтерпретацію. 1,3-бутадієн можна розглядати як молекулу, в якій кожен подвійний зв'язок має приєднаний етеніловий замінник. Такий замісник повинен бути електронно-відводящим або, принаймні, менш електронно-донорським, ніж метильна група; отже, подвійні зв'язки в 1,3-бутадієні повинні бути більш реактивними по відношенню до метильного радикала, ніж подвійний зв'язок в пропені. Ця різниця могла б пояснити, принаймні частково, різницю у відносних швидкостях реакцій, показаних у еквалайзерах 12 та еквалайзері 13.