ІІІ. Реакції внутрішньомолекулярного додавання (циклізації)
- Page ID
- 27557

Крім опису реакцій циклізації за розміром виробленого кільця, терміни exo і endo вказують спосіб формування кільця. Значення цих термінів проілюстровано в реакціях, показаних на схемі 8. Коли термінологія екзо/ендо використовується для опису утворення кільця від реакції 5-гексенільного радикала, п'ятичленне кільце розглядається як виникає внаслідок екзо-закриття, а шестичленне - від закриття ендо (Схема 7).

2. Перехідно-державна структура
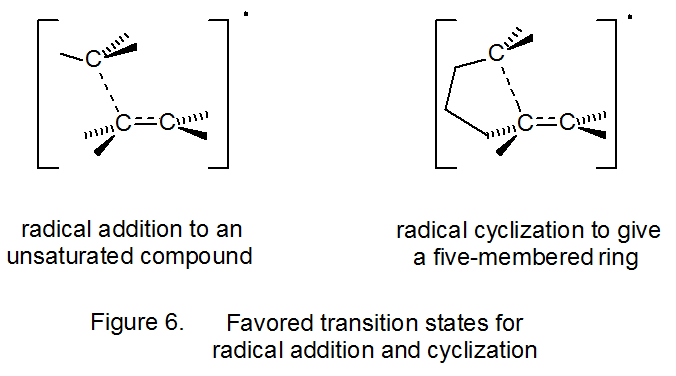
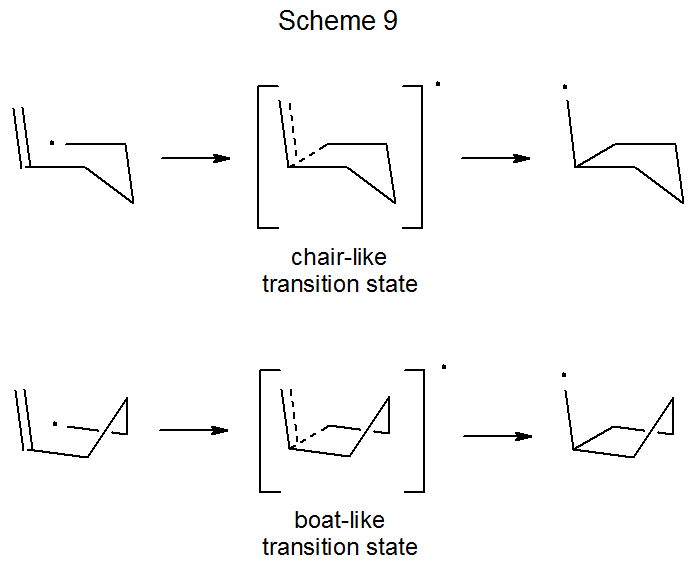
Структури перехідного стану для радикального складання і радикальної циклізації наведені на малюнку 6 в загальному вигляді. Для реакцій циклізації не тільки розмір кільця, але й кільцева конформація впливають на енергію перехідного стану; таким чином, при п'ятичленному кільцевому формуванні можливі як стільчасті 2 5,27, так і човноподібні структури 27,30. Для незаміщеного 5-гексеніл-радикала кріслоподібний перехідний стан, що веде до п'ятичленного кільця, обчислюється як нижчий за енергією, але лише трохи так, ніж човноподібний перехідний стан (схема 9). 27 (Взаємодії «флагштока», які сприяють тому, щоб зробити конформацію циклогексану човна набагато менш стабільною, ніж конформація стільця, менш важкі в човноподібному перехідному стані для радикальної циклізації.) Обидва перехідні стани (човноподібні та стільцеві), що ведуть до п'ятичленного кільця (Схема 9), обчислюються, щоб бути нижчими за енергією, ніж будь-які перехідні стани, що ведуть до шестичленного кільця. Ці розрахунки добре відповідають експериментальному спостереженню, що циклізація 5-гексенілового радикала дає п'ятичленне кільце високо регіоселективним способом (екв 14, R = H). 25,31
.png)
3. Зміна нормальної регіоселективності
a. стеричні взаємодії та аддуктно-радикальна стабільність
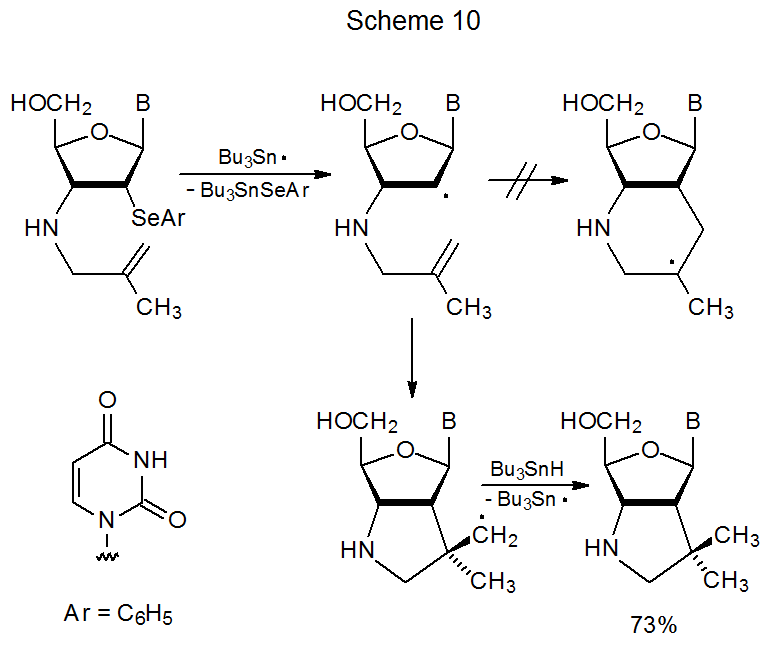
Хоча розмір кільця є основним фактором, що впливає на регіоселективність в реакціях циклізації, інші фактори іноді надають модифікуючу дію; наприклад, в реакції 5-метил-5-гексеніл-радикала присутність метильної групи збільшує кількість шестичленного кільцеутворення (екв 14, R = СН 3). 25,27 У цій реакції стеричні ефекти та аддуктивно-радикальна стабільність обидва сприяють шестичленному кільцю. Перехідний стан у цій реакції імовірно досягається досить пізно, що або стеричні ефекти, або аддуктно-радикальна стабільність, або обидва мають істотний вплив на регіоселективність. Передбачити, коли перехідний стан при цьому типі реакції буде досить рано, щоб викликати високорегоселективне формування п'ятичленного кільця, непросто. У реакції, показаній на схемі 10, де стеричні взаємодії та аддуктно-радикальна стабільність сприяють утворенню шестичленного кільця принаймні стільки, скільки вони роблять у реакції, показаної в еквалайзері 14 (R=CH 3), утворюється лише твір з п'ятичленним кільцем. 32
б. термодинамічне управління
Хоча кінетично керована реакція є нормою при радикальній циклізації, термодинамічний контроль спостерігається в реакції, показаної в еквалайзері 15, де субстратом є ненасичений силіловий ефір, а донор водню (Bu 3 SnH) підтримується на низькому рівні. 33 Коли ця реакція проводиться з високою концентрацією Bu 3 SnH, кінетично кероване, п'ятичленне утворення кільця є основним шляхом реакції. Пояснення цієї залежності від концентрації водень-донор починається з циклічності радикала 18 до утворення 19, радикала з новим п'ятичленним кільцем (схема 11). Якщо концентрація Bu 3 SnH висока, абстрагування атомом водню швидко завершує реакцію, але якщо концентрація донора низька, перебудова до більш стабільного радикала 20 через перехідний стан 21 відбувається до того, як може відбутися абстрагування атомом водню. 34 Абстракція атома водню на 20 потім дає термодинамічно сприятливий продукт. Альтернативний механізм цієї реакції, також показаний на схемі 11, полягає в тому, що кільцевий отвір 19 виробляє кремнієво-центрований радикал, який піддається кільцевому закриттю, щоб дати проміжний радикал 20. 35
.png)

c. розворот через стереохімію
Одна з ситуацій, коли шестичленне утворення кільця сприятливо підтримується послідовно над реакцією, що виробляє п'ятичленне кільце, полягає в тому, коли циклізація призведе до створення пари транс-плавлених п'ятичленних кілець. Реакції йодидів 22 і 23 ілюструють вплив, який може мати стереохімія на радикальну циклізацію. Ациклічний йодид 22 зазнає очікуваної циклізації, щоб дати п'ятичленне кільце (Схема 12), 36 але реакція йодиду 23 утворює шестичленне кільце (схема 13). 37 Оскільки транс-синтез між двома п'ятичленними кільцями призведе до сильно напруженого радикала 25, стереохімія радикала 24 диктує регіоселективність реакції циклізації. Шестичленне утворення кілець також відбувається в реакції, показаної на схемі 14 38, знову ж таки, тому що інший варіант змусить формування транс-плавлених п'ятичленних кілець.


