2.3: Функціональні групи
- Page ID
- 24710
Функціональні групи є найбільш реактивними частинами в органічних сполуках, і визначають основні властивості сполук. Короткий зміст загальних функціональних груп включено в таблицю 2.2. Добре знання функціональних груп - одна з основних навичок, необхідних для цього курсу. Вона потрібна для того, щоб студенти могли швидко ідентифікувати і назвати функціональні групи, що входять до складу молекул, а також чітко розуміти, інтерпретувати і малювати конкретну структуру кожної функціональної групи. Також потрібно називати IUPAC сполук, що містять пару функціональних груп.


Алкени та алкіни є вуглеводневими функціональними групами; π зв'язок у декількох зв'язках припадає на реакційну здатність алкенів та алкінів.
Бензольні кільця (С 6 Н 6) - особливий вид вуглеводнів. Історично склалося так, що через особливого аромату (солодкого запаху), який виділяють бензол і його похідні, їх називають ароматичними сполуками. Структура бензолу може бути представлена у вигляді трьох подвійних зв'язків C = C, що чергуються з одиночними зв'язками, однак фактична структура бензолу не має нічого спільного з алкенами. Детальні обговорення структури бензолу, який є великою системою кон'югації, та хімічні визначення ароматичного/ароматичного характеру будуть темою органічної хімії II. Бензольні кільця можуть бути показані за допомогою будь-якого з наступних креслень конструкції.


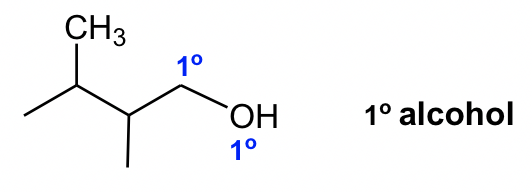
Алкоголь - функціональна група, з якою ви напевно знайомі. В органічній хімії термін спирт відноситься до з'єднання, що містить OH (гідрокси) групу. Залежно від положення групи OH спирти також можна класифікувати як первинні (1°), вторинні (2°) або третинні (3°).
Ще однією функціональною групою, яка містить атом кисню в одиночних зв'язках, є ефір. В ефірі атом O з'єднується з двома вуглецевмісними R групами через дві C-O σ зв'язки. Для сполук з ефіром як єдиною функціональною групою його зазвичай називають загальною назвою «алкілалкіловий ефір». Коли дві алкільні групи однакові, їх можна об'єднати як «діалкіл».

Ефір може бути в циклічній структурі, а також. Можливо, не так інтуїтивно розпізнавати наступну структуру як ефір, і маркування атома вуглецю буде корисним для ідентифікації.
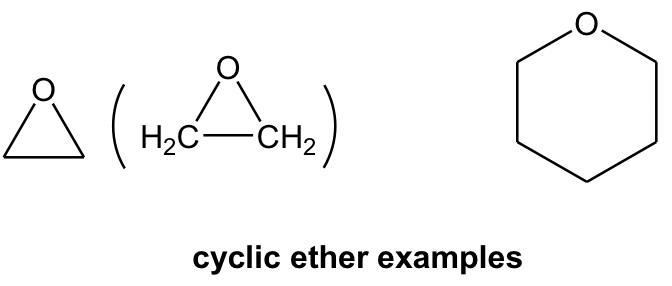
І нітрилові, і нітрогрупи містять атом азоту, і їх може бути легко змішати. Нітрил має потрійний зв'язок CN, і тому може бути лише в кінці конструкції, тоді як нітро (NO 2) може знаходитися в будь-якому положенні на вуглецевому ланцюзі або кільці.
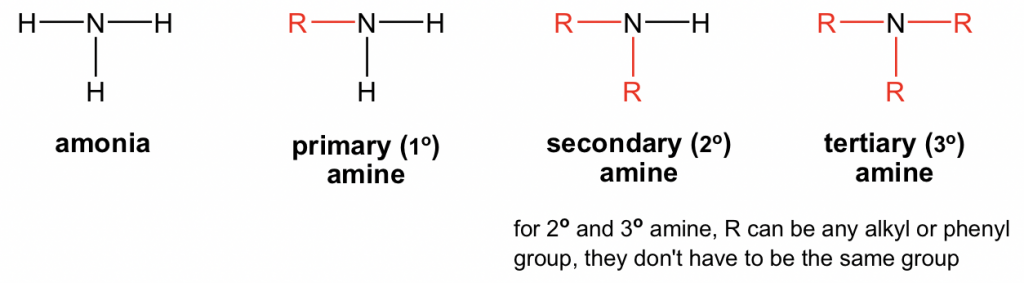
Амін є органічним похідним аміаку, NH 3. Коли атом (и) водню в NH 3 замінюється групами R, він виробляє амін. Амін може бути первинним (1°), вторинним (2°) або третинним (3°) залежно від того, скільки R груп з'єднано з азотом. Аміни також можуть називатися загальними назвами.
Для функціональних груп по 2-й частині таблиці 2.2 всі вони мають спільну структурну одиницю карбонільної групи С=О; різна структура «W» в загальній формулі визначає характер функціональної групи. Як правило, складніше визначити та намалювати ці функціональні групи правильно, оскільки вони схожі. Потрібна більше практики.

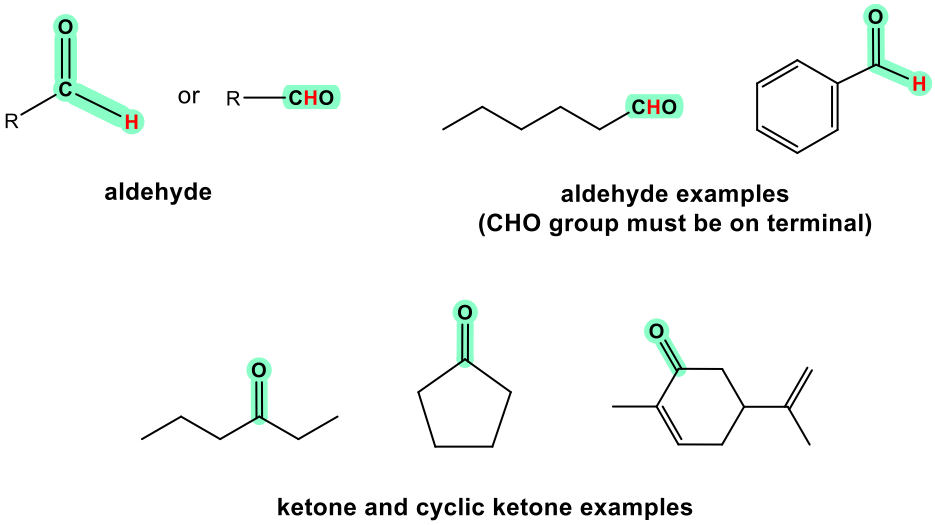
Альдегід і кетон схожі за своєю структурою і властивостями. Альдегід можна розглядати як окремий випадок кетону, оскільки «Н» можна розглядати як R з нульовим вмістом вуглецю. Оскільки Н повинен бути з'єднаний з одного боку групи C = O в альдегіді, альдегід може бути лише в кінці структури. Кетон, з іншого боку, повинен знаходитися в середньому положенні, щоб забезпечити обидві сторони груп C = O пов'язані з групами R. Кетон також може перебувати в циклічній структурі.
Останні чотири функціональні групи пов'язані між собою за структурою і хімічними властивостями. Коли група OH пов'язана з C = O, вся СООН називається функціональною групою карбонової кислоти. Інші три, ефір, ангідрид та амід, є похідними карбонової кислоти, тобто їх можна приготувати з карбоновою кислотою як вихідним матеріалом. Для цих трьох функціональних груп важливо пам'ятати, що «W» частина повинна розглядатися разом з C = O, і загалом вона визначає функціональну групу правильно. Наприклад, COOR - це ефір; його не можна визнати як «кетон» плюс «ефір».

