2.1: Структури алкенів
- Page ID
- 24709
2.1.1 Структури та різні структурні формули
Алкан - найпростіший вуглеводневий з єдиними зв'язками С-С. Алкан ланцюга відповідає загальній формулі C n H 2n+2 (n: натуральне число), а кількість атомів Н досягає максимального рівня в ланцюгових алканах. Назви і структури прямоланцюгових алканів до десяти вуглеців наведені в таблиці нижче.
| Кількість вуглецю | Ім'я |
Формула (С н Н 2н+2) |
Конденсована структура |
| 1 | метан | СН 4 | СН 4 |
| 2 | етану | С 2 Ч 6 | СН 3 СН 3 |
| 3 | пропан | С 3 Ч 8 | СН 3 СН 2 СН 3 |
| 4 | бутан | З 4 Ч 10 | СН 3 СН 2 СН 2 СН 3 |
| 5 | пентан | З 5 Ч 12 | СН 3 СН 2 СН 2 СН 2 СН 3 |
| 6 | гексан | С 6 Ч 14 | СН 3 СН 2 СН 2 СН 2 СН 2 СН 3 |
| 7 | гептан | С 7 Ч 16 | СН 3 СН 2 СН 2 СН 2 СН 2 СН 2 СН 3 |
| 8 | октан | З 8 Ч 18 | СН 3 СН 2 СН 2 СН 2 СН 2 СН 2 СН 2 СН 3 |
| 9 | нонан | З 9 Ч 20 | СН 3 СН 2 СН 2 СН 2 СН 2 СН 2 СН 2 СН 2 СН 3 |
| 10 | декан | С 10 Ч 22 | СН 3 СН 2 СН 2 СН 2 СН 2 СН 2 СН 2 СН 2 СН 2 СН 3 |
Таблиця 2.1 Назви та структури прямоланцюгових алканів
Первинними джерелами алканів є природний газ і нафта. Природний газ містить переважно метан (70-90%) і деяку частину етану. Переробка нафти розділяє сиру нафту на різні фракції і кожна фракція складається з алканів однакової кількості вуглецю. Пропан та бутан є поширеними видами палива в газових пальниках пропану та запальничках. Алкани з вуглецями від 5 до 8 є основними компонентами бензину, тоді як дизель містить алкани в діапазоні від 9 до 16 вуглецю. Зі збільшенням кількості вуглеців температура кипіння і в'язкість алканів збільшуються.
Існує безліч форматів, щоб показати структурні формули органічних сполук, важливо вміти розпізнавати різні креслення формул та правильно використовувати їх для представлення структур.
Структура кекула
Ми провели деякі обговорення структур Кекуле в розділі 1.2.4. Вони схожі на структури Льюїса з усіма сполучними електронами, показаними короткими лініями, і всіма атомами, включеними як символи елементів. Однак електрони однієї пари залишаються поза увагою в структурах Кекуле, що є основною відмінністю між структурами Кекуле органічної сполуки та структурами Льюїса.

Формула конденсованої структури
У формулах конденсованої структури зв'язки C-H опускаються, і всі атоми Н, прикріплені до певного вуглецю (або інших атомів), зазвичай показані як група, така як CH 3, CH 2, NH 2, OH. Структури в таблиці 2.1 наведені у вигляді конденсованих структур. Зв'язок C-C іноді може бути опущений, а також (як для 2-метилпропану та 2-гексанолу в прикладах нижче). Зазвичай, якщо структура має відгалуження, зв'язок між батьківською структурою з гілкою потрібно показати короткою лінією. Швидше намалювати структуру з формулою конденсованої структури, і структура не виглядає такою громіздкою, як структури Кекуле.

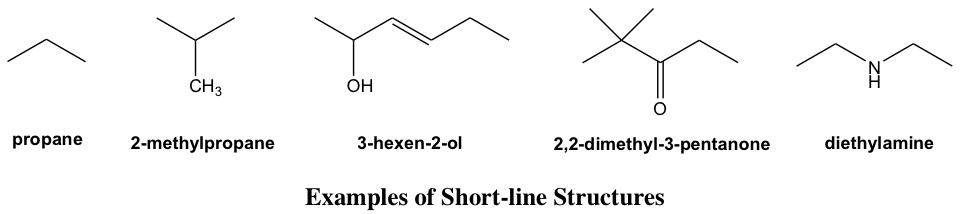
Формула структури короткої лінії
Малюнок структури може бути додатково спрощений за допомогою короткої лінії структури (або «структура лінії зв'язку», «скелетна формула» в інших книгах) з більшістю атомів опущені, це також дуже поширений тип формули структури, що використовується в органічній хімії через її простоту. Щоб правильно застосовувати та інтерпретувати структури короткої лінії, дуже важливо чітко розуміти умовності цього типу малюнка.
- Кожна коротка лінія являє собою зв'язок.
- Вуглецеві ланцюги показані зигзагоподібним способом.
- Атоми вуглецю не відображаються (як виняток, необов'язково показувати групу CH 3 в кінці ланцюга або як гілку); кожен вигин у лінії або кінцевій лінії являє собою атом вуглецю, якщо інший атом не показаний явно.
- Атоми водню, пов'язані з вуглецями, не показані; атоми водню, пов'язані з іншими атомами, показані явно.
- Атоми, відмінні від C і H, наприклад N, O, Cl, потрібно показувати явно.
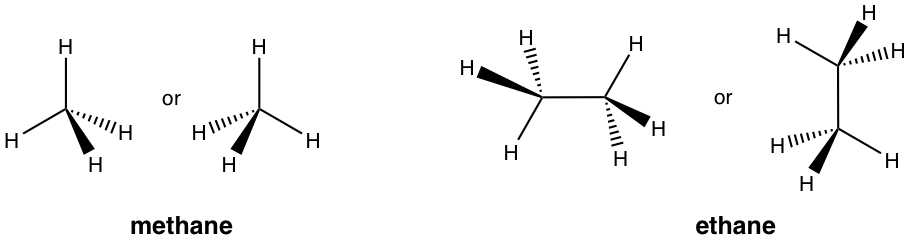
Перспективна формула тривимірної структури
Коли необхідно виділити просторове розташування груп навколо чотиригранного вуглецю sp 3 для цілей конформації (глава 4) або стереохімії (глава 5), використовується формула перспективи з твердими та пунктирними клинами. З чотирьох зв'язків на чотиригранному вуглеці дві зв'язки лежать в паперовій площині і показані як звичайні лінії, твердий клин являє собою зв'язок, який вказує на паперову площину, а пунктирний клин являє собою зв'язок, який вказує позаду паперової площини.
2.1.2 Конституційні ізомери
Для метану, етану та пропану існує лише один спосіб розташування вуглецю. Оскільки кількість вуглецю збільшується до 4 вуглеців, існує два способи з'єднання атомів вуглецю: один як прямий ланцюг (синя структура внизу), а інший як гілка на ланцюзі (червона структура внизу).
| Два конституційних ізомери з формулою C 4 H 10 | |

|
|
| Бутан |
Ізобутан (i-бутан) «iso» означає «ізомерний» |
|
б.п. = 0 °C |
б.п. = -12 °C |
| щільність: 0,622 г/мл | щільність: 0,604 г/мл |
Як ми бачимо, ці дві різні структури являють собою дві різні сполуки, з різними назвами та різними фізичними властивостями; однак вони обидва мають однакову формулу C 4 H 10, і їх називають конституційними (структурними) ізомерами. Конституційні (Структурні) ізомери - це різні сполуки з однаковою молекулярною формулою, але їх атоми розташовані в іншому порядку. (Тобто атоми пов'язані різними способами.)
Давайте подивимося більше прикладів конституційних ізомерів.
Для алканів з 5 вуглецями існує загалом три конституційні ізомери. Перевірте примітки, крім того, для стратегії побудови конституційних ізомерів.


Вправи 2.1
Намалюйте всі конституційні ізомери за формулою С 7 Н 16.
Відповіді на практичні питання Глава 2
Конституційні ізомери, які ми маємо до цих пір, мають різну довжину вуглецевих «хребтів», а також називаються скелетними конституційними ізомерами. Інші можливі ситуації включають позиційні та функціональні конституційні ізомери, з якими ми зіткнемося пізніше.
Зі збільшенням кількості вуглецю кількість конституційних ізомерів різко зростає. Для прикладу алканів з 20 вуглецями, тобто C 20 H 42, існує 366,319 конституційних ізомерів. Хоча не існує простої формули, що дозволяє передбачити загальну кількість ізомерів для певної кількості вуглецю, явища конституційних ізомерів частково пояснюють високу різноманітність органічних структур.
2.1.3 Визнання 1 °, 2 °, 3 °, 4 ° вуглецю
Атоми вуглецю в органічній структурі можна класифікувати як первинні (1°), вторинні (2°), третинні (3°) та четвертинні (4°), залежно від того, скільки інших вуглеців він з'єднується з. Зокрема:
- Первинний (1°) вуглець: прикріплений безпосередньо лише до одного іншого атома С;
- Вторинний (2°) вуглець: приєднаний безпосередньо до двох інших атомів С;
- Третинний (3°) вуглець: приєднаний безпосередньо до трьох інших атомів С;
- Четвертинний (4°) вуглець: приєднаний до чотирьох інших атомів С.
Атоми водню, прикріплені до вуглецю 1°, 2° та 3°, маркуються як 1°, 2° та 3° водню відповідно.

В одній сполуці вуглеці (або водні), які належать до різної категорії, виявляють різні структурні та реактивні властивості. Ця концепція має набагато більше застосувань у наступних розділах.
